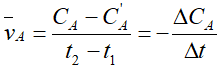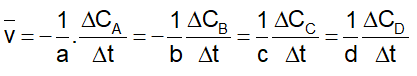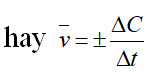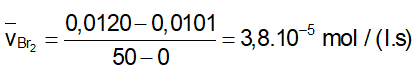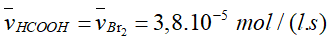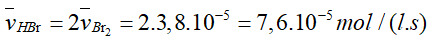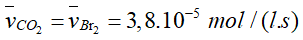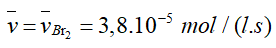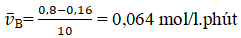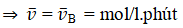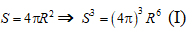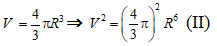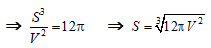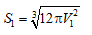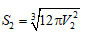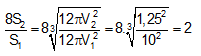3 dạng bài tập Tốc độ phản ứng trong đề thi Đại học có lời giải - Hoá học lớp 10
3 dạng bài tập Tốc độ phản ứng trong đề thi Đại học có lời giải
Với 3 dạng bài tập Tốc độ phản ứng trong đề thi Đại học có lời giải Hoá học lớp 10 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Tốc độ phản ứng từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Dạng 1: Tốc độ phản ứng
Phương pháp giải
Xét phản ứng tổng quát: aA+ bB → cC + dD.
Thời điểm t1: CA CB CC CD
Thời điểm t2: C'A C'B C'C C'D
* Nồng độ phản ứng của A là ΔCA = Ca - C'A
Nồng độ tạo thành của C là ΔCC = C'C - CC
* Tốc độ trung bình tham gia phản ứng của A là :
(Dấu trừ biểu thị nồng độ giảm của chất tham gia phản ứng)
* Tốc độ trung bình của phản ứng :
* Ngoài ra vận tốc còn được biểu diễn theo công thức sau:
mA + nB → pC + qD
Biểu thức vận tốc: v = k [A]m[B]n
k: hằng số tỉ lệ (hằng số vận tốc).
[A], [B]: nồng độ mol của chất A và B

Dạng 1.1: Tính tốc độ phản ứng
Ví dụ minh họa
Ví dụ 1: Trong thí nghiệm oxi hoá axit fomic xảy ra phản ứng sau:
Br2+ HCOOH → 2HBr + CO2
Lúc ban đầu Br2 là 0,0120 mol/l, sau 50 giây nồng độ là 0,0101 mol/l. Hãy xác định:
- Tốc độ trung bình tham gia phản ứng của Br2, HCOOH.
- Tốc độ trung bình tạo thành của HBr và CO2.
- Tốc độ trung bình của phản ứng.
Hướng dẫn giải:
Xét phản ứng:
Br2 + HCOOH → 2HBr + CO2
t1 = 0: 0,0120 (M)
t2 = 50s: 0,0101 (M)
- Tốc độ trung bình tham gia phản ứng của Br2
- Tỉ lệ tham gia phản ứng của Br2 và HCOOH là 1: 1 nên tốc độ trung bình tham gia phản ứng của HCOOH là:
- Tỉ lệ trong phương trình của Br2 với HBr là 1: 2 nên tốc độc trung bình tạo thành của HBr là:
- Tỉ lệ trong phương trình của Br2 với CO2 là 1: 1 nên tốc độ trung bình tạo thành của CO2 là:
- Do hệ số cân bằng của Br2 là 1 nên:
Ví dụ 2: Cho phản ứng hóa học: A + B → C
Nồng độ ban đầu của A là 1 mol/l, của B là 0,8 mol/l. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng là
A. 0,16 mol/l.phút
B. 0,016 mol/l/phút
C. 1,6 mol/l.phút
D. 0,064 mol/l.phút
Hướng dẫn giải:
CB sau = 0,8.20% = 0,16 (mol/l)
Vì hệ số của B là 1
⇒ Đáp án D
Dạng 1.2: Xác định nồng độ chất ban đầu hoặc sản phẩm

Ví dụ minh họa
Ví dụ 1: Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng :
N2 (k) + 3H2 (k) ↔ 2NH3 (k)
Sau một thời gian, nồng độ các chất trong bình như sau: [N2] = 2M; [H2] = 3M; [NH3] = 2M. Nồng độ mol/l của N2 và H2 ban đầu lần lượt là :
A. 3 và 6. B. 2 và 3.
C. 4 và 8. D. 2 và 4.
Hướng dẫn giải:
Do ban đầu chỉ có N2, H2 nên lượng NH3 trong hỗn hợp sau là sản phẩm được sinh ra trong phản ứng N2 và H2 → từ nồng độ của NH3 xác định được nồng độ phản ứng của H2 và N2.
N2 (k) + 3H2 (k) ↔ 2NH3 (k)
Bđ (C0): x y
Pư: 1M ← 3M ← 2M
Cb: 2M 3M 2M
Ta có: C0N2 = CCB + Cpư ⇒ x = 2 + 1 = 3(M)
C0 H2 = CCB + Cpư = 3 + 3 = 6 (M)
⇒ Đáp án A
Ví dụ 2: Trong công nghiệp người ta điều chế NH3 theo phương trình hoá học:
N2 (k) + 3H2 (k) ↔ 2NH3 (k)
Khi tăng nồng độ H2 lên hai lần (giữ nguyên nồng độ của N2 và nhiệt độ phản ứng) thì tốc độ phản ứng tăng lên bao nhiêu lần?
A. 2 lần B. 4 lần
C. 8 lần D. 16lần
Hướng dẫn giải:
Giả sử ban đầu [N2] = aM. [H2] = bM
Tốc độ phản ứng ban đầu: v1 = k[N2][H2]3 = k.a.b3
Tốc độ phản ứng lúc sau: v2 = k[N2][H2]3 = k.a.(2b)3 = 8 k.a.b3
⇒v2 = 8 v1.
⇒ Đáp án C
Dạng 1.3: Mối liên hện giữa diện tích tiếp xúc và tốc độ phản ứng
Ví dụ minh họa

Ví dụ 1: Nếu chia một mẩu đá vôi hình cầu có thể tích 10,00 cm3 thành tám mẩu đá vôi hình cầu thể tích bằng 1,25 cm3 thì tổng điện tích mặt cầu tăng bao nhiêu lần:
A. 2 lần B. 4 lần
C. 8 lần D. 16lần
Hướng dẫn giải:
- Các mẩu đá vôi là hình cầu nên :
Diện tích bề mặt tiếp xúc là:
Thể tích là :
- Mẩu đá vôi ban đầu có:
Mẩu đá vôi sau khi chia nhỏ có:
- Tỉ lệ diện tích bề mặt sau khi chia thành 8 mẩu đá vôi là:
⇒ Diện tích bề mặt tăng 2 lần
⇒ Đáp án A