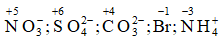Bài tập hóa trị và số oxi hóa - Hoá học lớp 10
Bài tập hóa trị và số oxi hóa
Với Bài tập hóa trị và số oxi hóa Hoá học lớp 10 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập hóa trị và số oxi hóa từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Lý thuyết và Phương pháp giải
Đối với hợp chất hữu cơ, số oxi hóa của C trong HCHO được tính là số oxi hóa trung bình; hoặc xem số oxi hóa của C là tổng đại số các số oxi hóa của các nguyên tử khác mà nó liên kết.
Chẳng hạn: Trong CH3 – CH2OH:
Số oxi hóa trung bình của C là: -2
Còn số oxi hóa của C trong CH3 là: -3 và trong CH2OH là -1.
Ví dụ minh họa

Ví dụ 1. Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Hướng dẫn:
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+, NO2- , và HNO3
Ta có: x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2- là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
⇒ Chọn B.
Ví dụ 2. Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Hướng dẫn:
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Ví dụ 3. Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3 B. 3 và +5
C. 5 và +5 D. 3 và -3
Hướng dẫn:
N thuộc nhóm IVA nên có hóa trị 4
Số OXH: x + 4.1 + (-1)=0 ⇒ x = -3.
Ví dụ 4. Xác định số oxi hóa của các nguyên tố trong phân tử và ion sau: CO2, H2O, SO3, NH3, NO2, Na+, Cu2+ , Fe2+ , Fe3+, Al3+
Hướng dẫn:
Áp dụng quy tắc xác định số oxi hóa:
+) Phân tử: 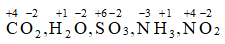
+) Ion: Số oxi hóa của Na+ , Cu2+, Fe2+ , Fe3+, Al3+ lần lượt là: +1, +2, +2, +3, +3

Ví dụ 5. Xác định số oxi hóa của Mn, Cr, Cl, P trong phân tử: KMnO4 , Na2Cr2O7, KClO3, H3PO4
Hướng dẫn:
Số oxi hóa của Mn, Cr, P: 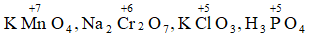
Ví dụ 6. Xác định điện hóa trị của các nguyên tố trong các hợp chất sau: KCl, Na2S; Ca3N2.
Hướng dẫn:
Hóa trị của một nguyên tố trong hợp chất ion gọi là điện hóa trị và bằng điện tích ion đó.
+) KCl: Điện hóa trị của K là: 1+ và của Cl là: 1-
+) Na2S: Điện hóa trị của Na là: 1+ và của S là: 2-
+) Ca3N2: Điện hóa trị của Ca là: 2+ và của N là: 3-
Ví dụ 7. Xác định số oxi hóa của cacbon trong mỗi phân tử sau:
CH3 – CH3; CH2= CH2; CH≡ CH; CH2 =CH-C≡CH;
CH3 – CH2OH; CH3 – CHO; CH3- COOH; CH3COOCH =CH2;
C6H5 – NO2; C6H5 – NH2
Hướng dẫn:
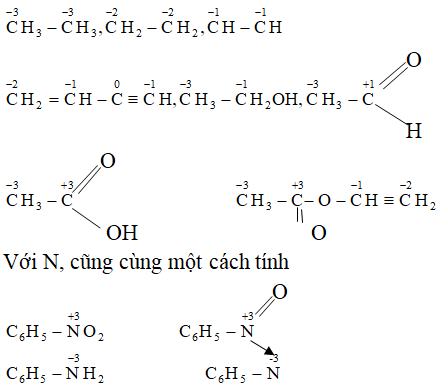
Ví dụ 8. Xác định số oxi hóa của N, S, C, Br trong ion: NO3-, SO42- ; CO32- , Br, NH4+
Hướng dẫn:
Số oxi hóa của N, S, C, Br: