Tổng hợp Lý thuyết chương Phản ứng oxi hóa, khử - Hoá học lớp 10
Tổng hợp Lý thuyết chương Phản ứng oxi hóa, khử
Tài liệu Tổng hợp Lý thuyết chương Phản ứng oxi hóa, khử Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Phản ứng oxi hóa, khử từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

Lý thuyết Phản ứng hóa học - Phân loại phản ứng trong hóa học vô cơ
- Tóm tắt lý thuyết Hóa học 10 chương 4
Lý thuyết Phản ứng hóa học - Phân loại phản ứng trong hóa học vô cơ
I. Phản ứng hóa học là gì ?
1. Phản ứng hóa học là gì?
- Phản ứng hóa học là quá trình biến đổi từ chất này sang chất khác.
- Chất bị biến đổi trong phản ứng là chất phản ứng hay chất tham gia.
- Chất mới sinh ra là sản phẩm.
- PT chữ của phản ứng hóa hoc:
Tên các chất tham gia → Tên các sản phẩm.
- Cách đọc phương trình chữ của PƯHH:
• Dấu “+” sau phản ứng đọc là “và”
• Dấu “ → ” đọc là “tạo thành” hay “tạo ra” hoặc “phân hủy ra”
• Dấu “+” ở trước phản ứng đọc là “tác dụng với” hay “phản ứng với”
VD1: Hãy đọc các phương trình chữ sau:
a. Sắt + lưu huỳnh → Sắt (II) sunfua.
“Sắt tác dụng với lưu huỳnh tạo thành sắt hai sunfua”
b. Đường → nước + than
“Đường phân hủy thành nước và than”
c. Than + oxi → khí cacbonic
“Than phản ứng với oxi tạo thành khí cacbonic”
d. Kẽm + axit → Kẽm clorua + khí hiđro
“Kẽm tác dụng với axit tạo ra kẽm clorua và khí hiđro”
VD2. Hãy viết phương trình chữ khi cây nến cháy (biết nến là parafin)?
Hướng dẫn: Parafin + oxi → cacbonic + nước
- Trong quá trình phản ứng lượng chất tham gia giảm dần còn lượng chất sản phẩm tăng dần.
2. Diễn biến của phản ứng hóa hoc
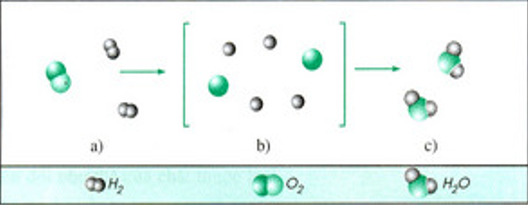
Từ sơ đồ phản ứng hóa học giữa hiđro và oxi tạo thành nước ta thấy : Trong phản ứng hóa học chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
Lưu ý:
- Nếu có đơn chất kim loại tham gia phản ứng thì sau phản ứng nguyên tử kim loại phải liên kết với nguyên tử của nguyên tố khác.
- Nếu đơn chất là kim loại thì nguyên tử kim loại sẽ tham gia phản ứng.
3. Điều kiện để có phản ứng hóa học xảy ra
- Chất tham gia phản ứng tiếp xúc nhau.
- Có thể cần có nhiệt độ.
- Có thể cần xúc tác thích hợp.
4. Dấu hiệu có thể nhận biết phản ứng hóa học xảy ra.
- Có thể thay đổi màu sắc, trạng thái, mùi.
- Tỏa nhiệt, thu nhiệt hoặc phát sáng.
- Tạo ra kết tủa, bay hơi, hoặc đổi màu.
II. Các loại phản ứng hóa học
a/ Phản ứng hoá hợp
4P + O2 → P2O5
Là phản ứng hóa học, trong đó 2 hay nhiều chất hóa hợp với nhau tạo thành một chất mới.
Tгопg phản ứng hoá hợp, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
b/ Phản ứng phân huỷ
2Fe(OH) 3 → Fe2 O3 + 3H2 O
Là phản ứng hóa học, trong đó một chất bị phân hủy thành 2 hay nhiều chất mới
Trong phản ứng phân huý, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thav đổi.
c/ Phản ứng thế
Là phản ứng hóa học, trong đó nguyên tử của nguyên tố này ở dạng đơn chất thay thế nguyên tử của nguyên tố khác trong hợp chất
Fe + HCl → FeCl2 + H2
Trong hoá học vô cơ, phản ứng thế bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố.
d/ Phản ứng trao đổi
Là phản ứng hóa học, trong đó các hợp chất trao đổi nguyên tử hay nhóm nguyên tử với nhau
Trong phản ứng trao đổi, số oxi hoá của các nguyên tố không thay đổi.
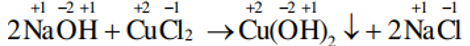
Các phản ứng trao đổi, một số phản ứng hoá hợp và một số phản ứng phân huỷ thuộc loại phản ứng hoá học này.
Lý thuyết Phản ứng oxi hóa khử
I. Phản ứng oxi hóa - khử
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất trong phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
- Chất khử (chất bị oxh) là chất nhường electron
- Chất oxh (chất bị khử) là chất thu electron.
- Quá trình oxh (sự oxh) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình thu electron.
Ví dụ:
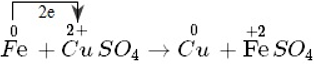
Quá trình thay đổi số oxi hóa:
Fe0 → Fe2+ + 2e
- Số oxi hóa của sắt tăng từ 0 đến +2. Nguyên tử sắt là chất khử. Sự làm tăng số oxi hóa của sắt được gọi là sự oxi hóa nguyên tử sắt.
- Nguyên tử sắt nhường electron, là chất khử. Sự nhường electron của nguyên tử sắt được gọi là sự oxi hóa nguyên tử sắt.
Cu2+ + 2e → Cu
- Số oxi hóa của đồng giảm từ +2 xuống 0. Ion đồng là chất oxi hóa. Sự làm giảm số oxi hóa của ion đồng được gọi là sự khử ion đồng.
- Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
⇒ Phản ứng của sắt với dung dịch đồng sunfat cũng là phản ứng oxi hóa - khử vì tồn tại đồng thời sự oxi hóa và sự khử.
II. Lập phương trình hóa học của phản ứng oxi hóa khử
Bước 1: Xác định số oxh của các nguyên tố để tìm chất oxi hoá và chất khử.
Bước 2: Viết quá trình oxh và quá trình khử, cân bằng mỗi quá trình.
Bước 3: Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH.
Ví dụ: Lập PTHH của phản ứng oxi hoá khử sau:
NH3 + Cl2 → N2 + HCl
Bước 1:

Số oxh của N tăng từ -3 lên 0: Chất khử.
Số oxh của Cl giảm từ 0 xuống -1: Chất oxh.
Bước 2:
Quá trình oxi hóa :
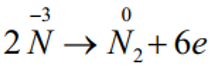
Quá trình khử:
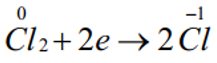
Bước 3:
Quá trình oxi hóa:
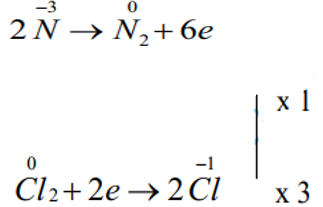
Bước 4: Viết PTHH
2NH3 + 3Cl2 → N2 + 6HCl
III. Ý nghĩa của phản ứng oxi hóa – khử
- Phản ứng oxi hóa - khử là một trong những quá trình quan trọng nhất của thiên nhiên:
Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hàng loạt quá trình sinh học khác đều có cơ sở là các phản ứng oxi hóa - khử.
- Ngoài ra: Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xảy ra trong pin và trong ăcquy đều bao gồm sự oxi hóa và sự khử.
Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học, ... đều không thực hiện được nếu thiếu các phản ứng oxi hóa - khử.

