70 câu trắc nghiệm Bảng tuần hoàn các nguyên tố hóa học có lời giải chi tiết (cơ bản) - Hoá học lớp 10
70 câu trắc nghiệm Bảng tuần hoàn các nguyên tố hóa học có lời giải chi tiết (cơ bản)
Với 70 câu trắc nghiệm Bảng tuần hoàn các nguyên tố hóa học có lời giải chi tiết (cơ bản) Hoá học lớp 10 tổng hợp 70 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Bảng tuần hoàn các nguyên tố hóa học từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Bài 1: Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào?
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
C. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành 1 cột.
D. Cả A, B, C.
Lời giải:
Chọn đáp án: D
Bài 2: Chu kì là:
A. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều khối lượng nguyên tử tăng dần.
B. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số khối tăng dần.
C. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân nguyên tử tăng dần.
D. Dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số nơtron tăng dần.
Lời giải:
Chọn đáp án: C
Bài 3: Nhóm nguyên tố là:
A. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron giống nhau, được xếp ở cùng một cột.
B. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hoá học giống nhau và được xếp thành một cột.
C. Tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hoá học gần giống nhau và được xếp thành một cột.
D. Tập hợp các nguyên tố mà nguyên tử có tính chất hoá học giống nhau và được xếp cùng một cột.
Lời giải:
Chọn đáp án: C
Bài 4: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn:
A. 3 và 3
B. 4 và 3
C. 4 và 4
D. 3 và 4
Lời giải:
Chọn đáp án: D
Bài 5: Trong bảng tuần hoàn, chu kỳ nhỏ là những chu kỳ nào sau đây?
A. 1
B. 2
C. 3
D. Cả 3 chu kỳ 1, 2, 3.
Lời giải:
Chọn đáp án: D
Bài 6: Nguyên tử các nguyên tố thuộc chu kỳ 3 có số lớp electron trong nguyên tử là:
A. 3
B. 4
C. 5
D. 6.
Lời giải:
Chọn đáp án: A
Bài 7: Số nguyên tố thuộc chu kỳ 3 là
A. 8
B. 18
C. 32
D. 50
Lời giải:
Chọn đáp án: A
Giải thích:
Các chu kì 2,3 là chu kì nhỏ, có 8 nguyên tố trong 1 chu kì
Các chu kì 4,5,6 là các chu kì lớn, có 18 nguyên tố trong 1 chu kì.
Bài 8: Nguyên tử các nguyên tố thuộc nhóm VA có số electron lớp ngoài cùng là:
A. 4 B. 3
C. 5 D. 1
Lời giải:
Chọn đáp án: C
Bài 9: Nguyên tử các nguyên tố thuộc nhóm IIIA có số electron độc thân là:
A. 3 B. 1
C. 2 D. 0
Lời giải:
Chọn đáp án: B
Bài 10: Nhận định nào sau đây không đúng?
A. Chu kỳ gồm các nguyên tử có số lớp electron bằng nhau.
B. Trong bảng tuần hoàn các nguyên tố được xếp theo chiều tăng của khối lượng nguyên tử.
C. Các nguyên tử có số lớp electron bằng nhau xếp cùng một hàng.
D. Các nguyên tử có số electron hoá trị bằng nhau xếp cùng một cột.
Lời giải:
Chọn đáp án: B
Giải thích: Trong bảng tuần hoàn các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân.
Bài 11: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z= 11) là
A. 1s22s22p63s2
B. 1s22s22p53s2
C. 1s22s22p43s1
D. 1s22s22p63s1
Lời giải:
Chọn đáp án: D
Giải thích: Cấu hình electron của Na(Z=11): 1s22s22p63s1
Bài 12: Một nguyên tố thuộc nhóm VIA, chu kỳ 3. Điện tích hạt nhân của nguyên tử nguyên tố đó là:
A. 13+
B. 14+
C. 15+
D. 16+
Lời giải:
Chọn đáp án: D
Giải thích:
Nhóm VIA ⇒ có 6 electron lớp ngoài cùng
Chu kì 3 ⇒ có 3 lớp eletron
⇒ Cấu hình electrong: 1s22s22p63s2 p4 ⇒ Z=16

Bài 13: Nguyên tố Se (Z=34). Vị trí của Se là
A. Ô 34, chu kỳ 4, nhóm VIA.
B. Ô 34, chu kỳ 4, nhóm VIB
C. Ô 34, chu kỳ 4, nhóm VA.
D. Ô 34, chu kỳ 4, nhóm VB.
Lời giải:
Chọn đáp án: A
Giải thích:
34= 2+8+18+6 ⇒ cấu hình [...]3d104s24p6
⇒ Se thuộc chu kì 4, nhóm VIA
Bài 14: Cho cấu hình electron của Mn [Ar]3d54s2. Mn thuộc nguyên tố nào?
A. Nguyên tố s
B. Nguyên tố p
C. Nguyên tố d
D. Nguyên tố f
Lời giải:
Chọn đáp án: C
Giải thích:
Trật tự các mức năng lượng tăng dần theo trình tự sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Do đó nguyên tử Mn có electron cuối cùng được điền vào phân lớp d nên là nguyên tố d.
Bài 15: Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
A. tăng theo chiều tăng của điện tích hạt nhân.
B. giảm theo chiều tăng của điện tích hạt nhân.
C. tăng theo chiều tăng của tính kim loại.
D. A và C đều đúng.
Lời giải:
Chọn đáp án: D
Bài 16: Nguyên tố ở chu kỳ 4, nhóm VIA có cấu hình electron hóa trị là
A. …4s24p6.
B. …4s24p4.
C. …5s25p5.
D. …5s25p4.
Lời giải:
Chọn đáp án: B
Giải thích: Chu kì 4: có 4 lớp electron, nhóm VIA : có 6eletron lớp ngoài cùng.
Bài 17: Cho nguyên tố có STT là 17, vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hoá học là:
A. Ô số 17, chu kì 3, nhóm VIIA.
B. Ô số 17, chu kì 3, nhóm IA.
C. Ô số 17, chu kì 4, nhóm IIA.
D. Ô số 17, chu kì 3, nhóm IIA.
Lời giải:
Chọn đáp án: A
Giải thích:
17=2+8+7 ⇒ [...] 3s23p5
Có 3 lớp electron: thuộc chu kì 3, có 7 electron lớp ngoài cùng nên thuộc nhóm VIIA.
Bài 18: Cho nguyên tố có STT là 19 có bao nhiêu electron độc thân
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: A
Giải thích: 19=2+8+8+1 ⇒ [...]4s1
Lưu ý khi Z > 20, phân lớp 3d xuất hiện có mức năng lượng lớn hơn 4s khi đó ở lớp 3 thay vì có 8electron sẽ có 18electron.
Bài 19: Nguyên tố R thuộc nhóm VIA. Công thức oxit cao nhất của R và công thức hợp chất với hiđro là
A. R2O5 và RH .
B. RO2 và RH4.
C. R2O7 và RH.
D. RO3 và RH2
Lời giải:
Chọn đáp án: D
Giải thích:
Hóa trị cao nhất với oxi là 6, hóa trị thấp nhất với hidro là 8-6=2.
⇒ Công thức: RO3 và RH2
Bài 20: Công thức chung của các oxit kim loại nhóm IA là
A. R2O.
B. RO2 .
C. RO.
D. R2O3
Lời giải:
Chọn đáp án: A
Bài 21: Nhận định nào sau đây đúng khi nói về 3 nguyên tử :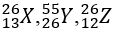
A. X và Z có cùng số khối
B. X,Z là 2 đồng vị của cùng một nguyên tố hóa học
C. X,Y thuộc cùng một nguyên tố hóa học
D. X và Y có cùng số nơtron
Lời giải:
Chọn đáp án: A
Giải thích:
A đúng vì Ax = Az
B sai vì X và Z không có cùng số proton → không là 2 đồng vị của cùng một nguyên tố hóa học
C sai vì X và Y không cùng điện tích hạt nhân → không thuộc cùng một nguyên tố hóa học
D vì X và Y khác nhau số nơtron
Bài 22: Số proton và số nơtron có trong một nguyên tử nhôm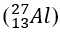
A. 13 và 14
B. 13 và 15
C. 12 và 14
D. 13 và 13
Lời giải:
Chọn đáp án: A
Giải thích: 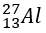
Bài 23: Cation R+ có cấu hình electron phân lớp ngoài cùng là 3p6. Vị trí của R trong bảng tuần hoàn là
A. Ô thứ 20, nhóm IIA, chu kỳ 4.
B. Ô thứ 19, nhóm IB, chu kỳ 4
C. Ô thứ 19, nhóm IA, chu kỳ 4.
D. Ô thứ 17, nhóm VIIA, chu kỳ 3
Lời giải:
Chọn đáp án: C
Giải thích:
Cấu hình electron của R+ : [...]3p6
⇒ Cấu hình electron của R: [...]3p64s1
Có 19electron: thuộc ô 19,
có 4 lớp electron: thuộc chu kì 4,
có 1 electron lớp ngoài cùng: nhóm IA.
Bài 24: Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
A. O (Z=8)
B. Cl (Z=17)
C. Al (Z=13)
D. Si (Z=14)
Lời giải:
Chọn đáp án: D
Giải thích:
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
→ X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p
→ Cấu hình electron của X là 1s22s22p63s23p2
→ Z=14 → X là Si
Bài 25: Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L ( lớp thứ 2). Số proton có trong nguyên tử X là
A. 7 B. 6
C. 8 D. 5
Lời giải:
Chọn đáp án: B
Giải thích:
Nguyên tử nguyên tố X có 4 electron ở lớp L
→ X có 2 electron ở phân lớp 2s và 2 electron ở phân lớp 2p
→ Cấu hình electron của X là 1s22s22p2 → Z=6
Bài 26: anion X2- có cấu hình electron: 1s22s22p63s23p6. Nguyên tử nguyên tố X thuộc
A. Chu kỳ 3 nhóm VIA.
B. Chu kỳ 3 nhóm VIIIA.
C. Chu kỳ 4 nhóm IIA.
D. Chu kỳ 4 nhóm VIA.
Lời giải:
Chọn đáp án: A
Giải thích:
Cấu hình electron của X: 1s22s22p63s23p4
⇒ X thuộc chu kì 3, nhóm VIA
Bài 27: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
A. 12. B. 13.
C. 11. D. 14.
Lời giải:
Chọn đáp án: A
Giải thích:
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2
Cấu hình e của X là: 1s22s22p63s2
X có 12 e nên có 12 p nên số hiệu nguyên tử của nguyên tố X là 12.
Bài 28: Nguyên tố hóa học X có Z = 20, chu kì 4 nhóm IIA. Điều khẳng định nào sau đây là sai?
A. Số electron trên lớp vỏ là 20
B. Vỏ nguyên tử có 4 lớp electron và có 2 electron lớp ngoài cùng
C. Hạt nhân nguyên tử có 20 proton
D. Nguyên tố hóa học này là phi kim
Lời giải:
Chọn đáp án: D
Giải thích:
X thuộc nhóm IIA: có 2 e lớp ngoài cùng nên có tính kim loại
(Các nguyên tố có 1,2,3 e lớp ngoài cùng có xu hướng nhường e, có tính kim loại)
Bài 29: Nguyên tử của nguyên tố nào sau đây có khuynh hướng nhường 1 electron trong các phản ứng hóa học?
A. Na ở ô 11 trong bảng tuần hoàn.
B. Mg ở ô 12 trong bảng tuần hoàn.
C. Al ở ô 13 trong bảng tuần hoàn.
D. Si ở ô 14 trong bảng tuần hoàn.
Lời giải:
Chọn đáp án: A
Bài 30: Số hiệu nguyên tử Z của các nguyên tố X, A, M, Q lần lượt là 6, 7, 20, 19. Nhận xét nào sau đây đúng ?
A. Cả 4 nguyên tố trên thuộc 1 chu kì.
B. M, Q thuộc chu kì 4.
C. A, M thuộc chu kì 3.
D. Q thuộc chu kì 3.
Lời giải:
Chọn đáp án: B
Giải thích: Cấu hình e của X, A, M , Q lần lượt là: 1s22s22p2; 1s22s22p3; 1s22s22p63s23p64s2; 1s22s22p63s23p64s1
Bài 31: Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng tuần hoàn thì
A. phi kim mạnh nhất là iot.
B. kim loại mạnh nhất là liti.
C. phi kim mạnh nhất là flo.
D. kim loại yếu nhất là xesi.
Lời giải:
Chọn đáp án: C
Bài 32: Oxit cao nhất của 1 nguyên tố R ứng với công thức RO2. Nguyên tố R đó là
A. Magie.
B. Nitơ.
C. Cacbon.
D. Photpho.
Lời giải:
Chọn đáp án: C
Bài 33: Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là:
A. 3 B. 5
C. 6 D. 7
Lời giải:
Chọn đáp án: C
Bài 34: Tìm câu sai trong các câu sau đây:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm.
B. Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhận tăng dần.
C. Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
D. Trong 1 nhóm A theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
Lời giải:
Chọn đáp án: C
Bài 35: Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Hãy xác định câu sai trong các câu sau khi nói về nguyên tử X
A. Lớp ngoài cùng của X có 6 electron
B. Hạt nhân nguyên tử X có 16 electron
C. Trong bảng tuần hoàn X nằm ở chu kì 3
D. X nằm ở nhóm VIA
Lời giải:
Chọn đáp án: B
Giải thích:
Cấu hình đầy đủ của X: 1s22s22p63s23p4
⇒ Có 16 electron, lớp ngoài cùng có 6 e, có 3 lớp e nên thuộc chu kì 3
B sai vì trong hạt nhân có hạt proton và notron không có electron.

Bài 36: Nguyên tử R tạo được Anion R2-. Cấu hình e của R2- ở trạng thái cơ bản là 3p6. Tổng số hạt mang điện trong R là.
A. 18 B. 32
C. 38 D. 19
Lời giải:
Chọn đáp án: B
Giải thích: Cấu hình của R2- là 3p6 ⇒ của R sẽ là 3p4 ⇒ R có cấu hình đầy đủ là 1s22s22p63s23p4 ⇒ tổng hạt mang điện trong R là ( p + e ) = 32
Bài 37: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X là 3s23p1. Vị trí (chu kì, nhóm) của X trong bảng tuần hoàn các nguyên tố hóa học là
A. Chu kì 3, nhóm IIIB.
B. Chu kì 3, nhóm IA.
C. Chu kì 4, nhóm IB.
D. Chu kì 3, nhóm IIIA.
Lời giải:
Chọn đáp án: D
Giải thích: X có 3 lớp e ⇒ X thuộc chu kì 3. X có tổng e lớp ngoài cùng là 3 và e cuối điền vào phân lớp p ⇒ X ở nhóm IIIA.
Bài 38: Nguyên tố X có cấu hình electron là 1s22s22p3. Vậy vị trí X trong bảng tuần hoàn và công thức hợp chất khí với hiđro của X là :
A. Chu kì 2, nhóm VA, HXO3.
B. Chu kì 2, nhóm VA, XH4.
C. Chu kì 2, nhóm VA, XH3.
D. Chu kì 2, nhóm VA, XH2.
Lời giải:
Chọn đáp án: C
Giải thích:
Có 5e lớp ngoài cùng nên thuộc nhóm VA, có 2 lớp e: thuộc chu kì 2,
Hóa trị cao nhất với oxi là 5, thấp nhất với hidro là 8-5=3 nên CT XH3
Bài 39: Trong một chu kì của bảng tuần hoàn khi đi từ trái sang phải thì
A. Năng lượng ion hóa giảm dần
B. Bán kính nguyên tử giảm dần
C. Độ âm điện giảm dần
D. Ái lực điện tử giảm dần
Lời giải:
Chọn đáp án: B
Bài 40: Biết nguyên tố X thuộc chu kì 4 nhóm IIIA của bảng tuần hoàn. Cấu hình electron nguyên tử của X là
A. 1s22s22p63s23p63d104s24p3
B. 1s22s22p63s23p64s24p63d5
C. 1s22s22p63s23p63d104s24p1
D. 1s22s22p63s23p4
Lời giải:
Chọn đáp án: C
Giải thích:
Lưu ý Trật tự các mức năng lượng tăng dần theo trình tự sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Bài 41: Một nguyên tử X có bán kính rất lớn. Phát biểu nào sau đây đúng về X?
A. Độ âm điện của X rất lớn và X là PK
B. Độ âm điện của X rất nhỏ và X là PK
C. Độ âm điện của X rất lớn và X là KL
D. Độ âm điện của X rất nhỏ và X là KL
Lời giải:
Chọn đáp án: D
Bài 42: Những đặc trưng nào sau đây của đơn chất, nguyên tử các nguyên tố biến đổi tuần hoàn theo chiều tăng điện tích hạt nhân
A. Nhiệt độ nóng chảy, nhiệt độ sôi
B. Tỉ khối
C. Số lớp electron
D. Số lớp electron lớp ngoài cùng
Lời giải:
Chọn đáp án: D
Bài 43: Nguyên tử của nguyên tố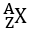
A. X thuộc ô 92, chu kì 7
B. X thuộc ô 60 chu kì 6
C. X thuộc ô 72 chu kì 6 nhóm IVB
D. Tất cả đều sai
Lời giải:
Chọn đáp án: A
Giải thích:
Cấu hình electron 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f66d1
X thuộc ô 92, ô thứ 3 họ actini
Tổng số electron Z= 92

Bài 44: Nguyên tử của nguyên tố R có 3 electron thuộc phân lớp 3d. Vị trí của nguyên tố R trong bảng tuần hoàn là vị trí nào sau đây
A. Ô số 23 chu kì 4 nhóm VB
B. Ô số 25 chu kì 4 nhóm VIIB
C. Ô số 24 chu kì 4 nhóm VIB
D. tất cả đều sai
Lời giải:
Chọn đáp án: A
Giải thích:
Thứ tự electron trong nguyên tử X 1s22s22p63s23p64s23d3
Cấu hình electron của nguyên tử R 1s22s22p63s23p64s23d34s2
Nguyên tử R có 23 electron. Vậy R thuộc ô số 23. R thuộc chu kì 4 nhóm VB
Bài 45: Cho các phát biểu sau:
(I) F là phi kim mạnh nhất.
(II) Li là kim loại có độ âm điện lớn nhất.
(III) He là nguyên tử có bán kính nhỏ nhất.
(IV) Be là kim loại yếu nhất trong nhóm IIA.
Trong các phát biểu trên, số phát biểu đúng là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: C
Giải thích: Phát biểu (I), (III) và (IV) đúng.
Bài 46: Nguyên tử của nguyên tố X khi mất 2 electron lớp ngoài cùng thì tạo thành ion X2+ có cấu hình electron lớp ngoài cùng là 3p6. Số hiệu nguyên tử X là
A. 18 B. 20
C. 38 D. 40
Lời giải:
Chọn đáp án: B
Giải thích: Cấu hình e của X: 1s22s22p63s23p64s2 ⇒ có 20e ⇒ Z=20
Bài 47: Cho các nguyên tố 8X, 11Y, 20Z và 26T. Số electron hóa trị của nguyên tử các nguyên tố tăng dần theo thứ tự:
A. X < Y < Z < T.
B. T < Z < X < Y.
C. Y < Z < X < T.
D. Y < X < Z < T.
Lời giải:
Chọn đáp án: C
Giải thích:
Cấu hình electron nguyên tử các nguyên tố lần lượt là:
X: 1s22s22p4 ⇒ 6 electron hóa trị.
Y: 1s22s22p63s1 ⇒ 1 electron hóa trị.
Z: 1s22s22p63s23p64s2 ⇒ 2 electron hóa trị.
T: 1s22s22p63s23p63d64s2 ⇒ 8 electron hóa trị.
Bài 48: Ba nguyên tố R, Q, T là các nguyên tố thuộc nhóm A và lần lượt đứng liên tiếp cạnh nhau trong cùng một chu kì.
Có các phát biểu sau đây:
(1) Điện tích hạt nhân tăng dần theo thứ tự: R < Q < T.
(2) Bán kính nguyên tử tăng dần theo thứ tự: R < Q < T.
(3) Tính phi kim tăng dần theo thứ tự: R < Q < T.
(4) Khối lượng nguyên tử tăng dần theo thứ tự: R < Q < T.
(5) Hóa trị trong hợp chất với hidro tăng dần theo thứ tự: R < Q < T.
Trong các phát biểu trên, số phát biểu đúng là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: C
Giải thích: Phát biểu (1), (3) và (4) đúng.
Bài 49: X và Y là hai nguyên tố thuộc nhóm A, trong cùng một chu kì lớn. Oxit cao nhất của X và Y có công thức hóa học là X2O3 và YO2.
Có các phát biểu sau đây:
(1) X và Y đứng cạnh nhau.
(2) X là kim loại còn Y là phi kim.
(3) Độ âm điện của X nhỏ hơn Y.
(4) Hợp chất của X và Y với hidro lần lượt là XH5 và YH4.
Trong các phát biểu trên, số phát biểu đúng là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: B
Giải thích: Phát biểu (1) và (3) đúng.
Bài 50: Có những tính chất sau đây của nguyên tố:
(1) Hóa trị của nguyên tố trong hợp chất với oxi;
(2) Bán kính nguyên tử;
(3) Tính kim loại – phi kim;
(4) Tính axit – bazơ của hợp chất hidroxit.
Trong các tính chất trên, số tính chất biến đổi tuần hoàn trong một nhóm A là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: C
Giải thích: Các tính chất 1, 3, 4 biến đổi tuần hoàn trong một nhóm.
Bài 51: Nguyên tử của nguyên tố Z có 4 lớp electron, lớp ngoài cùng có 6 electron. Số hiệu nguyên tử của Z là:
A. 24 B. 34
C. 36 D. 16
Lời giải:
Chọn đáp án: B
Giải thích:
Cấu hình electron của Z là: 1s22s22p63s23p63d104s24p4
Số hiệu nguyên tử của Z là 34.

Bài 52: Nguyên tố Z đứng ở ô thứ 17 của bảng tuần hoàn. Có các phát biểu sau:
(1) Z có độ âm điện lớn.
(2) Z là một phi kim mạnh.
(3) Z có thể tạo thành ion bền có dạng Z+.
(4) Hợp chất của X với oxi có công thức hóa học X2O5.
Trong các phát biểu trên, số phát biểu đúng là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: B
Giải thích: Phát biểu 1, 2 đúng.
Bài 53: Một nguyên tử X có 21 electron. Hóa trị cao nhất của X trong hợp chất với oxi là
A. I
B. II
C. III
D. IV
Lời giải:
Chọn đáp án: C
Giải thích:
Cấu hình electron nguyên tử của X là 1s22s22p63s23p63d14s2
X ở nhóm IIIB. Hóa trị cao nhất của X với oxi là III.
Bài 54: Trong nhóm IA, theo chiều điện tích hạt nhân tăng dần, sự biến đổi nào sau đây không đúng?
A. Bán kính nguyên tử tăng dần
B. Tính khử kim loại giảm dần
C. Tính axit của oxit tương ứng giảm dần
D. Khối lượng riêng tăng dần
Lời giải:
Chọn đáp án: B
Bài 55: Một nguyên tố A thuộc chu kì 3, nhóm IIIA của bảng tuần hoàn. Có những phát biểu sau đây về nguyên tố A:
(1) Nguyên tố này tạo được hợp chất khí có công thức hóa học AH3.
(2) Oxit tương ứng với hóa trị cao nhất của A có công thức hóa học A2O3.
(3) Hợp chất hidroxit của A có công thức hóa học A(OH)3.
(4) Hidroxit của A có tính bazơ mạnh.
Trong các phát biểu trên, số phát biểu đúng là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: B
Giải thích: Các phát biểu 2, 3 đúng.
Bài 56: Nguyên tố Z thuộc nhóm A của bảng tuần hoàn. Oxit ứng với hóa trị cao nhất của Z có công thức hóa học ZO3. Số electron ở lớp ngoài cùng của A là
A. 8 B. 6
C. 3 D. 2
Lời giải:
Chọn đáp án: B
Giải thích: Z có hóa trị cao nhất với oxi là 6 nên có 6e lớp ngoài cùng
Bài 57: Cấu hình electron nguyên tử nguyên tố X là 1s22s22p63s23p2. Số hiệu nguyên tử của X
A. 13 B. 14
C. 15 D. 27
Lời giải:
Chọn đáp án: B
Giải thích: Tổng số e trên các phân lớp là 14 ⇒ Z=p=e = 14
Bài 58: Nguyên tử của nguyên tố M tạo được cation M2+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Vị trí của nguyên tố M trong bảng tuần hoàn là vị trí nào sau đây
A. ô số 12 chu kì 3 nhóm IIA
B. ô số 13 chu kì 3 nhóm IIIA
C. ô số 14 chu kì 3 nhóm IVA
D. tất cả đều sai
Lời giải:
Chọn đáp án: A
Giải thích: Vì M – 2e → M2+ do đó cấu hình electron phải là 1s22s22p63s2 và ở ô số 12 chu kì 3 nhóm IIA
Bài 59: Anion X- có cấu hình electron phân lớp ngoài cùng là 2p6. Hỏi nguyên tử X có cấu hình electron nào sau đây
A. 1s22s22p5
B. 1s22s22p6
C. 1s22s22p4
D. A,C đúng
Lời giải:
Chọn đáp án: A
Giải thích: Vì X + e → X- nên cấu hình electron của nguyên tử X là 1s22s22p5
Bài 60: Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là 1s22s22p63s1; 1s22s22p63s2; 1s22s22p63s23p1. Dãy gồm các kim loại xếp theo chiều tăng dần tính khử từ trái sang phải là
A. Z,Y,X
B. X,Y,Z
C. Y,Z,X
D. Z,X,Y
Lời giải:
Chọn đáp án: A
Giải thích:
Tính khử là tính chất đặc trưng của kim loại → tính khử tăng → tính kim loại tăng
X,Y,Z đều thuộc chu kì 3. Sắp xếp theo chiều tăng dần của điện tích hạt nhân X-Y-Z
Trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, tính khử giảm dần
Bài 61: Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20. Phát biểu nào sau đây sai?
A. Các nguyên tố này đều là các kim loại mạnh nhất trong chu kì.
B. Các nguyên tố này không cùng thuộc 1 chu kì.
C. Thứ tự tăng dần tính bazo là: X(OH)2, Y(OH)2, Z(OH)2
D. Thứ tự tăng dần độ âm điện là: Z<Y<X
Lời giải:
Chọn đáp án: A
Giải thích:
ZX= 4 ⇒ cấu hình e lớp ngoài cùng của X là … 2s2 ⇒ X thuộc nhóm II, chu kì 2
Zy = 12 ⇒ cấu hình e lớp ngoài cùng của Y là ….3s2 ⇒ Y thuộc nhóm II, chu kì 3
Zz = 20 ⇒ cấu hình e lớp ngoài cùng của Z là ….4s2 ⇒ Z thuộc nhóm II, chu kì 4
A sai vì nguyên tố nhóm IA mới là KL mạnh nhất trong 1 CK
B đúng X thuộc CK 2, Y thuộc CK 3, Z thuộc CK 4.
C đúng Trong cùng 1 nhóm tính bazo tăng dần theo chiều tăng dần của điện tích hạ nhân.
D đúng Trong cùng 1 nhóm độ âm điện giảm dần theo chiều tăng dần của điện tích hạt nhân.
Bài 62: Các nguyên tố trong cùng chu kì có cùng
A. Số electron lớp ngoài
B. Khối lượng nguyên tử
C. Điện tích hạt nhân
D. Số lớp electron
Lời giải:
Chọn đáp án: D
Bài 63: Trong bảng tuần hoàn, số thứ tự của ô là:
A. Số khối
B. Khối lượng nguyên tử
C. Số hiệu nguyên tử
D. Tất cả đều đúng
Lời giải:
Chọn đáp án: C
Bài 64: Nguyên tố X thuộc chu kì 3, nhóm VIA. Số hiệu nguyên tử của X là
A. 16 B. 14
C. 17 D. 12
Lời giải:
Chọn đáp án: A
Giải thích:
X thuộc chu kì 3, nhóm VIA nên có 3 lớp e và 6 e lớp ngoài cùng
Cấu hình electron của X: 1s22s22p63s23p4

Bài 65: Cho nguyên tố X có cấu hình electron là: 1s22s22p63s23p2. X thuộc nhóm nào, chu kì nào?
A. Chu kì 2, nhóm IIA
B. Chu kì 3, nhóm IIA
C. Chu kì 3, nhóm IVA
D. Chu kì 2, nhóm IIIA
Lời giải:
Chọn đáp án: C
Giải thích:
Có 2 lớp e nên thuộc chu kì 3
Có 4 e lớp ngoài cùng và e ngoài cùng điền vào phân lớp p nên thuộc nhóm IVA
Bài 66: Nguyên tố R thuộc chu kì 3, nhóm VIIA trong bảng tuần hoàn. Công thức oxit cao nhất của R là:
A. RO3
B. R2O7
C. R2O3
D. R2O
Lời giải:
Chọn đáp án: B
Giải thích: R thuộc nhóm VIIA nên có 7e lớp ngoài cùng ⇒ công thức oxit cao nhất của R có hóa trị 7 ⇒ R2O7
Bài 67: Một nguyên tố A thuộc chu kì 3, nhóm IIIA của bảng tuần hoàn. Có những phát biểu sau đây về nguyên tố A:
(1) Nguyên tố này tạo được hợp chất khí có công thức hóa học AH3.
(2) Oxit tương ứng với hóa trị cao nhất của A có công thức hóa học A2O3.
(3) Hợp chất hidroxit của A có công thức hóa học A(OH)3.
(4) Hidroxit của A có tính bazơ mạnh.
Trong các phát biểu trên, số phát biểu đúng là
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: B
Giải thích: Nguyên tử có bán kính nhỏ nhất có Z = 2(He)
Bài 68: Chọn câu đúng khi nói về độ âm điện của 2 nguyên tố hóa học
A. Độ âm điện đặc trưng cho khả năng hút elctron
B. Độ âm điện đặc trưng cho khả năng nhưởng electron của nguyên tử
C. Độ âm điện đặc trưng cho khả năng tham gia phản ứng hóa học
D. Độ âm điện tăng theo chiều tăng của điện tích hạt nhân
Lời giải:
Chọn đáp án: A
Bài 69: Nguyên tố Z thuộc nhóm A của bảng tuần hoàn. Oxit ứng với hóa trị cao nhất của Z có công thức hóa học ZO3. Công thức của Z với H là:
A. ZH2
B. ZH6
C. ZH3
D. ZH4
Lời giải:
Chọn đáp án: A
Giải thích:
Hóa trị cao nhất với oxi là 6, nên hóa trị của Z với H là 8 – 6 = 2
CT của Z với H là ZH2

