125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải chi tiết (nâng cao) - Hoá học lớp 10
125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải chi tiết (nâng cao)
Với 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải chi tiết (nâng cao) Hoá học lớp 10 tổng hợp 125 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nhóm Oxi, Lưu huỳnh từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Bài 1:Cho các chất: Cu, CuO, BaSO4, Mg, KOH, C, Na2CO3. Tổng số chất tác dụng với dung dịch H2SO4 đặc, nóng là
A. 4.
B. 5.
C. 6.
D. 7.
Lời giải:
Hướng dẫn giải
Đáp án C.
Trừ BaSO4
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
CuO + H2SO4 → CuSO4 + H2O
Mg + 2H2SO4 → MgSO4 + 2H2O + SO2
2KOH + H2SO4 → K2SO4 + 2H2O
C + 2H2SO4 → CO2 + 2SO2 + 2H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
Bài 2:Cho lưu huỳnh lần lượt phản ứng với mỗi chất sau (trong điều kiện thích hợp): H2, O2, Hg, H2SO4 loãng, Al, Fe, F2, HNO3 đặc, nóng; H2SO4 đặc, nóng. Số phản ứng chứng minh được tính khử của lưu huỳnh?
A. 5.
B. 2.
C. 4.
D. 3.
Lời giải:
Hướng dẫn giải
Đáp án C.
S + O2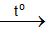
S + 3F2 → SF6
3S + 4HNO3 → 3SO2 + 4NO + 2H2O
S + 2H2SO4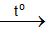
Bài 3:Oxi hoá hoàn toàn m gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1 thu được 13,1 gam hỗn hợp Y gồm các oxit. Giá trị của m là
A. 7,4.
B. 8,7.
C. 9,1.
D. 10.
Lời giải:
Hướng dẫn giải
Đáp án C.
Gọi nCu = nAl = a (mol)
Cu → CuO
a → a (mol)
2Al → Al2O3
a 0,5a (mol)
Ta có : 80a + 102.0,5a = 13,1 ⇒ a = 0,1 (mol)
⇒ m = 27a + 64a = 9,1 g
Bài 4:Nung một hỗn hợp gồm 4,8 gam bột Magie và 3,2 gam bột lưu huỳnh trong một ống nghiệm đậy kín. Khối lượng chất rắn thu được sau phản ứng là
A. 8,0 gam.
B. 11,2 gam.
C. 5,6 gam.
D. 4,8 gam
Lời giải:
Hướng dẫn giải
Đáp án A.
nMg = 0,2 (mol), nS = 0,1 (mol)
Mg + S → MgS
0,2 0,1 0,1 (mol) , Mg dư
mCr = mMgS + mMg = 0,1. (24+32) + 0,1.24 = 8 g
Bài 5:Hòa tan hết 1,84 gam hỗn hợp Cu và Fe trong dung dịch H2SO4 dư, dặc, nóng, thu được 0,035 mol SO2. Số mol Fe và Cu trong hỗn hợp ban đầu lần lượt là
A. 0,02 và 0,03.
B. 0,01 và 0,02.
C. 0,01 và 0,03.
D. 0,02 và 0,04.
Lời giải:
Hướng dẫn giải:
Đáp án B.
Gọi nCu = y, nFe = x mol
x → 3x (mol)
y → 2y (mol)
0,07 ← 0,035 (mol)
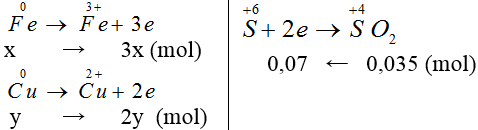
Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,07 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 1,84 (2).
Giải 1,2 ta có: x = 0,01, y = 0,02 (mol)
Bài 6:Lưu huỳnh tác dụng với dung dịch kiềm nóng:
S + KOH → K2S + K2SO3 + H2O.
Trong phản ứng này có tỉ lệ số nguyên tử S bị oxi hoá với số nguyên tử S bị khử là
A. 2:1.
B. 1:2.
C. 1:3.
D. 2:3.
Lời giải:
Hướng dẫn giải
Đáp án B.
3S + 6KOH → 2K2S + K2SO3 + 3H2O.
Bài 7:Có các chất và dung dịch sau: NaOH (1), O2 (2), dung dịch Br2 (3), dung dịch CuCl2 (4), dung dịch FeCl2 (5). H2S có thể tham gia phản ứng với bao nhiêu chất?
A. 2.
B. 4.
C. 3.
D. 5.
Lời giải:
Hướng dẫn giải
Đáp án B.
Các chất 1, 2, 3, 4.
2NaOH + H2S → Na2S + H2O
2H2S + O2 → 2S + 2H2O
H2S + 4Br2 + 4H2O → 8HBr + H2SO4
CuCl2 + H2S → CuS + 2HCl
Bài 8:Cho từng chất : Fe, FeO, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với H2SO4 dư, đặc nóng. Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử là:
A. 8.
B. 6.
C. 5.
D. 7.
Lời giải:
Hướng dẫn giải
Đáp án D.
Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử xảy ra giữa H2SO4 dư, dặc, nóng với lần lượt các chất: Fe, FeO, Fe(OH)2, Fe3O4,Fe(NO3)2, FeSO4, FeCO3. (Hợp chất mà trong đó Fe chưa đạt số oxi hóa là +3).
Sử dụng thông tin sau trả lời câu hỏi 9, 10
Cho 9,2 gam hỗn hợp gồm Zn và Al phản ứng hoàn toàn với lượng dư dung dịch H2SO4 đặc, nóng thu được 5,6 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất).
Bài 9:Khối lượng Al có trong hỗn hợp là
A. 2,7 gam.
B. 5,4 gam
C. 8,1 gam.
D. 6,75 gam.
Lời giải:
Đáp án A
Bài 10:Khối lượng muối thu được sau phản ứng là:
A.33,2 g
B. 57,2g
C. 81 gam.
D. 76,5 g
Lời giải:
Đáp án A.
Gọi nAl = a mol, nZn = b mol.
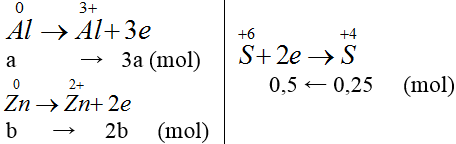
Ta có: 27a + 65b = 9,2 (*)
3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
mAl = 0,1.27 = 2,7 gam
m muối = mKl + M gốc axit. ne/2
= 3,92 + 96. 0,25 = 33,2 g
Bài 11:Cho phương trình phản ứng:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Sau khi cân bằng với hệ số là các giá trị tối giản, hệ số của chất oxi hoá và chất khử là
A. 5 và 2.
B. 2 và 5.
C. 2 và 2.
D. 5 và 5.
Lời giải:
Hướng dẫn giải:
Đáp án B.
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Bài 12:Đốt cháy hoàn toàn 4,48 g lưu huỳnh rồi cho sản phẩm cháy hấp thụ hoàn toàn vào 200 ml dung dịch Ba(OH)2 0,5M. Lượng chất kết tủa thu được sau phản ứng là:
A. 10,85g
B. 21,7g
C. 13,02 g
D. 16,725
Lời giải:
Hướng dẫn giải:
Đáp án C.
nS = nSO2=0,14 mol
nBa(0H)2= 0,2.0,5 = 0,1 (mol)
nSO2/nBa(OH)2=0,14/0,1=1,4
Tạo 2 muối Ba(HSO3)2 và BaSO3
nBaSO3= 2nBa(OH)2 -nSO2 = 0,2-0,14 = 0,06
mBaSO3=0,06.(137+32+48)=13,02(g)
Bài 13:Hấp thụ hoàn toàn 12,8g SO2 vào 250ml dung dịch NaOH 1M. Khối lượng muối tạo thành sau phản ứng là:
A. 15,6g và 5,3g
B. 18g và 6,3g
C. 15,6g và 6,3g
D. Kết quả khác
Lời giải:
Hướng dẫn giải:
Đáp án C
nSO2 = 0,2 (mol); nNaOH = 1.0,25 = 0,25 (mol)
nNaOH/nSO2=0,25/0,2=1,25(g)
Tạo Na2SO3 và NaHSO3
SO2 + NaOH → NaHSO3
a a a
SO2 + 2NaOH → Na2SO3 + H2O
b 2b b
a+ b = 0,2
a+ 2b = 0,25
Giải ra ta có a = 0,15, b = 0,05 mol
mNa2SO3=0,05.(46+32+48)=6,3)g
mNaHSO3=0,15.(23+1+32+48)=15,6(g)
Bài 14:Cho sơ đồ phản ứng sau:
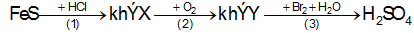
Các chất X, Y lần lượt là:
A. SO2, hơi S.
B. H2S, hơi S.
C. H2S, SO2.
D. SO2,H2S.
Lời giải:
Hướng dẫn giải:
Đáp án C.
FeS + 2HCl → FeCl2 + H2S
2H2S + 3O2 → 2SO2 + 2H2O
Bài 15:Hấp thụ hoàn toàn 6,72 lít khí SO2 (đktc) vào dung dịch chứa a mol KOH, thu được dung dịch chứa 39,8 gam hỗn hợp muối. Giá trị của a là
A. 0,5
B. 0,6
C. 0,4
D. 0,3
Lời giải:
Hướng dẫn giải:
Đáp án C.
nSO2 = 0,3 (mol)
Gọi số mol KHSO3: x mol; K2SO3:y mol
x+y = 0,3 (1)
120x +158y = 39,8 (2)
⇒ x=0,2; y=0,1
⇒ nKOH = x + 2y = 0,4 (mol) (bảo toàn K)
Bài 16:Cho các ứng dụng:
(1) Được dùng để sát trùng nước sinh hoạt.
(2) Được dùng để chữa sâu răng.
(3) Tẩy trắng tinh bột, dầu ăn.
(4) Bảo quản trái cây chín.
Số ứng dụng của ozon là
A. 2.
B. 4.
C. 1.
D. 3.
Lời giải:
Hướng dẫn giải: Đáp án B.
Bài 17:Đốt cháy đơn chất X trong oxi thu được khí Y. Mặt khác, X phản ứng với H2 (khi đun nóng) thu được khí Z. Trộn hai khí Y và Z thu được chất rắn màu vàng. Đơn chất X là
A. lưu huỳnh.
B. cacbon.
C. photpho.
D. nitơ.
Lời giải:
Đáp án A.
S + O2
S + H2
2H2S + SO2 → 3S + 2H2O
Bài 18:Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thị hết X vào 2 lít dung dịch chứa Ba(OH)2 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là
A. 23,2
B. 12,6
C. 18,0
D. 24,0
Lời giải:
Hướng dẫn giải:
Đáp án C.
nBa(OH)2 = 0,1.2 = 0,2 (mol); = 0,1 (mol)
nBaSO3 = 2nBa(OH)2 -nSO2 ⇒ nSO2 = 2.0,2 – 0,1 = 0,3 (mol)
FeS2 → 2SO2 (Bảo toàn S)
0,15 0,3 (mol)
⇒ mFeS2 = 0,15.(56+32.2) = 18 (g)
Bài 19:Cho 12,8g Cu tác dụng với H2SO4 đặc nóng dư , khí sinh ra cho vào 200ml dung dịch NaOH 2M. Hỏi muối nào được tạo thành và khối lượng là bao nhiêu?
A. Na2SO3 và 24,2g
B.Na2SO3 và 25,2g
C. NaHSO315g và Na2SO3 26,2g
D.Na2SO3 và 23,2g
Lời giải:
Hướng dẫn giải:
Đáp án B
Bảo toàn e: nCu = = 0,2 (mol)
nNaOH = 2.0,2 = 0,4 (mol)
nNaOH/nSO2=0,4/0,2=2
Tạo muối Na2SO3
SO2 + 2NaOH → Na2SO3 + H2O
0,2 0,4 0,2
mNa2SO3=0,4.(23.2+32+48)=25,2(g)

Bài 20:Cho các chất khí sau đây: Cl2, SO2, CO2, SO3. Chất làm mất màu dung dịch brom là
A. CO2.
B. SO3.
C. Cl2.
D. SO2
Lời giải:
Đáp án D.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Bài 21:Cho các chất và hợp chất: Fe, CuO, Al, Pt, CuS, BaSO4, NaHCO3, NaHSO4. Số chất và hợp chất không tác dụng với dung dịch H2SO4 loãng là
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Hướng dẫn giải:
Đáp án C.
Các chất: Pt, CuS, BaSO4, NaHSO4
Sử dụng thông tin trả lời câu hỏi 22, 23
Hấp thụ hoàn toàn 1,344 lít CO2 (đktc) vào 13,95 ml dung dịch KOH 28% (d = 1,147 g/ml).
Bài 22:Tính khối lượng muối thu được
A. 3,16 g
B. 4,8g
C. 7,96 g
D. 9,6 g
Lời giải:
Đáp án C.
Bài 23:Vậy muối thu được và nồng độ % tương ứng là:
A. K2SO3 10%
C. K2SO3 15,93% và KHSO3 24,91%
B. KHSO3 15%
D. KHSO3 24,19% và K2SO3 15,93%
Lời giải:
Đáp án C.
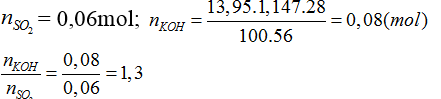
Tạo K2SO3 và KHSO3
SO2 + KOH → KHSO3
a a a
SO2 + 2KOH → K2SO3 + H2O
b 2b b
a+ b = 0,06
a+ 2b = 0,08
Giải ra ta có a = 0,04 , b = 0,02 mol
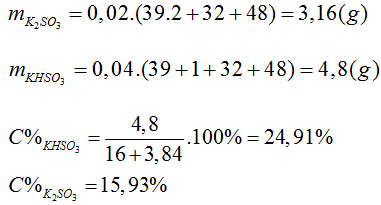
Bài 24:Cho các chất: C, Cu, ZnS, Fe2O3, CuO, NaCl rắn, Mg(OH)2. Có bao nhiêu chất tác dụng với H2SO4 đặc, nóng, tạo khí là
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Hướng dẫn giải:
Đáp án C.
C + 2H2SO4 → CO2 + 2SO2 + 2H2O
Cu + 2H2SO4 → CuSO4 + SO2 +2H2O
ZnS + H2SO4 → ZnSO4 + H2S
2NaCl + H2SO4 → Na2SO4 + 2HCl(k)
Bài 25:Cho các chất: Fe2O3, CuO, FeSO4, Na2SO4, Ag, Na2SO3, Fe(OH)3. Số chất có thể phản ứng với H2SO4 đặc nóng tạo ra SO2 là
A. 5.
B. 2.
C. 3.
D. 7.
Lời giải:
Hướng dẫn giải:
Đáp án C.
Các chất FeSO4, Ag, Na2SO3.
2FeSO4 + 2H2SO4 → Fe2(SO4)3 + SO2 + 2H2O
2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Sử dụng thông tin, trả lời câu hỏi 26, 27
Cho m gam một hỗn hợp Na2CO3 và Na2SO3 tác dụng hết với dung dịch H2SO4 2M dư thì thu được 2,24 lít hỗn hợp khí X (đktc) có tỷ khối đối với hiđro là 27.
Bài 26:Giá trị của m là:
A. 11,6 gam
B. 11,7 gam
C. 61,1 gam
D. 6,11 gam
Lời giải:
Đáp án A
Bài 27:Thể tích axit đã dùng là:
A. 200ml
B. 100ml
C. 30ml
D. 50ml
Lời giải:
Đáp án D
MX = 27.2 = 54, nX = 0,1
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
a a (mol)
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
b b (mol)
Ta có a + b = 0,1
44a + 64b = 0,1.54
⇒ a = b = 0,05 (mol)
m = 0,05. (106 + 126)=11,6 (g)
nH2SO4 = nkhí = 0,1 ⇒ V = 0,05 (lít)
Bài 28:Thêm 3 gam MnO2 vào 197 gam hỗn hợp X gồm KCl và KClO3. Trộn kĩ và đun hỗn hợp đến phản ứng hoàn toàn, thu được chất rắn cân nặng 152 gam. Khối lượng KCl trong 197 gam X là:
A. 74,50 gam.
B. 13,75 gam.
C. 122,50 gam.
D. 37,25 gam.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Bảo toàn khối lượng: = 3 + 197 – 152 = 48 (gam)
nO2 = 1,5 (mol)
2KClO3 → 2KCl + 3O2 ↑
⇒ mKCl = 197 – 1.122,5 = 74,5 (gam)
Bài 29:Hấp thụ 4,48 lít SO2 (đktc) vào 150 ml dung dịch NaOH 2M, thu được dung dịch chứa m gam muối. Giá trị của m là
A. 18,9
B. 25,2
C. 20,8
D. 23,0
Lời giải:
Hướng dẫn giải:
Đáp án D.
nSO2 = 0,2 (mol); nNaOH = 2.0,15 = 0,3 (mol)
nNaOH/nSO2=0,3/0,2=1,5
Tạo Na2SO3 và NaHSO3
SO2 + NaOH → NaHSO3
a a a
SO2 + 2NaOH → Na2SO3 + H2O
b 2b b
a+ b = 0,2
a+ 2b = 0,3
Giải ra ta có a = b = 0,1 mol
mNa2SO3=0,1.(46+32+48)=12,6(g)
mNaHSO3=0,1.(23+1+32+48)=10,4(g)
⇒ m = 23 (gam)
Bài 30:Khi nhiệt phân hoàn toàn 100 gam mỗi chất sau: KClO3 (xúc tác MnO2), KMnO4, KNO3 và AgNO3. Chất tạo ra lượng O2 lớn nhất là:
A. KMnO4.
B. KNO3.
C. KClO3.
D. AgNO3.
Lời giải:
Hướng dẫn giải:
Đáp án C
2KClO3 2KCl + 3O2
100/122,5 120/49 (mol)
2KMnO4 → K2MnO4 + MnO2 + O2
100/158 25/79 (mol)
2KNO3 → 2KNO2 + O2
100/101 50/101(mol)
2AgNO3 → 2Ag + 2NO2 + O2
100/170 5/17(mol)
Bài 31:Cho phương trình hoá học: P + H2SO4 → H3PO4 + SO2 + H2O. Hệ số của chất oxi hoá và hệ số của chất khử lần lượt là
A. 5 và 2.
B. 2 và 5.
C. 7 và 9.
D. 7 và 7.
Lời giải:
Hướng dẫn giải:
Đáp án B.
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
Bài 32:Cho các chất: Cu, CuO, NaCl, Mg, KOH, C, Na2CO3, tổng số chất vừa tác dụng với dung dịch H2SO4 loãng, vừa tác dụng với dung dịch H2SO4 đặc, nóng là
A. 3.
B. 4.
C. 5.
D. 6.
Lời giải:
Hướng dẫn giải
Đáp án B.
Các chất CuO, Mg, KOH, Na2CO3
Bài 33:Đun nóng 4,8 gam bột magie với 4,8 gam bột lưu huỳnh trong điều kiện không có không khí, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X vào dung dịch HCl dư, thu được hỗn hợp khí Y. Tỉ khối hơi của Y so với H2 là
A. 9
B. 13
C. 26
D. 5
Lời giải:
Hướng dẫn giải:
Đáp án B
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol), nS = 0,15 9mol)
nH2S = nMgS = nS = 0,15 mol; nH2 = nMg (dư) = 0,2 – 0,15 =0,05 (mol)
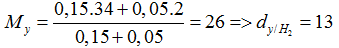
Bài 34:Kim loại nào sau đây khi tác dụng với lượng dư dung dịch H2SO4 loãng và dung dịch H2SO4 đặc, đun nóng thu được một loại muối?
A. Cu.
B. Cr.
C. Fe.
D. Mg.
Lời giải:
Hướng dẫn giải:
Đáp án D.
Cu không phản ứng với H2SO4 loãng, Fe, Cr + H2SO4 loãng cho muối hóa trị II, + H2SO4 đặc cho muối hóa trị III.
Bài 35:Đun nóng 4,8 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đktc). Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 6,72
Lời giải:
Hướng dẫn giải:
Đáp án C.
Mg + S → MgS
nMg = 0,2 (mol); nS =0,3 (mol) ⇒ S dư; nMgS = 0,2 (mol)
MgS + 2HCl → MgCl2 + H2S ↑
⇒ V = 0,2.22,4 = 4,48 (lít)
Bài 36:Phương trình hóa học nào sau đây là sai?
A. 2Fe + 3H2SO4 → Fe2(SO4)3 + 3H2
B. 2Na + 2HCl → 2NaCl + H2
C. FeS + H2SO4 (loãng) → FeSO4 + H2S
D. 2Cr + 3Cl2 → 2CrCl3.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Fe + H2SO4 → FeSO4 + H2
Bài 37:Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn.
B. Muối ăn.
C. Cồn.
D. Xút.
Lời giải:
Hướng dẫn giải:
Đáp án D.
2NaOH + SO2 → Na2SO3 + H2O
Bài 38:Hấp thụ V lít SO2 (đktc) vào 300 ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V
A. 2,24
B. 1,12
C. 11,2
D. A & C
Lời giải:
Hướng dẫn giải:
Đáp án D.
Trường hợp 1: Ba(OH)2 dư, SO2 hết , nBaSO3 = nSO2
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 ← 0,1
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH)2 hết, SO2 dư nhưng không hòa tan hết kết tủa (kết tủa chỉ tan một phần)
Ba(OH)2 + SO2 → BaSO3 ↓+ H2O
0,1 0,1 ← 0,1
Ba(OH)2 + 2SO2 → Ba(HSO3)2
( 0,3 – 0,1) → 0,4
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2lít
Bài 39:Tỉ khối của hỗn hợp X gồm oxi và ozon so với hiđro là 18. Phần trăm thể tích của oxi và ozon có trong hỗn hợp X lần lượt là:
A. 25% và 75%
B. 30% và 70%
C. 50% và 50%
D.75% và 25%
Lời giải:
Hướng dẫn giải:
Đáp án D
Coi số mol hỗn hợp X = 1 mol.
nO2 = x, nO3 = y (mol)
x + y = 1
32x + 48y = 1.18.2
⇒ x = 0,75, y = 0,25 (mol)
⇒ %VO2 =75%, %VO3 = 25%
Bài 40:Trường hợp nào sau đây không đúng?
A. SO2 vừa là chất oxi hóa, vừa là chất khử.
B. Phản ứng giữa H2S và SO2 dùng để thu hồi S trong các khí thải.
C. Ozon có tính khử mạnh và khử được Ag ở điều kiện thường.
D. Phản ứng giữa H2SO4 đặc với hợp chất hữu cơ gọi là sự than hoá.
Lời giải:
Hướng dẫn giải:
Đáp án C.
Ozon oxi hóa Ag
2Ag + O3 → Ag2O + O2.

Bài 41:Trong sơ đồ: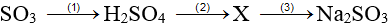
A. SO2.
B. H2S.
C. H2S và SO2.
D. S.
Lời giải:
Hướng dẫn giải:
Đáp án A.
SO3 + H2O → H2SO4
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
SO2 + 2NaOH → Na2SO3 + H2O
Bài 42:Đốt cháy hoàn toàn 3,4 g một chất X thu được 6,4 g SO2 và 1,8 g H2O. X có công thức phân tử là
A. H2S
B. H2SO4
C. H2SO3
D. H3SO4
Lời giải:
Hướng dẫn giải:
Đáp án A.
Đốt cháy X thu đc SO2 vào H2O ⇒ Trong X có S,H và có thể có O
Trong 64 SO2 có 32g S
7.04______x g S
x=3,52g ⇒ nS = 0,11 (mol)
Trong 18g H2O có 2g H
1.98 y g H
y=0,22g ⇒ nH = 0,22(mol)
mO=3.74-3.52-0.22=0
Vậy trong X có H và S
Gọi CT X là HxSy
Ta có: x:y=0, 22: 0,11=2:1
⇒ CT X: H2S
Bài 43:Đốt 13 g bột một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2 g (giải sử hiệu suất phản ứng là 100%). Kim loại đó là:
A. Cu
B. Zn
C. Fe
D. Ca
Lời giải:
Hướng dẫn giải:
Đáp án B.
Gọi kim loại là R.
Bảo toàn khối lượng mO = 16,2-13 = 3,2
⇒ nO2 = 0,1 (mol)
2R + O2 → 2RO
0,2 0,1
MR = 65(Zn)
Bài 44:Dãy gồm các chất chỉ có tính oxi hóa là:
A. H2O2, HCl, SO3.
B. O2, Cl2, S8.
C. O3, KClO4, H2SO4.
D. FeSO4, KMnO4, HBr.
Lời giải:
Hướng dẫn giải:
Đáp án C
Bài 45:Chọn trường hợp sai:
A. H2SO4 đặc tác dụng với đường cho muội than.
B. Khí SO2 làm mất màu dung dịch Br2, dung dịch KMnO4.
C. Pha loãng axit H2SO4 đặc bằng cách cho từ từ nước vào axit đặc.
D. Khí H2S tác dụng với FeCl3 tạo bột màu vàng.
Lời giải:
Hướng dẫn giải:
Đáp án C.
Cho từ từ axit vào nước.
Bài 46:Phát biểu nào sau đây không đúng?
A. SO2 có thể làm mất màu dung dịch brom.
B. H2S có mùi trứng thối.
C. SO3 tác dụng mạnh với nước và toả nhiệt.
D. H2S không phản ứng được với Cu(NO3)2.
Lời giải:
Hướng dẫn giải:
Đáp án D.
H2S + Cu(NO3)2 → CuS + 2HNO3
Bài 47:Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2(đktc). Giá trị của V là
A. 2,80
B. 3,36
C. 3,08
D. 4,48
Lời giải:
Hướng dẫn giải:
Đáp án A.
nFe = 0,1 (mol), nS=0,075 (mol)
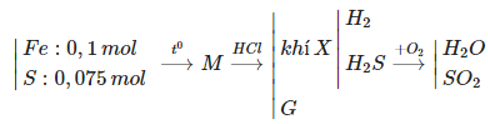
Fe ⟶ Fe2+ + 2e O2 + 4e → O2-
0,1 → 0,2 mol
S → S4+ + 4e
0,075 → 0,3 mol
Bảo toàn e: nFe.2 + nS.4 = nO2.4
⇒ nO2 = 0,125 (mol)
⟹ VO2 = 0,125.22,4 = 2,8 (lít).
Bài 48:Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a:b bằng
A. 2:1
B. 1:1
C. 3:1
D. 3:2
Lời giải:
Hướng dẫn giải:
Đáp án A.
Fe + S → FeS
FeS + 2HCl → FeCl2 + H2S;
Fe + 2HCl → FeCl2 + H2
MZ = 5.2 = 10; Chọn 1 mol Z
⇒ nH2 + nH2S = 1
2nH2 + 34nH2S =10
⇒ nH2 =0,75 ; nH2S = 0,25
nFeS =nH2S = 0,25 mol; nFe (dư) = nH2S = 0,75 mol
⇒ nFe(bđ) = 0,25 + 0,75 = 1 (mol) ⇒ nS(bđ) = 0,25.100/50 = 0,5 (mol)
⇒ a : b = 1 : 0,5 = 2 : 1
Bài 49:Để phân biệt được 3 chất khí: CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt, người ta dùng thuốc thử là
A. Nước vôi trong.
B. Dung dịch Br2.
C. Nước vôi trong và dung dịch Br2.
D. Dung dịch KMnO4.
Lời giải:
Hướng dẫn giải:
Đáp án C.
Chất làm mất màu dung dịch brom là SO2.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Chất làm đục nước vôi trong là CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Còn lại là O2
Bài 50:Có thể dùng H2SO4 đặc để làm khô tất cả các khí trong dãy nào?
A. CO2, NH3, Cl2, N2.
B. CO2, H2S, N2, O2.
C. CO2, N2, SO2, O2.
D. CO2, H2S, O2, N2.
Lời giải:
Hướng dẫn giải:
Đáp án C.
Nguyên tắc làm khô là H2SO4 đặc không phản ứng với chất được làm khô
Bài 51:Dẫn 8,96 lít (đktc) hỗn hợp khí X gồm H2S và CO2 vào lượng dư dung dịch Pb(NO3)2, thu được 23,9 gam kết tủa. Thành phần phần trăm thể tích của H2S trong X là
A. 25%
B. 50%
C. 60%
D. 75%
Lời giải:
Hướng dẫn giải:
Đáp án A
nX = 0,4 (mol)
n↓ = nPbS = 0,1 (mol)
Pb(NO3)2 + H2S → PbS + 2HNO3
Bài 52:Cho hỗn hợp khí oxi và ozon, sau một thời gian ozon bị phân hủy hết (2O3 3O2) thì thể tích khí tăng lên so với ban đầu là 2 lít. Thể tích của ozon trong hỗn hợp ban đầu là:
A. 4 lít O3
B. 3 lít O3
C. 2 lít O3
D. 6 lít O3
Lời giải:
Hướng dẫn giải:
Đáp án A.
2 O3 → 3 O2
2lít O3 → 3lít O2 Vtăng = 1 lít
X lít O3 → Vtăng = 2 lít
⇒ X = 4
Bài 53:Hỗn hợp khí A gồm có O2 và O3,tỉ khối của hỗn hợp khí A đối với hiđro là 19,2. Hỗn hợp khí B gồm H2 và CO, tỉ khối của hỗn hợp khí B đối với hiđro là 3,6.Thành phần phần trăm theo thể tích của H2 và O2 lần lượt là?
A. 80%, 60%
B. 20%, 40%
C.80%, 60%
D. 20%, 60%
Lời giải:
Hướng dẫn giải:
Đáp án A
Gọi số mol O2 trong 1 mol hỗn hợp A là x, thì số mol O3 trong hỗn hợp là (1 – x)
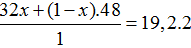
⇒ %VO2 = 60%,%VO3 = 40%.
- Gọi số mol H2 trong 1 mol hỗn hợp A là y, thì số mol CO trong hỗn hợp là (1 – y)
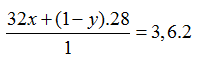
Giải được: y = 0,8 ⇒ %VH2 = 80%; Vco = 20%
Bài 54:Cho các cặp phản ứng sau:
(1) H2S + Cl2 + H2O →
(2) SO2 + H2S →
(3) SO2 + Br2 + H2O →
(4) S + H2SO4 đặc, nóng →
(5) S + F2 →
(6) SO2 + O2 →
Tổng số phản ứng tạo ra sản phẩm chứa lưu huỳnh ở mức oxi hóa +6 là:
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Hướng dẫn giải:
Đáp án C.
(1) H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
(3) SO2 + Br2 + 2H2O → 2HBr + H2SO4
(5) S + 3F2 → SF6
(6) 2SO2 + O2 → 2SO3
Bài 55:Dẫn 2,24 lít khí SO2 (đkc) vào 200 ml dung dịch KOH 1,5M vậy khi phản ứng xảy ra hoàn toàn thì thu được:
A. K2SO3 0,1M và KOH dư 0,4M
B. KHSO3 0,1M
C. K2SO3 0,5M và KOH dư 0,5M
D. KHSO3 0,1M và K2SO3 0,5M
Lời giải:
Hướng dẫn giải:
Đáp án C.
nSO2 = 0,1 (mol); nKOH = 2.0,15 = 0,3 (mol)
nKOH/nSO2=0,3/0,1=3
Tạo K2SO3
SO2 + 2KOH → K2SO3 + H2O
0,1 0,2 0,1
nKOH dư = 0,1 mol ⇒ CKOH = 0,5M,
Bài 56:Hỗn hợp khí X gồm O2 và O3, tỉ khối hơi của X đối với H2 là 19,2. Đốt cháy hoàn toàn a mol khí CO cần 1 mol X. Giá trị của a là
A. 1,0
B. 2,0
C. 2,4
D. 2,6
Lời giải:
Hướng dẫn giải:
Đáp án C.
MX = 19,2.2 = 38,4 ⇒
nO2 +nO3 =1 ;
32nO2 + 48nO3 = 38
⇒ nO2 =0,6 (mol) ;nO3 = 0,4 (mol)
CO + O → CO2 ⇒ nCO = a = 2nO2 + 3nO3 = 2.0,6 + 3.0,4 = 2,4 (mol)
Bài 57:Cho các cặp chất sau:
(1) Khí Cl2 và khí O2.
(2) Khí H2S và khí SO2.
(3) Khí H2S và dung dịch Pb(NO3)2.
(4) CuS và dung dịch HCl.
(5) Khí Cl2 và dung dịch NaOH.
Số cặp chất xảy ra phản ứng hoá học ở nhiệt độ thường là
A. 4.
B. 3.
C. 2.
D. 1.
Lời giải:
Hướng dẫn giải:
Đáp án B.
Các cặp 2,3,5
H2S + Pb(NO3)2 → PbS + 2HNO3
2H2S + SO2 → 3S + 2H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
Bài 58:Tiến hành các thí nghiệm sau
(1) O3 tác dụng với dung dịch KI.
(2) axit HF tác dụng với SiO2.
(3) khí SO2 tác dụng với nước Cl2.
(4) KClO3 đun nóng, xúc tác MnO2.
(5) Cho H2S tác dụng với SO2.
Số thí nghiệm tạo ra đơn chất là
A. 3.
B. 2.
C. 4.
D. 1.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Các thí nghiệm 1,4,5.
O3 + 2KI + H2O → 2KOH + I2 + O2
2KClO3 → 2KCl + 3O2
2H2S + SO2 → 3S + 2H2O
Bài 59:Cho 11 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 12,8 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 11 gam hỗn hợp đầu là
A. 5,6 gam.
B. 11,2 gam.
C. 2,8 gam.
D. 8,4 gam.
Lời giải:
Hướng dẫn giải:
Đáp án A.
nS = 0,4 (mol)
⇒ mhh = mFe + mAl
Bảo toàn electron: 2nFe+ 3nAl = 2nS
⇒ 56nFe + 27 nAl = 11 ; 2nFe + 3nAl = 2.0,4
⇒ nFe = 0,1, nAl = 0,2 ⇒ mFe = 0,1.56 = 5,6 (gam)
Bài 60:Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl dư , thu được 2,464 lít hỗn hợp khí X(đktc). Cho hỗn hợp khí này qua dung dịch Pb(NO3)2 dư thu 23,9g kết tủa màu đen . thể tích các khí trong hỗn hợp khí X là:
A. 0,224lít và 2,24 lít
B. 0,124 lít và 1,24 lít
C. 0,224lít và 3,24 lít
D.Kết quả khác
Lời giải:
Hướng dẫn giải:
Đáp án A
FeS + 2HCl → FeCl2 + H2S
Fe + 2HCl → FeCl2 + H2
Pb(NO3)2 + H2S → PbS + 2HNO3
nkhí = 0,11 (mol) ;nH2S = nPbS = 0,1 (mol)
⇒ nH2 = 0,11 – 0,1 = 0,01 (mol)
⇒ VH2S=2,24 (l) ,VH2=0,224 (lít)
Bài 61:Hỗn hợp X gồm hai khí SO2 và CO2 có tỉ khối đối với H2 là 27. Thành phần % theo khối lượng của SO2 là:
A. 35,5%
B. 59,26%
C. 40%
D. 50%
Lời giải:
Hướng dẫn giải
Đáp án D
Coi số mol hỗn hợp X = 1 mol.
nSO2 = x,nCO2 = y (mol)
x + y = 1
64x + 44y = 1.27.2
⇒ x = y = 05 (mol)
⇒ %VO2 = %VO3= 50%
Bài 62:Axit sunfuric đặc không được dùng để làm khô khí nào sau đây?
A. O3.
B. Cl2.
C. H2S.
D. O2.
Lời giải:
Hướng dẫn giải:
Đáp án C.
Do phản ứng: H2S + H2SO4 → S + 2H2O + SO2
Bài 63:Cho FeS tác dụng với dung dịch H2SO4 loãng, thu được khí A; nếu dùng dung dịch H2SO4 đặc, nóng thì thu được khí B. Dẫn khí B vào dung dịch A thu được rắn C. Các chất A, B, C lần lượt là:
A. H2, H2S, S.
B. H2S, SO2, S.
C. H2, SO2, S.
D. O2, SO2, SO3.
Lời giải:
Hướng dẫn giải:
Đáp án B.
FeS + H2SO4 → FeSO4 + H2S
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
2H2S + SO2 → 3S + 2H2O
Bài 64:Cho 33,2g hỗn hợp X gồm Cu, Mg, Al tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 22,4 lít khí ở đktc và chất rắn không tan B. Cho B hoà tan hoàn toàn vào dung dịch H2SO4 đặc, nóng dư thu được 4,48 lít khí SO2(đktc). Khối lượng mỗi kim loại trong hỗn hợp X lần lượt là:
A. 13,8; 7,6; 11,8
B. 11,8; 9,6; 11,8
C.12,8; 9,6; 10,8
D. kết quả khác
Lời giải:
Hướng dẫn giải:
Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có 64x + 24y + 27z = 33,2 (1)
Bảo toàn e: 2nMg + 3nAl = 2
⇒ 2y + 3z = 2.1 (2)
⇒ x = 0,2 (mol) (3)
Từ 1, 2, 3 ⇒ x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g); mMg = 0,4.24 = 9,6 (g); mAl = 10,8 (g)
Bài 65:Cho 11,2 g kim loại X tác dụng hết với H2SO4 đặc, nóng thu được 6,72 lít khí SO2 (đktc). Tên kim loại là:
A. đồng
B. sắt
C. kẽm
D. nhôm
Lời giải:
Hướng dẫn giải:
Đáp án B
Gọi hóa trị của kim loại là a.
nSO2 = 0,3 (mol)
Bảo toàn e nX.a = 2 nSO2
⇒ nX = 0,6/a
Mặt khác mX = 11,2 ⇒ MX = 56a/3
Với a = 3 MX = 56 (Fe)

Bài 66:Cho các phản ứng sau:
(1) Na2SO3+ HCl → khí X
(2) KMnO4
(3) Ca(HCO3)2 + HCl → khí Z
(4) FeS + HCl → khí T
Cho hỗn hợp chứa các khí trên đi qua bình đựng dung dịch NaOH dư. Số khí thoát ra khỏi bình là
A. 2.
B. 4.
C. 3.
D. 1.
Lời giải:
Hướng dẫn giải:
Đáp án D.
(1) Na2SO3+ HCl → 2NaCl + H2O + SO2
(2) 2KMnO4
(3) Ca(HCO3)2 + 2HCl → CaCl2 + H2O + CO2
(4) FeS + 2HCl → FeCl2 + H2S
Khí thoát ra khỏi bình là khí không phản ứng với NaOH. O2 không phản ứng với NaOH.
Bài 67:Hòa tan hỗn hợp gồm Fe và FeS vào dung dịch HCl dư, thu được 8,96 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3)2 dư thì thu được 23,9 gam kết tủa đen. Khối lượng Fe trong hỗn hợp đầu là
A. 11,2
B. 16,8
C. 5,6
D. 8,4
Lời giải:
Hướng dẫn giải:
Đáp án B
FeS + 2HCl → FeCl2 + H2S
Fe + 2HCl → FeCl2 + H2
Pb(NO3)2 + H2S → PbS + 2HNO3
nkhí = 8,96/22,4 = 0,4 (mol) ;nH2S = nPbS = 0,1 (mol)
⇒ nFe =nH2 = 0,4 – 0,1 = 0,3 (mol) ⇒ mFe = 0,3.56 = 16,8 (gam)
Bài 68:Điều chế khí Y trong phòng thí nghiệm
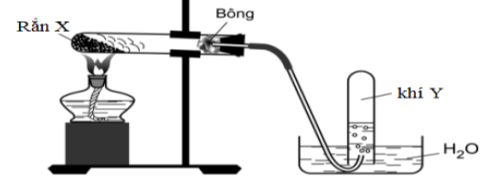
Cho các nhận định sau:
(a) Chất rắn X là KMnO4 thì khí Y là O2.
(b) Chất rắn X là NaNO3 thì khí Y là N2.
(c) Chất rắn X là KClO3 thì khí Y là Cl2.
(d) Chất rắn X là CaCO3 thì khí Y là O2.
Số nhận định đúng là
A. 2.
B. 3.
C. 1.
D. 4.
Lời giải:
Hướng dẫn giải: Đáp án A.
Bài 69:Điều chế oxi trong phòng thí nghiệm theo mô hình sau:

Nhận định nào sau đây là sai?
A. X là KMnO4.
B. X là NaHCO3.
C. X là (KClO3 + MnO2).
D. X là NaNO3.
Lời giải:
Hướng dẫn giải: Đáp án B.
Bài 70:Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là
A. 28%
B. 56%
C. 42%
D. 84%
Lời giải:
Hướng dẫn giải:
Đáp án D.
Fe + S → FeS
FeS + 2HCl → FeCl2 + H2S;
Fe + 2HCl → FeCl2 + H2
nFe(bđ) = nFeS + nFe(dư) = nH2S + nH2 = 6,72/22,4 = 0,3 (mol)
%mFe = (0,3.56)/20= 84%
Bài 71:Hình vẽ mô tả điều chế khí SO2 trong phòng thí nghiệm:
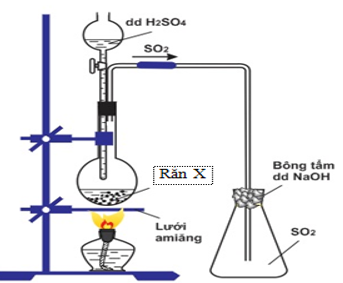
Điều nào sau đây là sai?
A. X là Na2SO3.
B. X là NaHSO3.
C. X là FeS.
D. X là Ba(HSO3)2.
Lời giải:
Hướng dẫn giải: Đáp án C.
Bài 72:Hoà tan hoàn toàn 6,05 g hỗn hợp X gồm Fe, Mg Zn bằng một lượng vừa đủ H2SO4 loãng thấy thoát 2,688 H2 ở đktc và dung dịch chứa m gam muối. Giá trị của m là:
A. 17,57g
B.18,98
C.17,25g
D. 9,52g
Lời giải:
Hướng dẫn giải:
Đáp án A.
nH2 = 0,12 (mol)=nH2SO4
Bảo toàn khối lượng: 6,05 + 0,12.98 = m + 0,12.2
m = 17,57 gam
Bài 73:Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H2SO4 loãng, thu được 4,48 lít H2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Lời giải:
Hướng dẫn giải:
Đáp án A
nH2 = 0,2 (mol)
⇒ mhh= mFe + mAl
Bảo toàn electron: 2nFe + 3nAl =2
⇒ 56nFe + 27nAl = 5,5 ; 2nFe + 3nAl = 2.0,2
⇒ nFe = 0,05 ; nAl = 0,1 ⇒ %mFe = 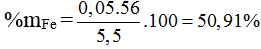
Bài 74:Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch H2SO4 loãng (dư), thu được 6,72 lít khí (đktc). Nếu cho m gam hỗn hợp X trên vào một lượng dư dung dịch H2SO4 (đặc, nguội), thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 23,0
B. 21,0
C. 24,6
D. 30,2
Lời giải:
Hướng dẫn giải:
Đáp án C
nH2 = 0,3 (mol);nSO2 = 0,3 (mol)
Bảo toàn electron:
3nAl = 2nH2 ; 2nCu = 2nSO2
⇒ nAl = 0,2; nCu = 0,3 ⇒ m = 0,2.27 + 0,3.64 = 24,6 (gam)
Lưu ý: khi cho X vào H2SO4 loãng chỉ có Al phản ứng.
Khi cho X vào H2SO4 đặc nguội chỉ có Cu phản ứng
Bài 75:Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có khí nào sau đây?
A. SO2.
B. H2S.
C. NH3.
D. CO2.
Lời giải:
Hướng dẫn giải:
Đáp án B
H2S + Pb(NO3)2 → PbS + 2HNO3
Bài 76:Mưa axit ảnh hưởng tới hệ thực vật, phá hủy các vật liệu bằng kim loại, các bức tượng bằng đá, gây bệnh cho con người và động vật. Hiện tượng trên gây ra chủ yếu do khí thải của nhà máy nhiệt điện, phương tiện giao thông và sản xuất công nghiệp. Tác nhân chủ yếu trong khí thải gây ra mưa axit là
A. SO2 và NO2.
B. CH4 và NH3.
C. CO và CH4.
D. CO và CO2.
Lời giải:
Hướng dẫn giải: Đáp án A
Bài 77:Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng 1 lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít khí hidro (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 9,52
B. 10,27
C. 8,98
D. 7,25
Lời giải:
Hướng dẫn giải:
Đáp án C
nH2 = 0,06 (mol) ⇒ nH2SO4 =nH2 = 0,06 mol
Bảo toàn khối lượng: 3,22 + 0,06.98 = m + 0,06.2
m = 8,98 gam
Bài 78:Cho các phản ứng sau:
a. FeS2 + O2 → X + Y
b. X + H2S → Z + H2O
c. Z + T → FeS
d. FeS + HCl → M + H2S
e. M + NaOH → Fe(OH)2 + N.
Các chất được ký hiệu bằng chữ cái X, Y, Z, T, M, N có thể là:
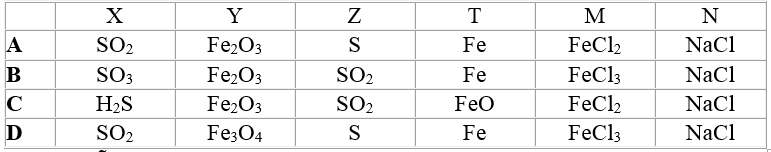
Lời giải:
Hướng dẫn giải:
Đáp án A.
a. 4FeS2 + 11O2 → 8SO2 + 2Fe2O3
b. SO2 + 2H2S → 3S + 2H2O
c. S + Fe → FeS
d. FeS + 2HCl → FeCl2 + H2S
e. FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl.
Bài 79:Cho các phát biểu sau:
(1) Để xử lý thủy ngân rơi vãi, người ta có thể dùng bột lưu huỳnh.
(2) Khi thoát vào khí quyển, freon phá hủy tần ozon.
(3) Lưu huỳnh đioxit là chất khí không màu, mùi hắc, nặng hơn không khí.
(4) Lưu huỳnh trioxit là chất khí không màu, tan vô hạn trong nước và tạo thành axit sunfuric.
Trong các phát biểu trên, số phát biểu đúng là
A. 3.
B. 4.
C. 2.
D. 1.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Các phát biểu đúng: 1,2,3.
Bài 80:Cho các phát biểu sau:
(a) Sục khí SO2 vào dung dịch NaOH dư tạo ra muối trung hòa Na2SO3.
(b) SO2 vừa có tính khử, vừa có tính oxi hóa.
(c) Khí SO2 là một trong những nguyên nhân chính gây ra mưa axit.
(d) Khí SO2 có màu vàng lục và rất độc.
Số phát biểu đúng là
A. 3.
B. 1.
C. 4.
D. 2.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Các phát biểu đúng a,b,c

Bài 81:Nung hỗn hợp bột kim loại gồm 11,2 gam Fe và 6,5 gam Zn với một lượng S dư (trong điều kiện không có không khí), thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được khí Y. Hấp thụ toàn bộ Y vào dung dịch NaOH 1M. Thể tích dung dịch NaOH 1M tối thiểu để hấp thụ hết khí Y là
A. 200 ml
B. 300 ml
C. 400 ml
D. 100 ml
Lời giải:
Hướng dẫn giải:
Đáp án B.
nFe = 0,2 mol; nZn = 0,1 mol
NaOH + H2S → NaHS + H2O
nNaOH =nH2S = nFeS + nZnS = 0,3 mol ⇒ V = 0,3 lít
Bài 82:Dẫn từ từ V lít khí SO2 (đktc) vào lượng dư dung dịch Br2, không thấy khí thoát ra. Thêm tiếp dung dịch BaCl2 dư vào dung dịch sau phản ứng, thu được 23,3 gam kết tủa. Giá trị của V là
A. 4,48
B. 1,12
C. 3,36
D. 2,24
Lời giải:
Hướng dẫn giải:
Đáp án D.
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
BaCl2 +H2SO4 → BaSO4 + 2HCl
nSO2 =nH2SO4 =nBaSO4= 0,1 mol ⇒ V = 0,1.22,4 = 2,24 lít
Bài 83:Có các thí nghiệm sau:
(I) Nhúng thanh sắt vào dung dịch H2SO4 loãng, nguội.
(II) Sục khí SO2 vào nước brom.
(III) Sục khí CO2 vào nước Gia-ven.
(IV) Nhúng lá nhôm vào dung dịch H2SO4 đặc, nguội.
Số thí nghiệm xảy ra phản ứng hóa học là
A. 4.
B. 3.
C. 1.
D. 2.
Lời giải:
Hướng dẫn giải:
Đáp án B.
Các phản ứng 1,2,3.
Fe + H2SO4 → FeSO4 + H2
SO2 + H2O + Br2 → 2HBr + H2SO4
CO2 + NaClO + H2O → NaHCO3 + HClO
Bài 84:Cho 25,5 gam hỗn hợp X gồm CuO và Al2O3 tan hoàn toàn trong dung dịch H2SO4 loãng, thu được dung dịch chứa 57,9 gam muối. Phần tẳm khối lượng của Al2O3 trong X là
A. 60%
B. 40%
C. 80%
D. 20%
Lời giải:
Hướng dẫn giải:
Đáp án D.
CuO → CuSO4
a a (mol)
Al2O3 → Al2(SO4)3
b b (mol)
80a + 102b = 25,5
160a + 342b = 57,9
⇒ a =0,255 , b =0,05 (mol)
⇒ 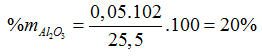
Sử dụng thông tin trả lời câu hỏi 90, 91.
Hòa tan hoàn toàn 24 gam hỗn hợp X gồm MO, M(OH)2 và MCO3 (M là kim loại có hóa trị không đổi) trong 100 gam dung dịch H2SO4 39,2%, thu được 1,12 lít khí(đktc) và dung dịch Y chỉ chứa một chất tan duy nhất có nồng độ 39,41%.
Bài 85:Khối lượng dung dịch sau phản ứng là:
A. 100 g
B. 121,8
C. 124
D. 125,3
Lời giải:
Đáp án B
Bài 86:Kim loại M là
A. Zn
B. Ca
C. Mg
D. Cu
Lời giải:
Đáp án C
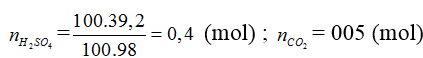
(MO, M(OH)2, MCO3) + H2SO4 → MSO4 + CO2 + H2O
mdd Y = 24 + 100 – 0,05.44 = 121,8 (gam)
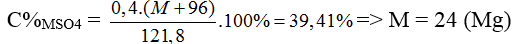
Bài 87:Có thể điều chế O2 bằng cách phân huỷ KMnO4, KClO3, H2O2. Nếu lấy cùng một lượng các chất trên đem phân huỷ hoàn toàn thì thể tích oxi trong cùng điều kiện thu được
A. Từ KMnO4 là lớn nhất
B. Từ KClO3 là lớn nhất
C. Từ H2O2 là lớn nhất
D. bằng nhau
Lời giải:
Hướng dẫn giải:
Đáp án B.
PTHH: 2KMnO4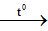
K2MnO4 + MnO2 + O2
m/158 m/79
2H2O2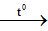
2H2O + O2
m/34 m/17
2KClO3 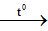
2KCl + 3O2
m/122,5 3m/245
Bài 88:Trong công nghiệp, axit sunfuric được điều chế từ quang pirit sắt. Khối lượng H2SO4 điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% FeS2 ( hiệu suất toàn quá trình là 80%) là
A. 1,568 tấn
B. 1,96 tấn
C. 1,25 tấn
D. 2,00 tấn
Lời giải:
Hướng dẫn giải:
Đáp án A.
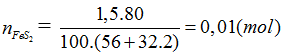
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80% ⇒ nH2SO4 = 0,02.0,8 = 0,016 (mol)
mH2SO4 =0,016.98 =1,568 tấn
Bài 89:Khi hòa tan hidroxit kim loại M(OH)2 bằng một lượng vừa đủ dung dịch H2SO4 20%, thu được dung dịch muối trung hòa có nồng độ 27,21%. Kim loại M là
A. Cu
B. Zn
C. Fe
D. Mg
Lời giải:
Hướng dẫn giải:
Đáp án A.
Coi = 1 mol
M(OH)2 + H2SO4 → MSO4 + 2H2O
mddH2SO4 = 1.98.100/20 = 490 (gam)
⇒ mdd sau = (M + 34) + 490 = M + 524
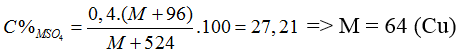
Bài 90:H2S bị oxi hóa thành lưu huỳnh màu vàng khi:
1) Dẫn khí H2S qua dung dịch FeCl3
2) Để dung dịch H2S ngoài trời
3) Đốt khí H2S ở điều kiện thiếu oxi
A. 1 và 2
B. 1 và 3
C. 2 và 3
D. 1, 2 và 3
Lời giải:
Hướng dẫn giải:
Đáp án B.
Các phương trình phản ứng xảy ra:
H2S + 2FeCl3 → 2FeCl2 + S↓ + 2HCl
2H2S + O2 → 2S↓ + 2H2O
Bài 91:Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn hợp rắn (có chứa một oxit) nặng 0,95 m gam. Phần trăm khối lượng PbS đã bị đốt cháy là
A. 74,69%
B. 95,00%
C. 25,31%
D. 64,68%
Lời giải:
Hướng dẫn giải:
Đáp án A.
0,95m (g) → hh (PbO và PbS dư) + SO2
Áp dụng ĐLBTKH ta có:
mO = m – 0,95m = 0,05m (g) → nO = 3,125.10-3 m (mol)
Ta có: nPbS phản ứng = nPbO = nO = 3,125.10-3 m (mol)
→ %PbS (đã bị đốt cháy) = (3,125. 10-3 m.239.100% )/m = 74,69%
Bài 92:Cho các phản ứng sau:
(1) SO2 + H2S → S + H2O
(2) SO2 + KMnO4 + H2O → MnSO4 + K2SO4 + H2SO4
(3) SO2 + Br2 + H2O → H2SO4 + HBr
(4) SO2 + Ca(OH)2 → Ca(HSO3)2
Số phản ứng mà SO2 đóng vai trò là chất khử là
A. 2.
B. 1.
C. 3.
D. 4.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Phản ứng 2, 3
(2) 5S+4O2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2S+6O4
(3)S+4O2 + Br2 + 2H2O → H2S+6O4 + 2HBr
Bài 93:Từ 1,6 tấn quặng có chứa 60% FeS2, người ta có thể sán xuất được khối lượng axit sunfuric là bao nhiêu?
A. 1558kg
B. 1578kg
C. 1548kg
D. 1568kg
Lời giải:
Hướng dẫn giải:
Đáp án D
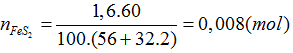
FeS2 → 2SO2 → 2SO3 → 2H2SO4
0,008 0,016 (tấn mol)
mH2SO4=0,16.98.1000=1568(kg)
Bài 94:Hòa tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml axit H2SO4 0,1M (vừa đủ). Sau phản ứng cô cạn dung dịch hỗn hợp muối sunfat khan thu được có khối lượng là
A. 6,81 gam
B. 4,81 gam
C. 3,81 gam
D. 5,81 gam
Lời giải:
Hướng dẫn giải:
Đáp án A.
mH2SO4 =mH20 = 0,1.0,5 = 0,05 (mol)
Bảo toàn khối lượng: 2,81 + 0,05.98 = m + 0,05.18
m = 6,81 gam
Bài 95:Trong phòng thí nghiệm khí oxi có thể được điều chế bằng cách nhiệt phân muối KClO3 có MnO2 làm xúc tác và có thể được thu bằng cách đẩy nước hay đẩy không khí:
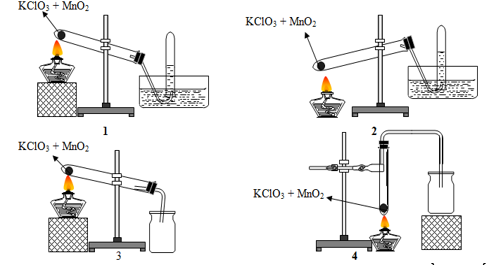
Trong các hình vẽ cho ở trên, hình vẽ mô tả điều chế và thu khí oxi đúng cách là
A. 1 và 2.
B. 2 và 3.
C. 1 và 3.
D. 3 và 4.
Lời giải:
Hướng dẫn giải: Đáp án C.

Bài 96:Dẫn 3,36 lít khí H2S (đktc) vào 250 ml dung dịch KOH 2M, sau khi phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam rắn khan. Giá trị của m là:
A. 16,5.
B. 27,5.
C. 14,6.
D. 27,7.
Lời giải:
Hướng dẫn giải:
Đáp án D.
nH2S = 0,15 (mol); nKOH = 2.0,25 = 0,5 (mol)
nKOH/nH2S=3,3
⇒ Tạo KS
H2S + 2KOH → K2S + H2O
0,15 0,3 0,15
m=mK2S+mKOH=0,15.110+0,2.56=27,7(g)
Bài 97:Cho 3,56 oleum H2S2O7 vào lượng dư H2O, thu được dung dịch X. Để trung hòa toàn bộ X cần V ml dung dịch NaOH 1M. Giá trị của V là
A. 80
B. 40
C. 20
D. 60
Lời giải:
Hướng dẫn giải:
Đáp án A.
noleum = 0,02 (mol)
H2SO4.SO3 + H2O → 2H2SO4
0,02 0,04
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,04 0,08
⇒ V = 0,08 (lít)
Bài 98:Hòa tan hoàn toàn 2,44 gam hỗn hợp bột X gồm FexOy và Cu bằng dung dịch H2SO4đặc, nóng (dư). Sau phản ứng, thu được 0,504 lít khí SO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch chứa 6,6 gam hỗn hợp muối sunfat. Phần trăm khối lượng của Cu trong X là
A. 39,34%
B. 65,57%
C. 26,23%
D. 13,11%
Lời giải:
Hướng dẫn giải:
Đáp án C
nSO2 = 0,0225 (mol)
Gọi nFe = a, nCu = b (mol), nO = c (mol)
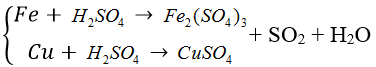
mhh = 56a+64b+16c = 2,44
mmuối = 400.0,5a+160b = 6,6
Bảo toàn electron: 3a+2b= 2c + 2.0,0225
⇒ a=0,025; b=0,01; c=0,025
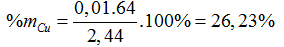
Bài 99:Hòa tan hết hỗn hợp X gồm Fe, FeS, Fe3O4 trong dung dịch H2SO4 đặc, nóng (dư) thu được dung dich Y có khối lượng giảm 48 gam và 38,08 lít SO2 (đktc). Cho Y tác dụng với dung dịch NaOH (dư), lấy kết tủa rồi nung trong không khí đến khối lượng không đổi còn 64 gam chất rắn Z. Tính phần trăm theo khối lượng của Fe trong X?
A. 68%
B. 73,68%
C. 43,18%
D.54%
Lời giải:
Hướng dẫn giải:
Đáp án B
nSO2 = 1,7 (mol)
Chất rắn Z là Fe2O3, nFe2O3=0,4 mol
2Febđ → Fe2O3
0,8 ← 0,4 (mol)
Ta có: mX = 1,7 ×64 – 48=60,8 (gam)
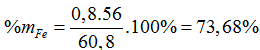
Bài 100:Chỉ dùng thêm một thuốc thử nào có thể phân biệt các dung dịch sau: BaCl2, MgSO4, Na2SO3, KNO3, K2S.
A. HCl
B. H2SO4
C. BaCl2
D. Ba(OH)2
Lời giải:
Hướng dẫn giải:
Đáp án B
Trích mỗi dung dịch một ít làm mẫu thử
Cho dung dịch H2SO4 lần lượt vào các mẫu thử trên
- Mẫu thử nào tạo kết tủa trắng là BaCl2
BaCl2 + H2SO4 → BaSO4 ↓+ 2HCl
- Mẫu thử nào tạo khí mùi hắc là Na2SO3
Na2SO3 + H2SO4 → Na2SO4+ SO2 ↑+ H2O
- Mẫu thử tạo mùi trứng thối là K2S
K2S + H2SO4 → K2SO4 + H2S↑
Cho dung dịch BaCl2 vừa mới nhận được lần lượt vào hai mẫu thử còn lại:
- Mẫu thử nào tạo kết tủa trắng là MgSO4
BaCl2 + MgSO4 → BaSO4↓ + MgCl2
- Mẫu thử không có hiện tượng gì là KNO3
Bài 101:Sử dụng nước và hóa chất nào sau đây làm thuốc thử, có thể phân biệt các chất bột sau: NaCl, CaCO3, Na2S, K2SO3 , Na2SO4
A. HCl
B. Qùy tím
C. NaOH
D. BaCl2
Lời giải:
Hướng dẫn giải:
Đáp án A
Cho H2O lần lượt vào các mẫu thử trên
- Mẫu thử không tan trong nước là CaCO3
- Các mẫu thử còn lại ta: NaCl, Na2S, K2SO3, Na2SO4
Cho dung dịch HCl dư lần lượt vào các mẫu thử tan.
- Mẫu thử tạo khí mùi trứng thối là Na2S
Na2S +2 HCl → 2NaCl + H2S↑
- Mẫu thử tạo khí mùi hắc là K2SO3
K2SO3 +2 HCl → 2KCl+ SO2↑+ H2O
- Hai chất không có hiện tượng gì là : NaCl và Na2SO4 (nhóm 1)
Cho dung dịch HCl dư vào chất không tan trong nước, sau đó lây dung dịch vừa thu được lần lượt tác dụng với 2 chất nhóm 1.
- Mẫu thử tạo kết tảu trắng là Na2SO4
CaCl2 + Na2SO4 → CaSO4 + 2NaCl
- Mẫu thử không có hiện tượng gì là NaCl
Bài 102:Trộn 0,8 mol SO2 với 20,16 lít O2 (đktc) trong bình kín có thể tích không đổi là 100 lít, đun nóng bình đến 400oC, ở nhiệt độ này thấy áp suất trong bình là 0,8 atm. % các chất khí trong bình là:
A. SO2 10%; O2 30%; SO3 60%
B. SO2 15%; O2 70%; SO3 15%
C. SO2 10%; O2 5%; SO3 65%
D. SO2 20,69%; O2 44,83%; SO3 34,48%
Lời giải:
Hướng dẫn giải:
Đáp án D
nO2 =0,9 (mol),nSO2 = 0,8 (mol)
2SO2 + O2 → 2SO3
Ban đầu 0,8 0,9 (mol)
Phản ứng 2x x 2x
Sau phản ứng 0,8-2x 0,9-x 2x
n sau phản ứng = 1,7-x
= 1,7 – x ⇒ x = 0,25 (mol)
Bài 103:Khi đốt 1 gam hỗn hợp đồng sunfua và kẽm sunfua có chứa 3,2% tạp chất không cháy, thu được một lượng khí có thể làm mất màu 100ml dung dịch iot 0,1M. Thành phần phần trăm theo khối lượng của hai muối sunfua trong hỗn hợp là?
A. 19,83% và 80,17%
B. 72,81% và 27,19%
C. 32,18% và 67,82%
D. 17,38% và 82,62%
Lời giải:
Hướng dẫn giải:
Đáp án A.
2CuS + 3O2 → 2CuO + 2SO2 ↑ (1)
(mol) a → a
2ZnS + 3O2 → 2ZnO + 2SO2 ↑ (2)
(mol) b → b
SO2 + I2 + 2H2 O → H2SO4 + 2HI (3)
(mol) 0,01 0,01
Khối lượng của hỗn hợp: ZnS và CuS là:
nI2 =0,1 ×0,1=0,01(mol)
Gọi a là số mol của CuS và b là số mol của ZnS
Ta có: 96a + 97b = 0,968
a + b = 0,01
⇒ a = 0,002, b = 0,008 (mol)
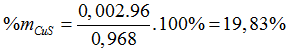
%mZnS =100% - 19,83% = 80,17%

Bài 104:Đun nóng 4,8 gam bột magie với 4,8 gam bột lưu huỳnh trong điều kiện không có không khí, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X vào dung dịch HCl dư, thu được hỗn hợp khí Y. My = ?
A. 9
B. 13
C. 26
D. 5
Lời giải:
Hướng dẫn giải:
Đáp án C.
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol); nS = 0,15 (mol)
= nMgS = nS = 0,15 mol; = nMg (dư) = 0,2 – 0,15 = 0,05 (mol)
⇒ MY = (0,15.34+0,05.2)/(0,15+0,05)=26
Bài 105:Dẫn 1,12 lít (đktc) hỗn hợp khí X gồm O2 và O3 đi qua dung dịch KI dư, sau phản ứng thu được 6,35 gam chất rắn màu tím đen. Phần trăm thể tích của ozon trong X là
A. 50%.
B. 25%.
C. 75%.
D. 80%.
Lời giải:
Hướng dẫn giải:
Đáp án A.
nX = 0,05 (mol)
nI2=0,025 mol
O3 + 2KI + H2O → 2KOH + O2 + I2
0,025 ← 0,025 (mol)
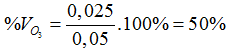
Bài 106:Hấp thụ 7,84 lít (đktc) khí H2S vào 64 gam dung dịch CuSO4 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Giá trị của m là:
A. 33,6.
B. 38,4.
C. 3,36.
D. 3,84.
Lời giải:
Hướng dẫn giải:
Đáp án D.
nH2S = 0,35 (mol),nCuSO4=(64,10)/(100.160)=0,04 mol
H2S + CuSO4 → CuS + H2SO4
0,35 0,04 0,04 (H2S dư)
m = 0,04.(64+32) = 3,84 (g)
Bài 107:Đốt cháy hoàn toàn V lít khí H2S (đktc) bằng một lượng oxi vừa đủ thu được khí Y. Hấp thụ hết Y cần vừa đủ 200 ml dung dịch KMnO4 1M. Giá trị của V là
A. 0,2.
B. 4,48.
C. 0,5.
D. 11,2
Lời giải:
Hướng dẫn giải:
Đáp án D.
nKMnO4=0,2 mol
2H2S + 3O2 → 2SO2 + 2H2O
0,5 0,5 (mol)
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4
0,5 0,2 (mol)
V = 0,5.22,4 =11,2 (lít)
Bài 108:Cho 5,6 lít (đktc) hỗn hợp khí X gồm H2S và SO2 tác dụng hết với 1,25 lít dung dịch nước brom vừa đủ. Thêm tiếp vào dung dịch sau phản ứng Ba(NO3)2 dư, thu được m gam kết tủa trắng. Giá trị của m là
A. 116,50.
B. 29,125.
C. 58,25.
D. 291,25.
Lời giải:
Hướng dẫn giải
Đáp án C
nkhí = 0,25 (mol)
nH2S = a(mol),nSO2 = b (mol)
H2S + 4Br2 + 4H2O → 8 HBr + H2SO4
a a
SO2 + Br2 + 2H2O → 2HBr + H2SO4
b b
H2SO4 + Ba(NO3)2 → BaSO4 + 2HNO3
a+b a+ b
m= 233.(a+b) = 233.0,25 = 58,35 g

Bài 109:Trộn 200 gam dung dịch H2SO4 12% với 300 gam dung dịch H2SO4 40% thu được 500 gam dung dịch H2SO4 a%. Giá trị của a là
A. 20,8%.
B. 28,8%.
C. 25,8%.
D. 30,8%
Lời giải:
Hướng dẫn giải
Đáp án B.
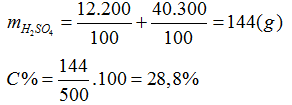
Bài 110:Lưu huỳnh tác dụng với dung dịch H2SO4 đặc nóng: S + H2SO4 → SO2 + H2O.
Trong phản ứng này có tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hoá là
A. 2:1.
B. 1:2.
C. 1:3.
D. 3:1
Lời giải:
Hướng dẫn giải:
Đáp án A.
S + 2H2SO4 → 3SO2 + 2H2O.
Bài 111:Hoà tan hoàn toàn m gam hỗn hợp X gồm Li2CO3, K2CO3, Na2CO3 trong dung dịch H2SO4 loãng, dư thu được dung dịch Y và 7,84 lít khí bay ra (đktc). Khi cô cạn dung dịch Y thu được 38,2 muối khan. Giá trị m là
A. 25,6.
B. 50,8.
C. 51,2.
D. 25,4.
Lời giải:
Hướng dẫn giải:
Đáp án A.
Gọi công thức của hỗn hợp X là: M2CO3
nCO2=0,25 mol
M2CO3 + H2SO4 → M2SO4 + H2O + CO2
0,35 0,35 0,35
Bảo toàn khối lượng: mX + maxit = m muối + m nước + m khí
m + 0,35.98 = 38,2 + 0,35.18 + 0,35.44
⇒ m = 25,6 (g)
Bài 112:Trong công nghiệp người ta sản xuất axít sunfuric theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4. Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axít sunfuric từ quặng trên là
A. 40%.
B. 60%.
C. 80%.
D. 62,5%
Lời giải:
Hướng dẫn giải
Đáp án C.
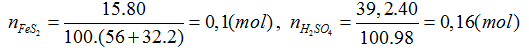
FeS2 → 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%
Bài 113:Hoà tan hoàn toàn 14,6 gam hỗn hợp kim loại X gồm Al, Zn bằng dung dịch H2SO4 đặc nóng thu được dung dịch Y và thoát ra 12,32 lít khí SO2 (đktc), sản phẩm khử duy nhất. Cô cạn cẩn thận dung dịch Y thu được m gam muối sunfat khan. Giá trị của m là
A. 118,7.
B. 53,0.
C. 100,6.
D. 67,4.
Lời giải:
Hướng dẫn giải
Đáp án D.
nSO2 = 0,55 ⇒ ne = 0,55.2 = 1,1 (mol)
mmuối = mKL + Mgốc axit. ne/2
= 14,6 + 96. 1,1/2 = 67,4 g
Bài 114:Hòa tan 18,4 gam hỗn hợp X gồm Fe và Cu trong dung dịch H2SO4 đặc, nóng dư thu được 7,84 lít SO2 (đktc) và dung dịch Y. Phần trăm khối lượng của Fe trong hỗn hợp X là
A. 60,87%.
B. 45,65%.
C. 53,26%.
D. 30,43%.
Lời giải:
Hướng dẫn giải:
Đáp án D.
Gọi nCu = y, nFe = x mol
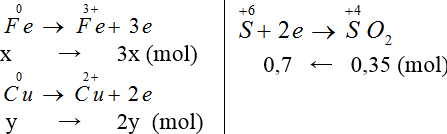
Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
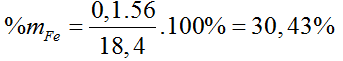
Bài 115:Cho hỗn hợp X gồm 0,08 mol mỗi kim loại Mg, Al, Zn vào dung dịch H2SO4 đặc, nóng, dư thu được 0,07 mol một sản phẩm khử duy nhất chứa lưu huỳnh. Xác định sản phẩm khử?
A. SO2.
B. S.
C. H2S.
D. SO3.
Lời giải:
Hướng dẫn giải
Đáp án C.
Bảo toàn e ta có
nMg.2 + nAl.3 + nZn.2 = nspk.x (x là số e thay đổi của sản phẩm khử)
0,08.2 + 0,08.3 + 0,08.2 = 0,07. x ⇒ x = 8 ⇒ Sản phẩm khử là H2S
Bài 116:Để hoà tan hoàn toàn 2,32 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3) cần dùng vừa đủ V lít dung dịch H2SO4 0,5M loãng. Giá trị của V là :
A. 0,23.
B. 0,18.
C. 0,08.
D. 0,16.
Lời giải:
Hướng dẫn giải:
Đáp án C.
Do số mol FeO bằng số mol Fe2O3,
Coi hỗn hợp chỉ có Fe3O4.
nFe3O4= 2,32/232=0,01 mol
Fe3O4 + 4H2SO4 → Fe2(SO4)3 + FeSO4 + 4H2O
0,01 0,04
V = 0,04/0,5 = 0,08 lít
Bài 117:Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M vừa đủ thu được dung dịch X . Cô cạn dung dịch X thu được lượng muối khan là :
A. 38,93 gam.
B. 103,85 gam.
C. 25,95 gam.
D. 77,86 gam.
Lời giải:
Hướng dẫn giải
Đáp án A.
nHCl = 0,5 (mol), = 0,14 (mol)
mmuối = m KL + m gốc axit (Cl, SO4)
= 7,74 + 0,5.35,5 + 0,14.96 = 38,93 (g)
Bài 118:Hoà tan 19,2 gam kim loại M trong H2SO4 đặc dư thu được khí SO2. Cho khí này hấp thụ hoàn toàn trong NaOH dư, sau phản ứng đem cô can dung dịch thu được 37,8 gam chất rắn. Kim loại M là
A. Cu.
B. Mg.
C. Fe.
D. Ca.
Lời giải:
Hướng dẫn giải
Đáp án A.
Do NaOH dư nên có phản ứng
nNa2SO3= 0,3 (mol)
2NaOH + SO2 → Na2SO3 + H2O
0,3 0,3 (mol)
Gọi hóa trị của M là x
Bảo toàn e ta có nM.x =nSO2.2 ⇒ nM = 0,6/x
MM = 32x, Với x = 2, M = 64 (Cu)
Bài 119:Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là :
A. SO2.
B. S.
C. H2S.
D. SO2, H2S.
Lời giải:
Đáp án C
nH2SO4 = 0,5 (mol)
nMg = 0,4 (mol) = nMgSO4
Bảo toàn S: nH2SO4 ⇒ nMgSO4+nS (trong X) ⇒ n S (trong X) = 0,1.
Bảo toản e: nMg.2 = nx.a (a là số e X đã nhận) ⇒ a = 8
Vậy sản phẩm khử là H2S
Bài 120:Hòa tan hoàn toàn 2,52 gam hỗn hợp Mg và Al bằng dung dịch HCl thu được 2,688 lít hiđro (đktc). Cũng lượng hỗn hợp này nếu hòa tan hoàn toàn bằng H2SO4 đặc nóng thì thu được 0,12 mol một sản phẩm X duy nhất hình thành do sự khử S+6. X là :
A. S.
B. SO2.
C. H2S.
D. S hoặc SO2.
Lời giải:
Hướng dẫn giải:
Đáp án B.
nH2 = 0,12 (mol)
Gọi số mol Mg = a, Al = b (mol)
24a + 27b = 2,52
Bảo toàn e: nMg.2 + nAl.3 = .2
2a + 3b = 0,12.2
⇒ a = 0,06, b =0,04 (mol)
Phản ứng với H2SO4 đặc
Bảo toàn e: nMg.2 + nAl.3 = nX.a (a là số e X đã nhận)
⇒ a = 2 , sản phẩm khử là SO2.
Bài 121:Hỗn hợp khí B gồm O2 và O3 có tỉ khối hơi so với H2 là 19,2. % về thể tích mỗi khí trong B là
A. 60% và 40%
B. 30% và 70%
C. 20% và 80%
D. 50% và 50%
Lời giải:
Hướng dẫn giải:
Đáp án A.
Coi số mol hỗn hợp X = 1 mol.
nO2 = x,nO3 = y (mol)
x + y = 1
32x + 48y = 1.19,2.2
x = 0,6, y = 0,4 (mol)
⇒ %VO3=40%, %VO2=60%

Bài 122:Trộn 3 mol SO2 với 2 mol O2, cho hỗn hợp vào bình xin có chứa sẵn chất xúc tác, bật tia lửa điện để phản ứng xảy ra. Sau phản ứng, đưa bình về điều kiện ban đầu thì thấy áp suất trong bình giảm đi 10%, Vậy hiệu suất của phản ứng trên là:
A. 90%
B. 60,67%
C. 33,33%
D. 50,2%
Lời giải:
Hướng dẫn giải:
Đáp án C.
Gọi x là số mol oxi đã phản ứng, ta có:
Tổng số mol khí trước phản ứng là: 3 + 2 = 5 mol
Tổng số mol khí sau phản ứng là: 5 – x
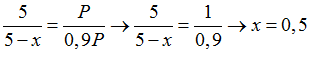
Xét tỉ lệ giữa số mol và hệ số cân bằng của SO2 và O2, SO2 hết, O2 dư
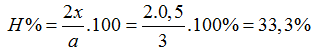
Bài 123:Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thụ hết X vào 2 lít dung dịch chứa Ba(OH)2 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là
A. 23, 2
B. 12, 6
C. 18,0
D. 24,0
Lời giải:
Hướng dẫn giải:
Đáp án C
nBa(OH)2= 0,1.2 = 0,2 (mol),nBaSO3= 0,1 (mol)
nBaSO3= 2nBa(OH)2-nSO2 ⇒ nSO2=0,3 mol
FeS2 → 2SO2
0,15 ← 0,3 (mol)
nFeS2= 0,15.(56 + 32.2)=18 (g)
Bài 124:Cho 5,4 gam Al và 6,4 gam Cu tác dụng với dung dịch H2SO4 đặc, nóng, dư. Sau phản ứng thu được V lít SO2 duy nhất (đktc). Giá trị của V là
A. 6,72 lít.
B. 3,36 lít.
C. 11,2 lít.
D. 8,96 lít.
Lời giải:
Hướng dẫn giải:
Đáp án D.
nAl = 0,2 (mol), nCu = 0,1 (mol)
Áp dụng định luật bảo toàn electron có
2nSO2 = 3nAl + 2nCu ⇒ nSO2 = 0,4 (mol)
→ V = 0,4 . 22,4 = 8,96 lít
Bài 125:Đốt cháy hoàn toàn 80 gam pirit sắt trong không khí thu được chất rắn A và khí B. Lượng chất rắn A tác dụng vừa đủ với 200g H2SO4 29,4%. Độ nguyên chất của quặng là:
A. 60%
B. 70%
C. 80%
D. 95%
Lời giải:
Hướng dẫn giải:
Đáp án A.
Phương trình phản ứng
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
0,4 0,2 0,8 mol
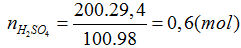
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
0,2 0,6 mol
m = 0,4 × 120 = 48g;