Phương pháp giải Các dạng bài tập chương Nhóm Oxi, Lưu huỳnh - Hoá học lớp 10
Phương pháp giải Các dạng bài tập chương Nhóm Oxi, Lưu huỳnh
Với Phương pháp giải Các dạng bài tập chương Nhóm Oxi, Lưu huỳnh Hoá học lớp 10 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nhóm Oxi, Lưu huỳnh từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

- 11 dạng bài tập Oxi, Lưu huỳnh trong đề thi Đại học có lời giải
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế Oxi, Lưu huỳnh
- Dạng 2: Nhận biết oxi, ozon, lưu huỳnh, SO2, SO3, H2S
- Dạng 3: Hoàn thành phản ứng hóa học Oxi, Lưu huỳnh
- Dạng 4: Các dạng bài tập về Oxi – Ozon
- Dạng 5: SO2, H2S, SO3 phản ứng với dung dịch kiềm
- Dạng 6: Các dạng bài tập về H2S và muối sunfua
- Dạng 7: Các dạng bài tập về Axit Sunfuric H2SO4
- Dạng 8: Hiệu suất phản ứng tổng hợp SO3, O3
- Tổng hợp: Bài tập về hợp chất của lưu huỳnh
- Tổng hợp: Bài tập về SO2, H2S, SO3 hoặc H2SO4 phản ứng với dung dịch kiềm
- Bài tập về Oxi cực hay, có lời giải chi tiết
- Bài tập về Ozon và Hidropeoxit cực hay, có lời giải chi tiết
- Bài tập về Axit Sunfuric (H2SO4) và muối Sunfat cực hay, có lời giải chi tiết
- Bài tập về Lưu huỳnh (S) cực hay, có lời giải chi tiết
- Bài tập về Hidro Sunfua (H2S) cực hay, có lời giải chi tiết
- Bài tập về Lưu huỳnh Đioxit (SO2) cực hay, có lời giải chi tiết
Bài tập trắc nghiệm
- 40 bài tập trắc nghiệm chương Oxi, Lưu huỳnh có đáp án
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải chi tiết (cơ bản)
- 125 câu trắc nghiệm Nhóm Oxi, Lưu huỳnh có lời giải chi tiết (nâng cao)
Bài tập về tính chất hóa học và phương pháp điều chế Oxi, Lưu huỳnh
Bài 1. Trong số những cấu hình electron dưới đây, cấu hình electron ở trạng thái cơ bản của lưu huỳnh là:
A. 1s2 2s2 2p6 3s2 3p3 3d1
B. 1s2 2s2 2p6 3s1 3p3 3d2
C. 1s2 2s2 2p6 3s2 3p4
D. 1s2 2s2 2p6 3s1 3p3 3d2
Hướng dẫn:
⇒ Chọn C
Bài 2. Có thể điều chế O2bằng cách phân huỷ KMnO4, KClO3, H2O2. Nếu lấy cùng một lượng các chất trên đem phân huỷ hoàn toàn thì thể tích oxi trong cùng điều kiện thu được
A. Từ KMnO4 là lớn nhất
B. Từ KClO3 là lớn nhất
C. Từ H2O2 là lớn nhất
D. bằng nhau
Hướng dẫn:
PTHH: 2KMnO4
2H2O2 
KClO3 
⇒ Chọn B
Bài 3. Khoanh tròn vào 1 chữ A hoặc B, C, D trước câu trả lời đúng.
Dẫn khí H2S đi qua dung dịch hỗn hợp KMnO4 và H2SO4 nhận thấy dung dịch:
A. Không có sự biến đổi gì
B. Thành dung dịch trong suốt, không màu
C. Dung dịch màu tím vẩn đục
D. Màu tím của dung dịch chuyển sang không màu và có kết tủa màu vàng
Hướng dẫn:
⇒ Chọn D
Bài 4. Khí oxi có lẫn hơi nước. Chất tốt nhất dùng để tách hơi nước khỏi oxi là:
A.Vôi sống (CaO)
B. Đồng (II) sunfat khan (CuSO4)
C. Axit sunfuric đặc (H2SO4)
D. Dung dịch natri hiđroxit (NaOH)
Hướng dẫn:
⇒ Chọn C
Bài 5. Cấu hình electron nào không đúng với cấu hình electron của anion X2-của các nguyên tố nhóm VIA?
A. 1s22s22p4. B. 1s22s22p6. C. [Ne] 3s23p6. D. [Ar] 4s24p6.
Hướng dẫn:
Cấu hình e của X là […]..s2…p4
⇒Anion X2- nhận thêm 2e có cấu hình là […]...s2…p6
⇒ Chọn A
Bài 6. O2 bị lẫn một ít tạp chất Cl2. Chất tốt nhất để loại bỏ Cl2 là
A. H2O. B. KOH. C. SO2. D. KI.
Hướng dẫn:
⇒ Chọn C
Bài 7. Ở trạng thái kích thích cao nhất, nguyên tử lưu huỳnh có thể có tối đa bao nhiêu electron độc thân?
A. 2. B. 3. C. 4. D. 6.
Hướng dẫn:
⇒ Chọn D
Bài 8: Phát biểu nào không đúng khi nói về khả năng phản ứng của lưu huỳnh?
A. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hóa.
B. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa
C. Hg phản ứng với S ngay ở nhiệt độ thường.
D. S vừa có tính khử vừa có tính oxi hóa.
Hướng dẫn:
⇒ Chọn B ( Khi tác dụng với phi kim, S thể hiện tính khử).
Bài 9: Cho các chất khí sau đây: Cl2, SO2, CO2, SO3. Chất làm mất màu dung dịch brom là:
A. CO2 B. SO3 C. SO2 D. Cl2
Hướng dẫn:
⇒ Chọn C
Bài 10: Để phân biệt khí oxi và ozon, có thể dùng hóa chất là:
A. Hồ tinh bột. B. Đồng kim loại
C. Khí hiđro D. Dung dịch KI và hồ tinh bột
Hướng dẫn:
⇒ Chọn D
Bài 11: Trong hợp chất nào nguyên tố lưu huỳnh không thể thể hiện tính oxi hóa?
A. SO2 B. H2SO4 C. KHS D. Na2SO3
Hướng dẫn:
⇒ Chọn C (S2- là số oxh thấp nhất của S nên chỉ thể hiện tính khử)
Bài 12: Lưu huỳnh đioxit có thể tham gia các phản ứng sau:
SO2 + Br2+ 2H2O → 2HBr + H2SO4 (1)
2H2S + SO2 → 3S + 2H2O (2).
Câu nào sau đây diễn tả không đúng tính chất của các chất trong những phản ứng trên?
A. phản ứng (2): SO2 vừa là chất khử, vừa là chất oxi hóa.
B. phản ứng (2): SO2 là chất oxi hóa, H2S là chất khử.
C. phản ứng (1): SO2 là chất khử, Br2 là chất oxi hóa.
D. phản ứng (1): Br2là chất oxi hóa, phản ứng (2): H2S là chất khử
Hướng dẫn:
⇒ Chọn A
Bài 13: X, Y là 2 nguyên tố liên tiếp nhau trong nhóm A. Cấu hình electron ngoài cùng của X là 2p4. Vậy vị trí của X và Y trong bảng hệ thống tuần hoàn là
A. X thuộc chu kì 3, nhóm VA; Y thuộc chu kì 3, nhóm VIA
B. X thuộc chu kì 2, nhóm VA; Y thuộc chu kì 3, nhóm VIA
C. X thuộc chu kì 2, nhóm VIA; Y thuộc chu kì 3, nhóm VIA.
D. X thuộc chu kì 2, nhóm IVA; Y thuộc chu kì 3, nhóm IVA
Hướng dẫn:
⇒ Chọn C
Bài 14: Câu nào sau đây không diễn tả đúng tính chất của các chất?
A. H2O và H2O2 cùng có tính oxi hóa, nhưng H2O có tính oxi hóa yếu hơn.
B. H2SO3 và H2SO4 cùng có tính oxi hóa, nhưng H2SO4 có tính oxi hóa mạnh hơn
C. O2 và O3 cùng có tính oxi hóa, nhưng O3 có tính oxi hóa mạnh hơn.
D. H2S và H2SO4 cùng có tính oxi hóa, nhưng H2SO4 có tính oxi hóa yếu hơn
Hướng dẫn:
⇒ Chọn D ( H2S chỉ thể hiện tính khử)
Bài 15: Trong các câu sau đây câu nào không đúng:
A. dung dịch H2SO4 loãng là một axit mạnh.
B. Đơn chất lưu huỳnh chỉ thể hiện tính khử trong các phản ứng hoá học.
C. SO2 vừa thể hiện tính oxi hoá, vừa thể hiện tính khử.
D. Ion S2- chỉ thể hiện tính khử, không thể hiện tính oxi hoá
Hướng dẫn:
⇒ Chọn B
Bài 16: Trong phản ứng: 3S + 6KOH → 2K2S + K2SO3 + 3H2O. Lưu huỳnh đóng vai trò là
A. Chất khử
B. Không là chất oxi hóa cũng không là chất khử
C. Là chất oxi hóa nhưng đồng thời cũng là chất khử
D. Chất oxi hóa
Hướng dẫn:
⇒ Chọn C
Bài 17: Các hợp chất của dãy nào vừa thể hiện tính oxi hóa vừa thể hiện tính khử:
A. H2SO4, H2S, HCl
B. H2S, KMnO4, HI
C. Cl2O7, SO3, CO2
D. H2O2, SO2, FeSO4
Hướng dẫn:
⇒ Chọn D ( H2S, HI chỉ thể hiện tính khử ; Cl2O7, SO3chỉ thể hiện tính oxi hóa).
Bài 18: Trong những chất sau, câu nào sai khi nói về tính chất hóa học của ozon?
A. Ozon oxi hóa tất cả các kim loại kể cả Au và Pt
B. Ozon oxi hóa Ag thành Ag2O
C. Ozon kém bền hơn oxi
D. Ozon oxi hóa ion I-thành I2
Hướng dẫn:
⇒ Chọn A
Bài 19: Trong các câu sau, câu nào sai:
A. Oxi tan nhiều trong nước.
B. Oxi nặng hơn không khí
C. Oxi chiếm 1/5 thể tích không khí
D. Oxi là chất khi không màu, không mùi, không vị
Hướng dẫn:
⇒ Chọn A( Khí oxi ít tan trong nước)
Nhận biết oxi, ozon, lưu huỳnh, SO2, SO3, H2S
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Các bước làm một bài nhận biết:
- Trích mẫu thử.
- Dùng thuốc thử.
- Nêu hiện tượng.
- Viết phương trình phản ứng.
Lưu ý: Nếu hai mẫu thử có cùng tính chất, khi cho thuốc thử vào nhận biết thì hiện tượng sẽ trùng nhau, lúc đó ta tách chúng thành một nhóm, những mẫu thử khác không giống hiện tượng tách thành nhóm khác và tiếp tục sử dụng bảng nhận biết theo thứ tự sau
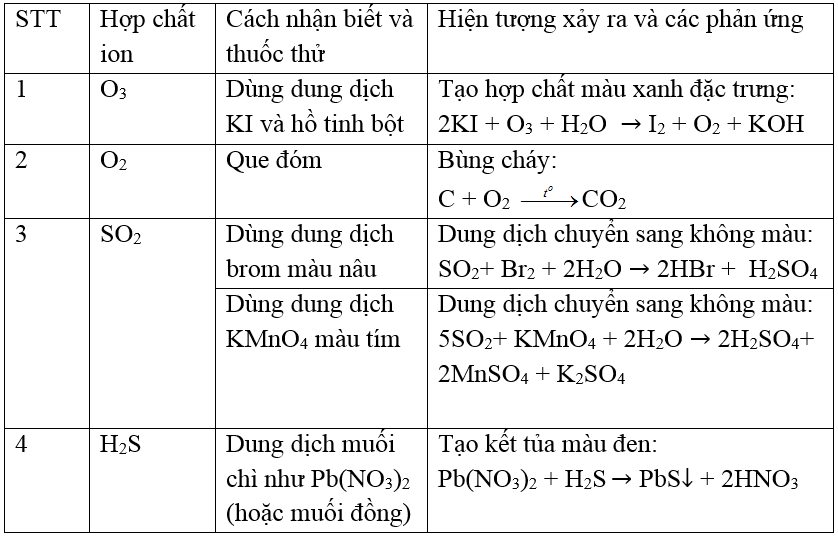
Bảng : Nhận biết O2, O3, S và các hợp chất
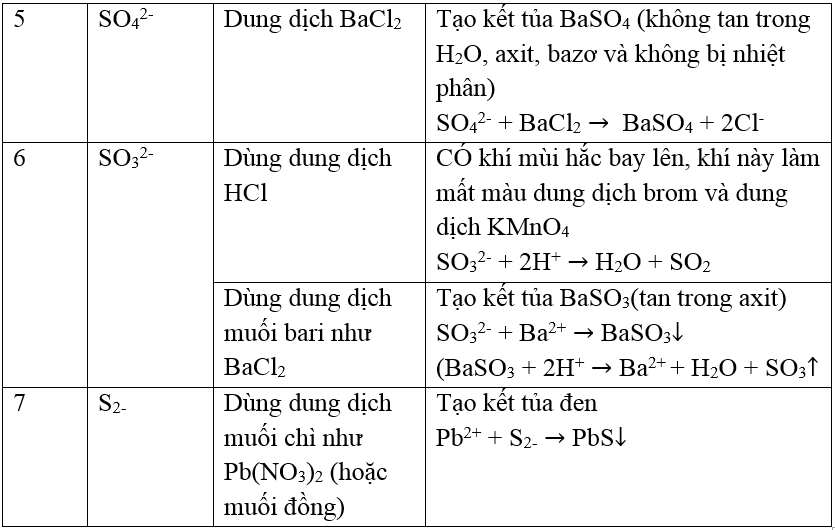
Ví dụ minh họa
Ví dụ 1: Có hai bình riêng biệt hai khí oxi và ozon. Trình bày phương pháp hóa học để phân biệt hai khí đó.
Hướng dẫn:
Dẫn lần lượt hai khí vào 2 dung dịch KI (chứa sẵn một ít tinh bột) nếu dung dịch có màu xanh xuất hiện thì khí dẫn là ozon.
2KI + O3 + H2O → I2 + O2 + KOH
I2 + hồ tinh bột → xanh
Khí còn lại không làm đổi màu là oxi.
Ví dụ 2: Có 4 lọ, mỗi lọ đựng một dung dịch không màu: NaCl, HCl, Na2SO4, Ba(NO3)2. Hãy nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học xảy ra (nếu có).
Hướng dẫn:
Trích mỗi dung dịch một ít làm mẫu thử, cho quỳ tím lần lượt vào các mẫu thử, mẫu thử nào quỳ tím hóa đỏ là HCl.
Cho vài giọt dung dịch BaCl2 vào 3 mẫu thử cón lại, mẫu thử nào tạo kết tủa trắng là ống nghiệm đựng Na2SO4.
Na2SO4+ BaCl2 → NaCl + BaSO4↓
Cho vài giọt dung dịch Na2SO4 (đã biết) vào 2 mẫu thử còn lại, mẫu nào có kết tủa trắng là dung dịch Ba(NO3)2
Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4↓
Còn lại dung dịch NACl, có thể khẳng định bằng dung dịch AgNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
Ví dụ 3: Trình bày phương pháp hóa học nhận biết các dung dịch sau:Na2S, K2CO3, BaCl2, Na2SO3, NaCl.
Hướng dẫn:
Trích mỗi dung dịch một ít làm mẫu thử
Cho dung dịch H2SO4 lần lượt vào các mẫu thử trên
- Mẫu thử tạo kết tủa trắng là BaCl2
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
- Mẫu thử không có hiện tượng gì là NaCl
- Mẫu thử tạo khí có mùi trứng ung (trứng thối) là Na2S
Na2S + H2SO4 → Na2SO4 + H2S↑
- Mẫu thử tạo khí mùi hắc là Na2SO3.
Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑+ H2O
- Mẫu thử tạo khí không màu, không mùi là K2CO3
K2CO3 + H2SO4 → K2SO4 + CO2↑+ H2O
Ví dụ 4: Cho các dung dịch không màu của các chất sau: NaCl, K2CO3. Na2SO4, HCl, Ba(NO3)2. Hãy phân biệt các dung dịch đã cho bằng phương pháp hóa học mà không dùng thêm hóa chất nòa khác làm thuốc thử. Viết phương trình hóa học nếu có.
Hướng dẫn:
Lấy mỗi dung dịch một ít rồi chia ra 5 ống nghiệm có đánh số. Cho lầ lượt từng dung dịch vào các dung dịch còn lại, hiện tượng thí nghiệm được ghi trong bảng sau:
| NaCl | K2CO3 | Na2SO4 | HCl | Ba(NO32 | Kết luận | |
| NaCl | ||||||
| K2CO3 | ↑ | ↓ | ↑,↓ | |||
| Na2SO4 | ↓ | ↓ | ||||
| HCl | ↑ | ↑ | ||||
| Ba(NO3)2 | ↓ | ↓ | 2↓ |
B. Bài tập trắc nghiệm
Câu 1. Có bốn lọ mất nhãn đựng bốn dung dịch K2SO3, K2SO4, (NH4)2SO3, (NH4)2SO4. Bằng phương pháp hóa học, hãy nhận biết các dung dịch này.
Lời giải:
Đáp án:
- Trích mỗi dung dịch một ít làm mẫu thử cho mỗi thí nghiệm.
- Lần lượt nhỏ dung dịch HCl vào các mẫu thử. Hai mẫu thử có khí bay ra K2SO3, (NH4)2SO4 (nhóm 1) theo phản ứng:
K2SO4 + 2HCl → 2KCl + H2O + SO2↑
(NH4)2SO3 + 2HCl → 2NH4Cl + SO2↑ +H2O
Hai mẫu thử còn lại không hiện tượng gì (nhóm 2).
- Nhỏ tiếp dung dịch NaOH lần lượt vào hai nhóm mẫu thử, mẫu thử có khí bay ra (NH4)2SO3 (đối với nhóm 1) và (NH4)2SO4 (đối với nhóm 2) theo phản ứng:
(NH4)2SO3 + 2NaOH → Na2SO3 + 2NH3↑ + 2H2O
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + 2H2O
Từ đó suy ra chất còn lại ở mỗi nhóm.
Câu 2. Có bốn dung dịch A, B, C, D chứa các chất NaOH, HCl, H2SO4, H2O (không theo thứ tự trên). Lần lượt cho quỳ tím và dung dịch BaCl2 vào bốn dung dịch này và thấy:
A: làm quỳ tím hóa đỏ và tạo kết tủa trắng.
B: làm quỳ tím hỏa xanh và không tạo kết tủa.
C: không đổi màu quỳ tím và không tạo kết tủa.
D: làm quỳ tím hóa đỏ và không tạo kết tủa.
Tìm A, B, C, D. Giải thích, viết phản ứng.
Lời giải:
Đáp án:
- A làm quỳ tím hóa đỏ và tạo kết tủa trắng là H2SO4
H2SO4 + BaCl2 → BaSO4 + 2HCl
- B làm quỳ tím hóa xanh và không tạo kết tủa là NaOH.
- C không đổi màu quỳ tím và không tạo kết tủa là H2O.
- D làm quỳ tím hóa đỏ và không tạo kết tủa là HCl.
Câu 3. Bằng phương pháp hóa học hãy nhận biết các khí: CO2, SO2, SO3.
Lời giải:
Đáp án:
- Cho qua dung dịch Br2 nhận biết SO2 do làm nhạt màu nâu của dung dịch brom:
Br2 + SO2 + 2H2O → 2HBr + H2SO4
- Cho qua dung dịch BaCl2 nhận biết SO3 do tạo kết tủa màu trắng:
BaCl2 + SO3 + H2O → BaSO4↓ + 2HCl
- Còn lại là CO2.
Câu 4. Làm thế nào để tinh chế khí H2 trong hỗn hợp khí CO2 + H2.
Lời giải:
Đáp án:
Cho hỗn hợp vào dung dịch Ca(OH)2 thì CO2 bị giữ lại do phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
Như vậy thu được H2.
Câu 5. Trình bày phương pháp hóa học nhận biết các dung dịch sau: Na2S, K2CO3, BaCl2, Na2SO3, NaCl.
Lời giải:
Đáp án:
Trích mỗi dung dịch một ít làm mẫu thử
Cho dung dịch H2SO4 lần lượt vào các mẫu thử trên
- Mẫu thử tạo kết tủa trắng là BaCl2
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
- Mẫu thử không có hiện tượng gì là NaCl
- Mẫu thử tạo khí có mùi trứng ung (trứng thối) là Na2S
Na2S + H2SO4 → Na2SO4 + H2S↑
- Mẫu thử tạo khí mùi hắc là Na2SO3.
Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑+ H2O
- Mẫu thử tạo khí không màu, không mùi là K2CO3
K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
Chú ý: Nếu không nhận biết được bằng mùi khí H2S và SO2 thì có thể phân biệt ba khí bằng cách sau:
- Dẫn 3 khí lần lượt qua dung dịch CuSO4 , khí tạo kết tảu màu đen là H2S.
H2S + CuSO4 → CuS↓(đen) + H2SO4
- Dẫn hai khí còn lại qua dung dịch nước brom, khí nào làm mất màu nước brom là SO2:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
- Khí còn lại là CO2
Câu 6. Cho các dung dịch không màu của các chất sau: NaCl, K2CO3. Na2SO4, HCl, Ba(NO3)2. Hãy phân biệt các dung dịch đã cho bằng phương pháp hóa học mà không dùng thêm hóa chất nòa khác làm thuốc thử. Viết phương trình hóa học nếu có.
Lời giải:
Đáp án:
Lấy mỗi dung dịch một ít rồi chia ra 5 ống nghiệm có đánh số. Cho lầ lượt từng dung dịch vào các dung dịch còn lại, hiện tượng thí nghiệm được ghi trong bảng sau:
| NaCl | K2CO3 | Na2SO4 | HCl | Ba(NO3)2 | Kết luận | |
| NaCl | ||||||
| K2CO3 | ↑ | ↓ | ↑,↓ | |||
| Na2SO4 | ↓ | ↓ | ||||
| HCl | ↑ | ↑ | ||||
| Ba(NO3)2 | ↓ | ↓ | 2↓ |
Nhận xét:
Ở dung dịch nào không có hiện tượng gì thì đó là dung dịch NaCl
- Dung dịch nào có 1 trường hợp thoát khí và 1 trường hợp kết tủa là K2CO3:
K2CO3 + 2HCl → 2KCl + H2O + CO2↑ (1)
K2CO3 + Ba(NO3)2 → KNO3 + BaCO3↓ (2)
- Dung dịch có 1 tường hợp kết tủa là dung dịch Na2SO4
Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4↓ (3)
- Dung dịch nào có 1 trường hợp thoát khí là dung dịch HCl (phương trình (1)).
- Dung dịch nào có 2 trường hợp kết tủa là dung dịch Ba(NO3)2 (phương trình (2) và (3)).
Hoàn thành phản ứng hóa học Oxi, Lưu huỳnh
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Cần nắm chắc các tính chất hóa học về oxi, ozon, lưu huỳnh, các hợp chất của chúng để thấy được mối quan hệ giữa các chất
- Với những bài ẩn tên chất yêu cầu tìm chất phù hợp và viết phương trình cần lựa chọn các chât tương ứng với các trạng thái oxi hóa của lưu huỳnh trong sơ đồ. Quá trình làm tăng trạng thái oxi hóa các nguyên tố lưu huỳnh cầ lựa chọn cho tác dụng với chất có tính oxi hóa. Ngược lại quá trình làm giảm trạng thái oxi hóa của nguyên tố lưu huỳnh cần lựa chọn cho tác dụng với chất có tính khử.
Ví dụ minh họa
Ví dụ 1: Hãy viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của các nguyên tố lưu huỳnh theo sơ đồ sau:
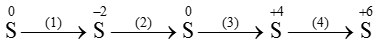
Hướng dẫn:
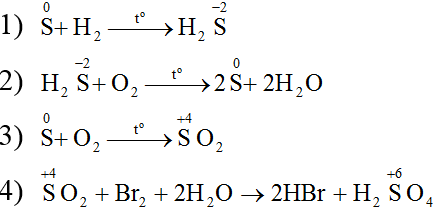
Ví dụ 2: Viết các phương trình phản ứng theo chuỗi biến hóa sau:
KClO3 → O2 → O3 → O2 → ZnO → ZnSO4
FeS → H2S → S → SO2 → CaSO3 → CaSO4
Hướng dẫn:
a) 2KClO3
3O2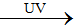
O3 + 2Ag → Ag2O + O2
O2 + 2Zn → 2ZnO
ZnO + H2SO4 → ZnSO4 + H2O
b) FeS + 2HCl → FeCl2 + H2S↑
2H2S + O2 thiếu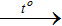
S + O2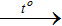
SO2 + CaO → CaSO3
CaSO3 + H2SO4 → CaSO4 + H2SO4 + SO2
Ví dụ 3: Hoàn thành sơ đồ biến hóa sau:
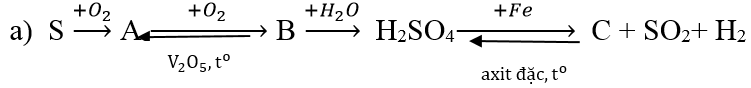
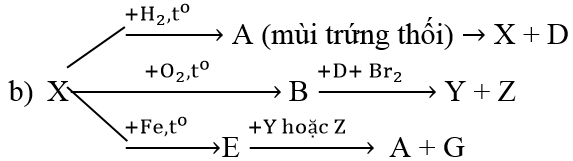
Hướng dẫn:
S + O2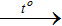
2SO2 + O2 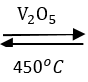
SO3 + H2O → H2SO4
6H2SO4 đặc + 2Fe 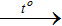
S + H2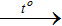
S + O2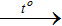
S + Fe 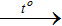
2H2S + SO2 → 3S + 2H2O
(X)⇒ S, (D) ⇒ H2O
SO2 + Br2 + 2H2O → 2HBr + H2SO4
(Y) ⇒ HBr, (Z) ⇒ H2SO4
FeS + 2HBr → FeBr2 + H2S↑
(G) ⇒ FeBr2 (A) ⇒ H2S
Hoặc FeS + H2SO4 → FeSO4+ H2S↑
(G)⇒ FeSO4 (A) ⇒ H2S
Ví dụ 4: Hoàn thành chuỗi các phản ứng sau, ghi rõ điều kiện nếu có:
ZnS → H2S → S → SO2 → SO3 → H2SO4 → HCl → Cl2 → KClO3 → O2
ZnS + 2HCl → ZnCl2 + H2S
2H2S + O2 thiếu → 2S + 2H2O
S + O2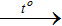
2SO2 + O2 
SO3+ H2O → H2SO4
H2SO4 đặc + NaCl tinh thể → NaHSO4 + HCl
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
3Cl2 + 6KHO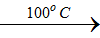
2KClO3 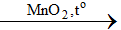
Ví dụ 5. Viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của nguyên tố lưu huỳnh theo sơ đồ sau:
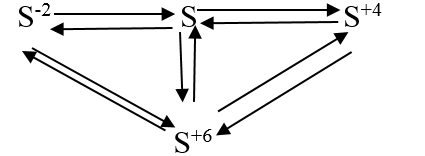
Hướng dẫn:
+) S-2 → S0: 2H2S + O2 thiếu → 2S + 2H2O
+) S0 → S-2: H2 + S 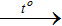
+) S0 → S+4: S + O2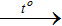
+) S+4 → S0: 2H2S + SO2 → 3S + 2H2O
+) S+4 → S+6: SO2+ Br2 + 2H2O → 2HBr + H2SO4
+) S+6 → S+4: Cu + 2H2SO4 đặc 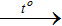
+) S0 → S+6: S + 3F2 → SF6
+) S+6 → S0: 3Zn + 4H2SO4 đặc 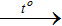
+) S-2 → S+6: H2S+ 4Cl2 + 4H2O → H2SO4 + 8HCl
+) S+6 → S2-: 4Mg + 5H2SO4 đặc 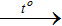
Nhận xét: với dạng bài này cần lựa chọn các chât tương ứng cho phù hợp với các trạng thái oxi hóa của lưu huỳnh trong sơ đồ. Quá trình làm tăng trạng thái oxi hóa các nguyên tố lưu huỳnh cầ lựa chọn cho tác dụng với chất có tính oxi hóa. Ngược lại quá trình làm giảm trạng thái oxi hóa của nguyên tố lưu huỳnh cần lựa chọn cho tác dụng với chất có tính khử.
B. Bài tập trắc nghiệm
Câu 1. Viết phương trình phản ứng theo chuỗi biến hóa sau:
FeS → H2S → S → SO2 → CaSO3 → CaSO4
Lời giải:
Đáp án:
FeS + 2HCl → FeCl2 + H2S
2H2S + O2thiếu ---V2O5→ 2S + 2H2O
SO2 + CaO → CaSO3
CaSO3 + H2SO4 → CaSO4 + SO2 + H2O
Câu 2. Xác định các chất và hoàn thành các phương trình phản ứng sau:
FeS + A → B (khí) + C
B + CuSO4 → D↓ đen + E
B + F → G↓ vàng + H
C + J khí → L
L + KI → C + M + N
Lời giải:
Đáp án:
FeS + 2HCl → FeCl2 + H2S↑
(A) (C) (B)
H2S + CuSO4 → CuS↓ + H2SO4
(D) (E)
2H2S + SO2 → 2S↓ + 2H2O
(F) (G) (H)
2FeCl2 + Cl2 → 2FeCl3
(J) (L)
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
(M) (N)
Câu 3. Hoàn thành sơ đồ biến hóa sau:
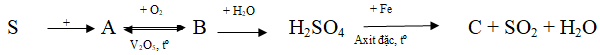
Lời giải:
Đáp án:
S + O2 → SO2 (A)
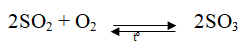
SO3 + H2O → H2SO4
6H2SO4(đ) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
Câu 4. Viết phương trình phản ứng theo chuỗi biến hóa sau:
KMnO4 → Cl2 → NaClO3 → O2 → SO2 → SO3 → H2SO4
Lời giải:
Đáp án:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
2NaClO3 → 2NaCl + 3O2
O2 + S → SO2
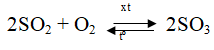
SO3 + H2O → H2SO4
Câu 5. Cặp phản ứng nào sau đây cho thấy lưu huỳnh vừa có tính khử vừa có tính oxi hóa?
A. S + H2 → H2S; S + Cu → CuS
B. S + 2H2SO4 → 3SO2 + 2H2O; S + 2Na → Na2S
C. S + 6HNO3 → H2SO4 + 6NO2 + 3H2O; S + O2 → SO2
D. S+ 3F2 → SF6 ; S + O2 → SO2
Lời giải:
Đáp án: B
Câu 6. Lưu huỳnh tác dụng với natri hidroxit đặc, nóng:
S + NaOH → Na2S + Na2SO3 + H2O
Trong phản ứng trên, tỷ lệ số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là:
A. 1 : 2 B. 1 : 1 C. 1 : 2 D. 2 : 1
Lời giải:
Đáp án: D
Câu 6.
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
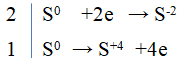
Câu 7. Cho phương trình phản ứng hóa học:
H2SO4 đặc + 8HI → 4I2 + H2S + 4H2O
A. H2SO4 là chất oxi hóa, HI là chất khử
B. HI là chất oxi hóa
C. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI
D. I2 khử H2S thành H2SO4 và nó bị khử thành HI.
Lời giải:
Đáp án: A
Câu 8. Cho các phương trình phản ứng hóa học sau:
1. SO2 + 2H2S → 3S + 2H2O
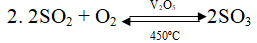
3. SO2 + Br2 + 2H2O → 2HBr + H2SO4
4. 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
5. SO2 + H2O → H2SO3
SO2 là chất oxi hóa trong các phản ứng:
A. 1, 3, 5 B. 1, 3, 4 C. 1 D. 1, 3
Lời giải:
Đáp án: C

