75 câu trắc nghiệm Liên kết hóa học có lời giải chi tiết (nâng cao) - Hoá học lớp 10
75 câu trắc nghiệm Liên kết hóa học có lời giải chi tiết (nâng cao)
Với 75 câu trắc nghiệm Liên kết hóa học có lời giải chi tiết (nâng cao) Hoá học lớp 10 tổng hợp 75 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Liên kết hóa học từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Bài 1: Chất nào có góc liên kết 120o trong phân tử?
A. H2S
B. BH3
C. CH4
D. H2O
Lời giải:
Chọn đáp án: B.
Giải thích: Phân tử B ở trạng thái lai hóa sp2, nên góc liên kết = 120o
Bài 2: Chất nào không có sự lai hóa sp trong ptử?
A. HClO
B. C2H2
C. BeBr2
D. BH3
Lời giải:
Chọn đáp án: D.
Giải thích: Phân tử BH3 phân tử B ở trạng thái lai hóa sp2.
Bài 3: Nguyên tử Be trong BeCl2 ở trạng thái lai hoá
A. sp
B. sp2
C. sp3
D. không xác định được
Lời giải:
Chọn đáp án: A.
Bài 4: Chọn câu sai :
A. Điện hóa trị có trong hợp chất ion.
B. Điện hóa trị bằng số cặp electron dùng chung.
C. Cộng hóa trị có trong hợp chất cộng hóa trị.
D. Cộng hóa trị bằng số cặp electron dùng chung.
Lời giải:
Chọn đáp án: B
Giải thích: Điện hóa trị bằng điện tích của ion đó trong hợp chất
Bài 5: Cho các phân tử: (1) MgO; (2) Al2O3; (3) SiO2; (4) P2O5. Độ phân cực của chúng được sắp xếp theo chiều tăng dần từ trái qua phải là:
A. (3), (2), (4), (1)
B. (1), (2), (3), (4)
C. (4), (3), (2), (1)
D. (2), (3), (1), (4)
Lời giải:
Chọn đáp án: C
Giải thích:
Mg, Al, Si. P cùng nằm trong một chu kì, độ âm điện tăng dần Mg < Al < Si < P
∆X = XO- Xnguyên tố, độ âm điện của nguyên tố càng nhỏ nguyên tố càng phân cực.
Bài 6: Hoàn thành nội dung sau : “Bán kính nguyên tử...(1) bán kính cation tương ứng và ... (2) bán kính anion tương ứng”.
A. (1) : nhỏ hơn, (2) : lớn hơn.
B. (1): lớn hơn, (2) : nhỏ hơn.
C. (1): lớn hơn, (2) : bằng.
D. (1) : nhỏ hơn, (2) : bằng.
Lời giải:
Chọn đáp án: B.
Giải thích: Cation có số electron nhỏ hơn so với nguyên tử, lực hút giữa hạt nhân và các electron mạnh hơn, làm bán kính giảm. Anion có số electron lớn hơn số electron của nguyên tử, lực hút của hạt nhân với các electron yếu hơn, làm tăng bán kính.
Bài 7: Trong phân tử nào sau đây chỉ tồn tại liên kết đơn : N2, O2, F2, CO2 ?
A. N2
B. O2
C. F2
D. CO2
Lời giải:
Chọn đáp án: C.
Giải thích: Công thức cấu tạo của các chất: N≡N, O=O, O=C=O, F-F

Bài 8: Cho các phân tử : H2, CO2, Cl2, N2, I2, C2H4, C2H2. Bao nhiêu phân tử có liên kết ba trong phân tử ?
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: B.
Giải thích: Các chất có liên kết ba là: N2 (N≡N), C2H2 (CH≡CH)
Bài 9: Phân tử H2O có góc liên kết bằng 104,5o do nguyên tử Oxi ở trạng thái lai hoá:
A. sp
B. sp2
C. sp3
D. không xác định
Lời giải:
Chọn đáp án: C.
Giải thích: Trong lai hóa sp3, góc liên kết bằng 109o28’, nguyên tử Oxi còn hai cặp e chưa tham gia liên kết nên làm giảm góc liên kết.
Bài 10: Hình dạng phân tử CH4 , BF3 , H2O , BeH2 tương ứng là :
A. Tứ diện, tam giác, gấp khúc, thẳng
B. Tam giác, tứ diện, gấp khúc, thẳng
C. Gấp khúc, tam giác, tứ diện, thẳng
D. Thẳng, tam giác, tứ diện, gấp khúc
Lời giải:
Chọn đáp án: A.
Giải thích: Do trạng thái lai hóa của các nguyên tử trung tâm trong phân tử CH4 , BF3 , H2O , BeH2 lần lượt là sp3, sp2, sp3, sp.
Bài 11: Kết luận nào sau đây sai ?
A. Liên kết trong phân tử NH3, H2O, H2S là liên kết cộng hóa trị có cực.
B. Liên kết trong phân tử BaF2 và CsCl là liên kết ion.
C. Liên kết trong phân tử CaS và AlCl3 là liên kết ion vì được hình thành giữa kim loại và phi kim.
D. Liên kết trong phân tử Cl2, H2, O2, N2 là liên kết cộng hóa trị không cực.
Lời giải:
Chọn đáp án: C.
Giải thích: Dựa vào độ âm điện, phân tử AlCl3 có liên kết cộng hóa trị phân cực
Bài 12: Nguyên tử Al có bán kính 1,43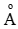
A. 1,96 B. 2,7
C. 3,64 D. 1,99
Lời giải:
Chọn đáp án: B.
Giải thích:
Al có cấu trúc lập phương tâm diện nên phần trăm thể tích chiếm (độ đặc khít) là 74%.
V1 mol nguyên tử Al = (M/d)74% = (27/d)74%.
V1 nguyên tử Al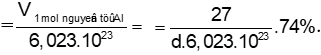
Mặt khác :
V1 nguyên tử Al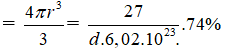
⇒ D = 2,7 gam/cm3
Bài 13: Chọn câu phát biểu đúng:
A. Liên kết giữa kim loại và phi kim luôn là liên kết ion
B. Liên kết đơn và liên kết đôi gọi chung là liên kết bội
C. Liên kết H-I được hình thành bằng sự xen phủ s-s
D. Liên kết trong phân tử oxi có cả liên kết δ và liên kết π
Lời giải:
Chọn đáp án: D.
Giải thích:
A. Liên kết giữa kim loại và phi kim luôn là liên kết ion (Sai, VD: AlCl3 là liên kết công hóa trị.
B. Liên kết đơn và liên kết đôi gọi chung là liên kết bội (Sai), liên kết đôi và liên kết ba được gọi chung là liên kết bội.
C. Liên kết H-I được hình thành bằng sự xen phủ s-s (sự xen phủ s – p)
Bài 14: Dãy nào sau đây gồm các chất đều có liên kết π trong phân tử?
A. C2H4, O2, N2, H2S
B. CH4, H2O, C2H4, C3H6
C. C2H4, C2H2, O2, N2
D. C3H8, CO2, SO2, O2
Lời giải:
Chọn đáp án: C
Giải thích:
Liên kết π có trong liên kết đôi và liên kết ba.
CTCT của các chất: C2H4(CH2=CH2), C2H2(CH≡CH), O2 (O=O), N2 (N≡N), SO2 (O=S → O)
Bài 15: Các liên kết trong phân tử Nitơ được tạo thành là do sự xen phủ của :
A. Các obitan s với nhau và các obitan p với nhau
B. 3 obitan p với nhau
C. 1 obitan s và 2 obitan p với nhau
D. 3 obitan p giống nhau về hình dạng kích thước nhưng khác nhau về định hướng không gian với nhau
Lời giải:
Chọn đáp án: D.
Bài 16: Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết:
• Tổng số proton trong hợp chat M2X bằng 46.
• Trong hạt nhân của M có n – p = 1, trong hạt nhân của X có n’ = p’.
• Trong hợp chất M2X, nguyên tố X chiếm 8/47 khối lượng phân tử.
Số hạt proton trong hạt nhân nguyên tử M, X và liên kết trong hợp chất M2X lần lượt là
A. 19, 8 và liên kết cộng hóa trị
B. 19, 8 và liên kết ion
C. 15, 16 và liên kết ion
D. 15, 16 và liên kết cộng hóa trị
Lời giải:
Chọn đáp án: B.
Giải thích:
Theo đề nM - pM = 1 và nX = pX
Phân tử khối của M2X : 2(pM + nM) + (pX + nX) = 2.2pM + 2pX + 2 = 94
X chiếm 8/47 phần khối lượng ⇒ Nguyên tử khối X=16 và M=39
⇒ Số proton trong X là 8 (oxi), trong M là 19 (kali)
Hợp chất K2O có liên kết ion.
Bài 17: Số liên kết π và liên kết σ trong phân tử C2H4 là
A. 1 và 5
B. 2 và 5
C. 1 và 4
D. 2 và 4
Lời giải:
Chọn đáp án: A
Giải thích: CTCT: CH2=CH2
Bài 18: Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố R thuộc nhóm VIIA là 28. Công thức hợp chất của R với hidro là
A. HF
B. HCl
C. SiH4
D. NH3
Lời giải:
Chọn đáp án: A
Giải thích:
R thuộc nhóm VIIA, hợp chất với hidro có dạng RH, R thuộc nhốm VIIA nên có thể là F, Cl, Br, I.
Tổng số hạt bằng 28: 2p + n = 28, p < 14 ⇒ R là F.
Bài 19: Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hóa học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. kim loại.
B. cộng hóa trị.
C. ion.
D. cho – nhận.
Lời giải:
Chọn đáp án: C
Giải thích: X là kim loại do có 1e lớp ngoài cùng, Y là phi kim do có 7e lớp ngoài cùng.X,Y là kim loại và phi kim điển hình, liên kết tạo thành là liên kết ion.
Bài 20: Cho nguyên tử Liti (Z = 3) và nguyên tử Oxi (Z = 8). Nội dung nào sau đây không đúng:
A. Cấu hình e của ion Li+: 1s2 và cấu hình e của ion O2-: 1s22s22p6.
B. Những điện tích ở ion Li+ và O2- do : Li → Li + + e và O + 2e → O2– .
C. Nguyên tử khí hiếm Ne có cấu hình e giống Li + và O2- .
D. Có công thức Li2O do: mỗi nguyên tử Li nhường 1 e mà một nguyên tử O nhận 2 e.
Lời giải:
Chọn đáp án: C.
Giải thích: Nguyên tử khí hiếm Ne có cấu hình: 1s22s22p6, cấu hình của Li+ là 1s2
Bài 21: Nguyên tử của nguyên tố X có tổng số hạt p, n, e là 18. Liên kết hóa học trong monooxit của X là:
A. liên kết ion.
B. liên kết cộng hóa trị phân cực.
C. liên kết cộng hóa trị không phân cực.
D. liên kết cho nhận.
Lời giải:
Chọn đáp án: B
Giải thích: Ta có 2p + n = 18, vậy p ≤ 18/3 =6, X là Cacbon (p=6). Liên kết trong phân tử CO là liên kết cộng hóa trị phân cực
Bài 22: Biết góc liên kết giữa các nguyên tử HCH trong phân tử CH4 là 109o28', phân tử CH4 có kiểu lai hóa nào dưới đây:
A. sp
B. sp3
C. sp2
D. Không lai hóa
Lời giải:
Chọn đáp án: B.
Bài 23: Liên kết hoá học trong phân tử Cl2 được hình thành :
A. Sự xen phủ trục của 2 orbitan s.
B. Sự xen phủ bên của 2 orbitan p chứa electron độc thân.
C. sự cho - nhận electron giữa 2 nguyên tử clo.
D. Nhờ sự xen phủ trục của 2 orbitan p chứa electron độc thân.
Lời giải:
Chọn đáp án: D.
Giải thích: Nguyên tử Clo chứa e độc thân tại phân lớp p, liên kết được tạo thành do sự xen phủ giữa hai obitan p chứa e độc thân của hai nguyên tử clo.

Bài 24: M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxit cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây?
A. Liên kết ion.
B. Liên kết cộng hoá trị.
C. Liên kết cho nhận
D. Liên kết ion, liên kết cộng hoá trị.
Lời giải:
Chọn đáp án: A.
Giải thích:
Oxit cao nhất của M có dạng MO.
%mM = (MM/MMO)100=
⇒ 71,43 = (MM/(MM+16))100
⇒ MM = 40 (Ca)
Oxit của X có dạng XO3
Tương tự, ta có:
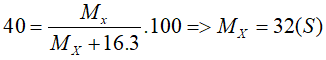
Hợp chất có liên kết ion
Sử dụng dữ kiện, trả lời câu hỏi 25,26
Phân tử XY3 có tổng số hạt proton, nơtron và electron bằng 196, trong đó hạt mang điện nhiều hơn số hạt không mang điện là 60. Tổng số hạt trong Y- nhiều hơn trong X3+ là 16. Công thức của XY3 là:
Bài 25: XY3 là công thức nào sau đây ?
A. SO3.
B. AlCl3.
C. BF3.
D. NH3
Lời giải:
Chọn đáp án: B.
Bài 26: Liên kết giữa X và Y trong phân tử XY3 thuộc loại liên kết nào ?
A. Liên kết cộng hóa trị phân cực.
B. Liên kết cộng hóa trị không phân cực.
C. Liên kết ion.
D. Liên kết cho – nhận.
Lời giải:
Chọn đáp án: A.
Giải thích:
Gọi tổng số hạt proton, nơtron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, nơtron và electron của nguyên tử XY3 là 196
Px + nx + ex + 3.(py + ny + ey)= 196 hay 2px + nx + 6py + 3ny = 196 (1) px = ex và py = ey.
Số hạt mang điện nhiều hơn số hạt không mang điện là 60 nên :
Px + ex + 3py + 3ey – nx - 3ny = 22 2px + 6py - nx - 3ny = 60 (2)
Tổng số hạt trong Y- nhiều hơn trong X3+ là 16
2Py + ny + 1 – (2px + nx – 3) = 16 hay 2py – 2px + ny –nx = 12
Giải ra ta có px = 13 (Al), py = 17 (Cl).
Phân tử AlCl3 có chứa liên kết cộng hóa trị phân cực. (dựa vào độ âm điện).
Bài 27: Khẳng định nào sau đây là đúng:
A. Liên kết bội luôn có hai liên kết π
B. Liên kết ba gồm 2 liên kết δ và một liên kết π
C. Liên kết bội là liên kết đôi
D. Liên kết đơn bao giờ cũng là liên kết δ
Lời giải:
Chọn đáp án: D.
Bài 28: Phân tử BCl3 có góc liên kết bằng 120o do nguyên tử B ở trạng thái lai hoá
A. sp
B. sp2
C. sp3
D. không xác định
Lời giải:
Chọn đáp án: B.
Bài 29: Nguyên tử cacbon, lưu huỳnh trong phân tử C2H4, H2S lần lượt có sự lai hóa gì?
A. sp2, sp3
B. sp2, sp
C. sp3, sp
D. sp3, sp3
Lời giải:
Chọn đáp án: A.
Bài 30: Hợp chất nào được tạo thành chỉ bằng sự xen phủ trục ?
A. C2H6
B. N2
C. CO2
D. SO2
Lời giải:
Chọn đáp án: A.
Giải thích: Các liên kết đơn được tạo thành tử sự xen phủ trục và bền vững. Phân tử C2H6 chỉ chứa liên kết đơn.
Bài 31: Sự lai hóa sp2 sau đây xảy ra ở một nguyên tử do:
A. sự tổ hợp của 1orbitan s và 2 orbitan p của nguyên tử đó.
B. sự tổ hợp của 2orbitan s và 2 orbitan p của nguyên tử đó.
C. sự tổ hợp của 2orbitan s và 1 orbitan p của nguyên tử đó
D. sự tổ hợp của 1orbitan s và 3 orbitan p của nguyên tử đó
Lời giải:
Chọn đáp án: A
Bài 32: Nếu liên kết cộng hóa trị được hình thành do 2 electron của một nguyên tử và 1 obitan trống của nguyên tử khác thì liên kết đó được gọi là :
A. liên kết cộng hóa trị có cực.
B. liên kết cho – nhận .
C. liên kết tự do – phụ thuộc.
D. liên kết pi.
Lời giải:
Chọn đáp án: B.
Bài 33: Nhiệt độ sôi của H2O cao hơn so với H2S là do :
A. Liên kết hidro của H2O bền hơn
B. Độ dài liên kết trong H2O ngắn hơn trong H2S.
C. Sự phân cực liên kết trong H2O lớn hơn.
D. A và C
Lời giải:
Chọn đáp án: D.
Bài 34: Nguyên tử nguyên tố X có electron cuối cùng thuộc phân lớp s, nguyên tử nguyên tố Y có electron cuối cùng thuộc phân lớp p. X,Y đều thuộc nhóm A. Biết rằng tổng số electron trong nguyên tử của X và Y là 20. Bản chất của liên kết hóa học trong hợp chất X – Y là:
A. Sự góp chung đôi electron.
B. Sự góp đôi electron từ một nguyên tử.
C. Sự tương tác yếu giữa hai nguyên tử có chênh lệch độ âm điện lớn.
D. Lực hút tĩnh điện giữa hai ion trái dấu
Lời giải:
Chọn đáp án: D
Giải thích:
X có e cuối thuộc phân lớp s ⇒ nhóm A (I hoặc II).
Y có e cuối thuộc phân lớp p ⇒ nhóm A (III → VIII).
eX + eY = 20 ⇒ pX + pY = 20
Ta có: X chỉ có thể là: H (p = 1); He (p = 2); Na (p = 11) và K (p = 19).
⇒ Ta thấy chỉ có Na (p = 11) ⇒ pY = 9 (Flo) thỏa mãn.
⇒ X - Y: NaF (liên kết ion)
Bài 35: Chất nào sau đây trong phân tử chỉ có liên kết đơn.
A. C2H3Cl.
B. C2H4
C. CH4
D. C2H2
Lời giải:
Chọn đáp án: C
Giải thích: CTCT của các chất: C2H3Cl (CH2=CHCl), C2H4 (CH2 =CH2), C2H2 (CH≡CH).
Bài 36: Nguyên tố X và Y thuộc nhóm A; nguyên tử nguyên tố X có 7 electron trên các phân lớp s, nguyên tử nguyên tố Y có 17 electron trên các phân lớp p. Công thức hợp chất tạo bởi X và Y; liên kết hóa học trong hợp chất đó là:
A. XY; liên kết ion.
B. Y2X; liên kết ion.
C. X5Y; liên kết cộng hoá trị.
D. X7Y; liên kết cộng hoá trị.
Lời giải:
Chọn đáp án: A
Giải thích:
Nguyên tử nguyên tố X có 7 electron trên các phân lớp s
⇒ X: 1s22s22p63s23p64s1
Vì thuộc nhóm A nên X thuộc nhóm IA
nguyên tử nguyên tố Y có 17 electron trên các phân lớp p
⇒ Y: 1s22s22p63s23p63d104s24p5 ⇒ 4s24p5
Vì Y thuộc nhóm A ⇒ Y thuộc nhóm VIIA
⇒ Hợp chất XY: liên kết ion
Bài 37: Chọn chất có tinh thể phân tử :
A. iot, kali clorua.
B. iot, kim cương.
C. nước đá, iot.
D. kim cương, silic.
Lời giải:
Chọn đáp án: C
Bài 38: Chọn câu sai :
A. Kim cương thuộc loại tinh thể nguyên tử.
B. Trong tinh thể nguyên tử, các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị.
C. Liên kết trong tinh thể nguyên tử rất bền.
D. Tinh thể nguyên tử có nhiệt độ nóng chảy và sôi thấp.
Lời giải:
Chọn đáp án: D.
Giải thích: Do có liên kết cộng hóa trị bền nên nhiệt độ nóng chảy, nhiệt độ sôi của tinh thể nguyên tử cao.
Bài 39: Chọn phát biểu đúng trong các phát biểu sau
A. NH3 có cấu trúc tam giác đều
B. CO2 và SO2 đều có cấu trúc thẳng
C. CO2 và BeCl2 đều có cấu trúc tam giác cân.
D. CH4 cấu trúc tứ diện đều.
Lời giải:
Chọn đáp án: D.
Giải thích:
A. NH3 có cấu tạo chóp
B. SO2 đều có cấu trúc góc
C. CO2 có cấu trúc thẳng.
Bài 40: Cation X+ do 5 nguyên tử của 2 nguyên tố hóa học tạo nên. Tổng số proton trong X+ là 11. Công thức của X+ là:
A. NH4+
B. NH3Cl+
C. Al(OH)4+
D. Ba(OH)4+
Lời giải:
Chọn đáp án: A.
Giải thích:
Số proton trung bình của một hạt nhân nguyên tử trong X+ là 11/5= 2,2. Vậy một nguyên tố trong X+ có điện tích hạt nhân nhỏ hơn 2,2, nguyên tố đó là H (Z = 1). Loại trường hợp He (Z = 2) vì He là khí hiếm không tạo được hợp chất. Vậy công thức ion X+có dạng: [A5-nHn]+. Trong đó : (5-n).ZA+ n = 11.
Ta lập bảng sau:
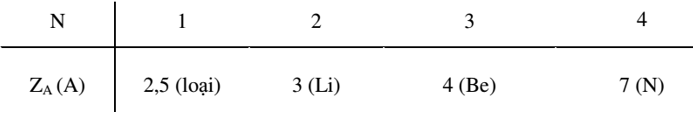
Ta loại các trường hợp A là Li, Be vì các ion X+ tương ứng không tồn tại.
Trường hợp A là nitơ thỏa mãn vì ion amoni tồn tại. Vậy X+ là ion NH4+

Bài 41: Anion X- có tổng số các hạt bằng 53, số hạt mang điện chiếm 66,04%. Cấu hính e của X- là:
A. 1s22s22p63s23p5.
B. 1s22s22p63s23p6.
C. 1s22s22p63s23p4.
D. 1s22s22p6.
Lời giải:
Chọn đáp án: C
Giải thích:
Ta có: Anion X- có tổng số các hạt bằng 53
2p + n + 1 = 53
Số hạt mang điện chiếm 66,04%, vậy số hạt không mang điện chiếm 33,96%
n= 33,96%.53 ⇒ n = 18, p = 17
Vậy X là Clo, cấu hình của X 1s22s22p63s23p5.
Bài 42: Hợp chất có công thức là AB2 có tổng số hạt mang điện bằng 64. Trong đó, hạt mang điện trong hạt nhân A nhiều hơn hạt mang điện trong hạt nhân B là 8.Phân tử AB2 có liên kết:
A. ion.
B. cộng hóa trị.
C. phối trí.
D. liên kết kim loại
Lời giải:
Chọn đáp án: B
Giải thích:
Ta có:
Tổng số e trong ion AB2 là 64
2pA + 4pB = 64 (do p = e)
Hạt mang điện trong hạt nhân A nhiều hơn hạt mang điện trong hạt nhân B là 8
pA - pB = 8
Giải ra ta có pA =16 , pB = 8.
Liên kết trong SO2 là liên kết cộng hóa trị
Sử dụng dữ kiện, trả lời câu hỏi 43,44
X, Y là hai nguyên tố thuộc cùng một nhóm A, ở hai chu kỳ liên tiếp. Cho biết tổng số electron trong anion XY32- là 42.
Bài 43: Xác định hai nguyên tố X, Y và XY32- trong số các phương án sau :
A. Be, Mg và MgBe3.
B. S, O và SO32-.
C. C, O và CO32-.
D. Si, O và SiO32-.
Lời giải:
Chọn đáp án: B.
Bài 44: Liên kết giữa X và Y trong ion XY32- thuộc loại liên kết nào ?
A. Liên kết cộng hóa trị phân cực.
B. Liên kết cộng hóa trị không phân cực.
C. Liên kết ion.
D. Liên kết cho - nhận.
Lời giải:
Chọn đáp án: A
Giải thích:
X, Y là hai nguyên tố thuộc cùng một nhóm A, ở hai chu kỳ liên tiếp nên có thể hơn kém nhau 8/18 hạt proton.
Tổng số electron: pX + 3pY + 2= 42 (do p =e)
Nếu pX – pY = 8, pX = 16, pY = 8 Ion là SO32-
Nếu pY – pX = 8, pX = 4, pY = 12, loại vì Be và Mg không tạo ion dạng MgBe32-
Bài 45: So với N2, khí NH3 tan được nhiều trong nước hơn vì:
A. NH3 có liên kết cộng hóa trị phân cực.
B. NH3 tạo được liên kết hiđro với nước.
C. NH3 có phản ứng một phần với nước.
D. trong phân tử NH3 chỉ có liên kết đơn.
Lời giải:
Chọn đáp án: B.
Giải thích:
Nước là dung môi phân cực, do oxy có độ âm điện lớn hơn H nên trong phân tử nước O tích điện âm, H tích điện dương.
NH3 cũng phân cực mạnh, trong phân tử N có 2e chưa sử dụng và độ âm điện lớn nên tích điện âm, H tích điện dương.
Khi NH3 gặp nước thì đầu âm của phân tử này hút đầu dương của phân tử kia làm cho các phân tử NH3 phân tán vào nước, nên NH3 tan trong nước. Sở dĩ NH3 tan nhiều là vì liên kết hydro giữa NH3 và nước khá mạnh.
Bài 46: Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34,trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện.Nguyên tố R tạo với Cl hợp chất có liên kết là?
A. Liên kết cộng hóa trị
B. Liên kết ion
C. Liên kết cho nhận
D. Liên kết phối trí
Lời giải:
Chọn đáp án: B
Giải thích:
Tổng số các loại hạt proton, nơtron và electron của R là 34
P + n + e = 34 ⇒ 2p + n = 34 (1)
Tổng số hạt mang điện gấp 1,833 lần số hạt không mang điện
P + e = 1,833n hay 2p -1,833n = 0 (2)
Từ (1), (2) ta có p = e = 11, n =12
Cấu hình electron của R là : Na, 1s22s22p63s1, R tạo với Cl hợp chất có liên kết ion.
Bài 47: Nguyên tử R có tống số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân gấp 1,059 lần số hạt mang điện tích âm. Số oxi hóa cao nhất R có thể tạo với oxi là?
A. +1 B. +3
C. +5 D. +7
Lời giải:
Chọn đáp án: D.
Giải thích:
Tổng số các loại hạt proton, nơtron và electron của R là 52
P + n + e = 52 ⇒ 2p + n = 52 (1)
Tổng số hạt không mang điện gấp 1,059 số hạt mang điện âm
n = 1,059.e hay n -1,059p = 0 (2)
Từ (1), (2) ta có p = e =17 , n =18
R là Clo, thuộc nhóm VIIA. Số oxi hóa cao nhất tạo với oxi là +7
Bài 48: Anion XY32- có tổng số hạt mang điện là 62. Số hạt mang điện trong hạt nhân của Y nhiều hơn số hạt mang điện trong hạt nhân của X là 2. Nhận định nào sau đây là sai?
A. Y là nguyên tố thuộc chu kì 2.
B. X là nguyên tố cacbon.
C. Trong phân tử hợp chất giữa Na, X,Y vừa có liên kết ion vừa có liên kết cộng hóa trị.
D. Hợp chất tạo giữa X và Y có dạng XY2 thì số proton là 32
Lời giải:
Chọn đáp án: D
Giải thích:
(XY3)2- có tổng số hạt mang điện là 62 ⇒ 2.Zx + 2.3.Zy = 60
Số hạt mang điện trong hạt nhân của Y nhiều hơn số hạt mang điện trong hạt nhân của X là 2 hạt ⇒ Zy - Zx = 2
Giải ra ta có: Zy = 8 (O); Zx = 6(C)
Trong CO2: pc + po.2 = 22
Bài 49: X và Y đều là hợp chất ion cấu tạo thành từ các ion có chung cấu hình electron 1s22s22p6. Tổng số hạt proton, nơtron, electron trong phân tử X và Y lần lượt là 92 và 60. X và Y lần lượt là :
A. MgO; MgF2
B. MgF2 hoặc Na2O; MgO
C. Na2O; MgO hoặc MgF2
D. MgO; Na2O.
Lời giải:
Chọn đáp án: B
Giải thích:
Anion có cấu hình1s22s22p6 ⇒ Anion là F hoặc O
Cation có cấu hình1s22s22p6 ⇒ Cation là Na hoặc Mg
Nếu anion là O, tổng số hạt p,n,e trong X là 92, X là Na2O (2pNa + nNa) + (2pO + nO) = 92
Tổng số hạt trong Y là 60, vậy Y là MgO.
Nếu anion là F.
Tổng số hạt trong X là 92. X là MgF2 (2pMg + nMg) + (2.2pF + 2nF) = 92
Bài 50: X, Y, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8. Nếu các cặp X và Y; Y và Z; X và Z tạo thành liên kết hoá học thì các cặp nào sau đây có liên ion?
A. Cặp X và Z.
B. Cả 3 cặp.
C. Cặp X và Y, cặp X và Z.
D. Cặp X và Y, cặp Y và Z.
Lời giải:
Chọn đáp án: D
Giải thích: X là F, Y là K, Z là O. Liên kết ion tạo thành trong KF, K2O

Bài 51: Hợp chất vô cơ T có công thức phân tử XY2. Tổng số các hạt trong phân tử T là 66, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của Y nhiều hơn X là 4. Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt. Trong T chỉ chứa loại liên kết nào?
A. Liên kết cộng hóa trị.
B. Liên kết ion
C. Liên kết cho nhận
D. Liên kết cộng phối trí.
Lời giải:
Chọn đáp án: A.
Giải thích:
Gọi tổng số hạt proton, nơtron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, nơtron và electron của nguyên tử XY2 là 66
Px + nx + ex + 2.(py + ny + ey)= 66 hay 2px + nx + 4py +2ny = 66 (1) px = ex và py = ey.
Số hạt mang điện nhiều hơn số hạt không mang điện là 22 nên :
Px + ex + 2py + 2ey – nx - 2ny = 22 2px + 4py - nx - 2ny = 22 (2)
Số khối của Y nhiều hơn X là 4
Px + nx – (py + ny) = 4 (3)
Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt
py + ny + ey – (Px + nx + ex) = 6 hay 2py + ny – (2px + nx) = 6 (4)
Từ (1), (2), (3), (4) ta có : px = 6 (C) và py = 8 (O).
CTCT của CO2 : O=C=O, phân tử chỉ có liên kết cộng hóa trị.
Bài 52: Cộng hoá trị của một nguyên tố có cấu hình electron ngoài cùng 3s23p4 là :
A. 2 B. 3
C. 4 D. 6
Lời giải:
Chọn đáp án: A
Bài 53: Số liên kết σ (xích ma) có trong mỗi phân tử: etilen; axetilen; metan lần lượt là
A. 3; 5; 9
B. 5; 3; 4
C. 4; 2; 6
D. 4; 3; 6
Lời giải:
Chọn đáp án: B
Giải thích:
CTCT: etilen (CH2=CH2): Có 5 liên kết σ
Axetilen (CH≡CH), có 3 liên kết σ
Metan CH4: có 4 liên kết σ
Sử dụng dữ kiện sau, trả lời câu hỏi 54, 55
Dựa vào độ âm điện, hãy nêu bản chất liên kết trong các phân tử và ion:
| Nguyên tố | K | H | C | S | Cl | O |
|---|---|---|---|---|---|---|
| Độ âm điện: | 0,8 | 2,1 | 2,5 | 2,5 | 3 | 3,5 |
Bài 54: Trong phân tử HClO có chứa các loại liên kết nào?
A. Liên kết cộng hóa trị phân cực
B. Liên kết cộng hóa trị phân cực và không phân cực
C. Liên kết ion và cộng hóa trị phân cực
D. Liên kết cộng hóa trị và cho nhận.
Lời giải:
Chọn đáp án: A
Bài 55: Trong phân tử KHS tồn tại những loại liên kết nào?
A. Liên kết ion và cho nhận
B. Liên kết cộng hóa trị không phân cực
C. Liên kết ion và liên kết cộng hóa trị không phân cực.
D. Liên kết ion và liên kết cộng hóa trị phân cực.
Lời giải:
Chọn đáp án: D
Giải thích:
Trong HClO: H-O-Cl có liên kết H-O là cộng hoá trị phân cực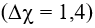
liên kết O-Cl là cộng hoá trị phân cực yếu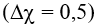
Trong KHS: K-S-H có liên kết K-S là liên kết ion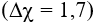
liên kết S-H là cộng hoá trị phân cực yếu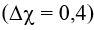
Bài 56: Vì sao độ âm điện của nitơ và clo xấp xỉ nhau nhưng ở điều kiện thường N2 có tính oxi hoá kém Cl2?
A. Do Clo có phân tử khối lớn hơn so với N2.
B. Clo có nhiều electron hơn.
C. Do N2 có liên kết ba bền vững, nên tính oxi hóa yếu.
D. Do N2 có ít proton hơn.
Lời giải:
Chọn đáp án: C.
Giải thích:
Ở điều kiện thường, phân tử N2 có liên kết ba bền vững (N-N) hơn so với phân tử Cl2
chỉ có liên kết đơn (Cl-Cl) ⇒ phân tử kém bền hơn sẽ có tính oxi hoá mạnh hơn
Bài 57: Dựa vào độ âm điện, hãy sắp xếp theo chiều tăng độ phân cực của liên kết giữa 2 nguyên tử trong phân tử các chất sau: CaO, MgO, CH4, AlN, N2, NaBr, BCl3(Cho độ âm điện của O = 3,5; Cl = 3,0; Br = 2,8; Na = 0,9; Mg = 1,2; Ca = 1,0; C = 2,5; H = 2,1; Al = 1,5; N = 3; B =2,0).
A. N2, CH4, BCl3, AlN, NaBr, MgO, CaO
B. N2, CH4, AlN, BCl3, NaBr, MgO, CaO
C. N2, CH4, BCl3, AlN, NaBr, CaO, MgO
D. N2, CH4, AlN, NaBr, BCl3, MgO, CaO
Lời giải:
Chọn đáp án: A.
Giải thích: Thứ tự tăng dần độ phân cực của liên kết:
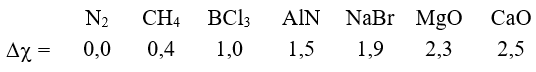
Bài 58: Mức độ phân cực của liên kết hoá học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là:
A. HI, HBr, HCl
B. HI, HCl, HBr
C. HCl, HBr, HI
D. HBr, HI, HCl
Lời giải:
Chọn đáp án: C
Giải thích:
Vì từ Cl → Br → I thì bán kính tăng rất nhanh trong khi độ âm điện lại giảm chậm
⇒ Độ phân cực H-X nhìn chung là tăng
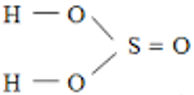
Bài 59: Trong phân tử H2SO3, có ..... liên kết đơn; ….. liên kết đôi; ..... liên kết δ; ..... liên kết π. Các số thích hợp điền vào các chỗ trống trên lần lượt là:
A. 4, 1, 5, 1
B. 2, 1, 3, 1
C. 2, 1, 3, 2
D. 4, 0, 5, 0
Lời giải:
Chọn đáp án: A.
Giải thích: Công thức cấu tạo của H2SO3
Bài 60: Chọn phát biểu sai:
A. Liên kết cộng hóa trị luôn được tạo thành giữa hai nguyên tử phi kim
B. Sự xen phủ bên tạo nên liên kết π
C. Sự xen phủ trục tạo liên kết σ
D. Lai hóa sp2 tạo bởi 1 obitan s và 2 obitan p
Lời giải:
Chọn đáp án: A.
Giải thích: phân tử AlCl3 có liên kết cộng hóa trị
Bài 61: Hợp chất M tạo bởi hai nguyên tố X và Y trong đó X, Y có số oxi hóa cao nhất trong các oxit là +nO, +mO và có số oxi hóa âm trong các hợp chất với hiđro là –nH, –mH và thoả mãn điều kiện :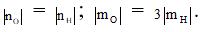
Biết X có số oxi hoá cao nhất trong M, công thức phân tử của M là công thức nào sau đây ?
A. XY2.
B. X2Y.
C. XY.
D. X2Y3.
Lời giải:
Chọn đáp án: A.
Giải thích:
+ Nguyên tố thuộc nhóm I, II, III không có số oxi hóa âm.
+ nO + | nH | = 8
Đề cho | nO | = | nH | ⇒ X thuộc nhóm IV
Đề cho | mO | = 3| mH | ⇒ mO = 3| 8 - mO | ⇒ mO = 6 ⇒ Y thuộc nhóm VI
Y thuộc nhóm VI có : O(16) , S(32) , Se (79)
⇒ X tương ứng là: C(12) , Si(14)
Biết X có số oxi hóa cao nhất trong M
⇒ X có số oxi hóa = nO = +4
⇒ M có dạng : XY2

Bài 62: Giống nhau giữa liên kết ion và liên kết kim loại là:
A. Đều được tạo thành do sức hút tĩnh điện.
B. Đều có sự cho và nhận các electron hóa trị.
C. Đều có sự góp chung các electron hóa trị.
D. Đều tạo thành các chất có nhiệt độ nóng chảy cao.
Lời giải:
Chọn đáp án: A.
Bài 63: Nguyên tử nguyên tố X có electron cuối cùng được phân bổ vào phân lớp 3p5. Nguyên tử nguyên tố Y có electron cuối cùng được phân bổ vào phân lớp 3p3. Nhận định nào sau đây là đúng.
A. X có 15 proton trong hạt nhân.
B. Y có xu hướng nhường đi 3 eletron
C. X,Y tạo với nhau hợp chất có liên kết cộng hóa trị
D. X có xu hướng nhận thêm 3 eletron.
Lời giải:
Chọn đáp án: C.
Giải thích:
Cấu hình electron đầy đủ của X: 1s22s22p63s23p5 Số p= 17 (có xu hướng nhận 1 e)
Cấu hình electron đầy đủ của Y: 1s22s22p63s23p3 số p = 15 (có xu hướng nhận 3e)
PCl3, PCl5 chứa liên kết cộng hóa trị.
Bài 64: Cho tinh thể các chất sau: iot (1), kim cương (2), nước đá (3), muối ăn (4), silic (5). Tinh thể nguyên tử là các tinh thể :
A. (1), (2), (5).
B. (1), (3), (4).
C. (2), (5).
D. (3), 4).
Lời giải:
Chọn đáp án: C
Giải thích: Tinh thể iot và tinh thể nước đá, tinh thể muối ăn là tinh thể phân tử.
Bài 65: Photpho có thể tạo với Clo 2 hợp chất đó là PCl3 và PCl5 trong khi nitơ chỉ tạo với Clo hợp chất NCl3 đó là do
A. Nguyên tử nitơ có bán kính nguyên lử nhỏ hon photpho.
B. Nguyên tử nitơ có độ âm điện lớn hơn photpho.
C. Nguyên tử nitơ không có trạng thái kích thích trong khi photpho thì có.
D. Nguyên tử nitơ có điện lích hạt nhân bé hơn pholpho.
Lời giải:
Chọn đáp án: C
Giải thích: Photpho có cấu hình 1s22s22p63s23p3, còn phân lớp 3d trống nên có thể kích thích e lên phân lớp 3d.
Bài 66: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Tinh thể canxi có cấu trúc lập phương tâm diện. Bán kính nguyên tử canxi tính theo lý thuyết là:
A. 0,196 nm.
B. 0,185 nm.
C. 0,168 nm.
D. 0,155 nm.
Lời giải:
Chọn đáp án: A.
Giải thích:
Trong tinh thể lập phương tâm diện, độ đặc khít là 74%.
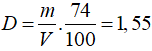
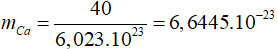
V = 4/3π .R3
Ta có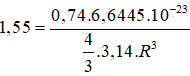
⇒ R = 1,96.10-8 (cm) = 0,196nm.
Bài 67: Phát biểu nào sau đây là đúng ?
A. Ở thể rắn, NaCl tồn tại dưới dạng tinh thể phân tử.
B. Photpho trắng có cấu trúc tinh thể nguyên tử.
C. Kim cương có cấu trúc tinh thể phân tử.
D. Nước đá thuộc loại tinh thể phân tử.
Lời giải:
Chọn đáp án: D.
Bài 68: Công thức nào sau đây là công thức cấu tạo đúng của hợp chất C3H6?
A. 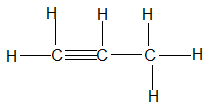
B. 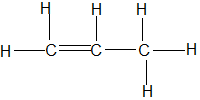
C. 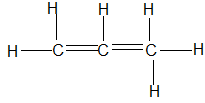
D. 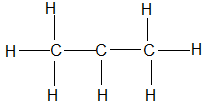
Lời giải:
Chọn đáp án: B
Bài 69: Liên kết trong các phân tử:
A. NaF , Cl2, PCl3 là liên kết ion
B. Cl2, NH3, CaO là liên kết cộng hóa trị.
C. NaF , CaO là liên kết ion.
D. Tất cả đều sai.
Lời giải:
Chọn đáp án: C
Giải thích: Đáp án A Cl2 là liên kết cộng hóa trị, đáp án B CaO là liên kết ion.

Bài 70: Liên kết trong phân tử HF, HCl, HBr, HI, H2O đều là
A. liên kết ion.
B. liên kết cộng hóa trị có cực.
C. liên kết cộng hóa trị không cực.
D. liên kết đôi.
Lời giải:
Chọn đáp án: B.
Giải thích: Các nguyên tố F, Cl, Br, I, O đều có độ âm điện lớn hơn nhiều so với H, nên liên kết tạo thành là liên kết cộng hóa trị phân cực.
Bài 71: Công thức cấu tạo nào viết sai ( 1H; 6C ; 7N ; 8O ; 17Cl, 16S) :
A. H-Cl
B. O=C=O
C. H-Cl-O
D. N≡N.
Lời giải:
Chọn đáp án: C.
Giải thích: Công thức đúng H-O-Cl
Bài 72: Tìm câu sai :
A. kim cương là một dạng thù hình của cacbon, thuộc loại tinh thể nguyên tử.
B. trong mạng tinh thể nguyên tử, các nguyên tử được phân bố luân phiên đều đặn theo một trật tự nhất định.
C. liên kết giữa các nguyên tử trong tinh thể nguyên tử là liên kết yếu
D. tinh thể nguyên tử bền vững, rất cứng, nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
Lời giải:
Chọn đáp án: C.
Giải thích: Tinh thể nguyên tử có liên kết cộng hóa trị bền vững
Bài 73: Cation R+ có cấu hình e phân lớp ngoài cùng là 2p6. Liên kết giữa nguyên tử nguyên tố R với oxi thuộc loại liên kết gì?
A. Liên kết cộng hóa trị
B. Liên kết ion.
C. Liên kết cộng hóa trị có cực.
D. Liên kết cho–nhận.
Lời giải:
Chọn đáp án: B
Giải thích:
Cấu hình của R: 1s22s22p63s1
R là kim loại, liên kết với oxi là liên kết ion.
Bài 74: Kiểu liên kết trong KCl, N2, NH3 lần lượt là:
A. ion, cộng hóa trị không cực,cộng hóa trị không cực.
B. ion, cộng hóa trị có cực, cộng hóa trị không cực.
C. ion, Cộng hóa trị có cực, cộng hóa trị có cực.
D. ion, cộng hóa trị không cực, cộng hóa trị có cực.
Lời giải:
Chọn đáp án: D
Bài 75: Cho các chất : HF, NaCl, CH4, Al2O3, K2S, MgCl2. Số chất có liên kết ion là (Độ âm điện của K: 0,82; Na: 0,93; Al: 1,61; S: 2,58; Cl: 3,16 và O: 3,44; Mg: 1,31; H: 2,20; C: 2,55; F: 4,0) :
A. 3 B. 2
C. 1 D. 4
Lời giải:
Chọn đáp án: D
Giải thích: NaCl, Al2O3, K2S, MgCl2

