75 câu trắc nghiệm Liên kết hóa học có lời giải chi tiết (cơ bản) - Hoá học lớp 10
75 câu trắc nghiệm Liên kết hóa học có lời giải chi tiết (cơ bản)
Với 75 câu trắc nghiệm Liên kết hóa học có lời giải chi tiết (cơ bản) Hoá học lớp 10 tổng hợp 75 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Liên kết hóa học từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Bài 1: Chỉ ra nội dung sai khi nói về ion :
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Lời giải:
Chọn đáp án: B.
Giải thích: Ion âm gọi là anion, ion dương gọi là cation.
Bài 2: Cho các ion : Na+, Al3+, SO42-, NO3-, Ca2+, NH4+, Cl–. Hỏi có bao nhiêu cation ?
A. 2 B. 3
C. 4 D. 5
Lời giải:
Chọn đáp án: C
Giải thích: Cation là phần tử mang điện dương, các cation lần lượt là: Na+, Ca2+, Al3+, NH4+
Bài 3: Trong các phản ứng hoá học, nguyên tử kim loại có khuynh hướng
A. nhận thêm electron.
B. Nhận hay nhường electron phụ thuộc vào từng phản ứng cụ thể
C. Nhường bớt electron.
D. Nhận hay nhường electron phụ thuộc vào từng kim loại cụ thể.
Lời giải:
Chọn đáp án: C.
Giải thích: Kim loại thường có 1,2,3 electron lớp ngoài cùng nên sẽ có khuynh hướng nhường electron.
Bài 4: Cho các phân tử : H2, CO2, HCl, Cl2. Có bao nhiêu phân tử có cực ?
A. 1 B. 2
C. 3 D. 4
Lời giải:
Chọn đáp án: A
Giải thích:
Có thể dựa vào hiệu độ âm điện của các nguyên tố hoặc công thức cấu tạo của các phân tử.
Các phân tử có cực là HCl.
CTCT của các hợp chất là: H-H (H2), O=C=O (CO2), H-Cl, Cl-Cl (Cl2)
Bài 5: Liên kết hóa học trong phân tử Br2 thuộc loại liên kết:
A. cộng hoá trị không cực.
B. hiđro.
C. cộng hoá trị có cực.
D. ion
Lời giải:
Chọn đáp án: A.
Giải thích: Do 2 nguyên tử brom có độ âm điện tương tự nhau.
Bài 6: Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết:
A. cộng hoá trị không cực.
B. hiđro.
C. cộng hoá trị có cực.
D. ion
Lời giải:
Chọn đáp án: C.
Giải thích: Độ âm điện của nguyên tử H = 2,2, của nguyên tử Cl = 3,16, cặp e chung sẽ lệch về phía nguyên tử có độ âm điện lớn hơn (Cl)
Bài 7: Liên kết trong hợp chất nào dưới đây thuộc loại liên kết ion (biết độ âm điện của Cl(3,16), Al(1,61), Ca(1), S (2,58)
A. AlCl3
B. CaCl2
C. CaS
D. Al2S3
Lời giải:
Chọn đáp án: B
Giải thích: Liên kết ion là liên kết mà hiệu độ âm điện giữa hai nguyên tử tham gia liên kết ≥ 1,7.
| Phân tử | AlCl3 | CaCl2 | CaS | Al2S3 |
|---|---|---|---|---|
| Hiệu độ âm điện | 1,55 | 2,16 | 1,58 | 0,97 |
Bài 8: Số oxi hoá của nguyên tố lưu huỳnh trong các chất : S, H2S, H2SO4, SO2 lần lượt là :
A. 0, +2, +6, +4.
B. 0, –2, +4, –4.
C. 0, –2, –6, +4.
D. 0, –2, +6, +4.
Lời giải:
Chọn đáp án: D.
Giải thích: Gọi số oxi hóa của S là x
| S | H2S | H2SO4 | SO2 |
|---|---|---|---|
| 0 | (+1).2 + x = 0 ⇒ x = -2 | (+1).2 + x + (-2).4 = 0 x = +6 | x + (-2).2 = 0 x = +4 |
Bài 9: Hợp chất mà nguyên tố clo có số oxi hoá +3 là :
A. NaClO
B. NaClO2
C. NaClO3
D. NaClO4
Lời giải:
Chọn đáp án: B
Giải thích:
Gọi số oxi hóa của Cl là x.
Ta có số oxi hóa của Na = +1, O = - 2
(+1).1 + x.1 + (-2).2 ⇒ x = +3
Bài 10: Chỉ ra nội dung sai :
A. Số oxi hoá của nguyên tố trong các hợp chất bằng hoá trị của nguyên tố đó.
B. Trong một phân tử, tổng số oxi hoá của các nguyên tố bằng không.
C. Số oxi hoá của ion đơn nguyên tử bằng điện tích của ion đó.
D. Tổng số oxi hoá của các nguyên tố trong ion đa nguyên tử bằng điện tích của ion đó.
Lời giải:
Chọn đáp án: A
Bài 11: Liên kết ion là liên kết được hình thành bởi:
A. Sự góp chung các electron độc thân.
B. Sự cho – nhận cặp electron hoá trị.
C. Lực hút tĩnh điện giữa các ion mang điện trái dấu.
D. Lực hút tĩnh điện giữa các ion dương và electron tự do.
Lời giải:
Chọn đáp án: C.
Bài 12: Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là:
A. Liên kết ion.
B. Liên kết cộng hoá trị.
C. Liên kết kim loại.
D. Liên kết hiđro.
Lời giải:
Chọn đáp án: B.
Bài 13: Chỉ ra nội dung sai khi xét phân tử CO2 :
A. Phân tử có cấu tạo góc.
B. Liên kết giữa nguyên tử oxi và cacbon là phân cực.
C. Phân tử CO2 không phân cực.
D. Trong phân tử có hai liên kết đôi.
Lời giải:
Chọn đáp án: A.
Giải thích: Phân tử CO2 có cấu tạo thẳng: O=C=O
Bài 14: Hợp chất trong phân tử có liên kết ion là cho biết độ âm điện của H (2,2), O (3,44), N (3,04), Cl (3,16) , Mg(1,31)
A. HCl.
B. NH3.
C. H2O.
D. MgCl2
Lời giải:
Chọn đáp án: D
Giải thích: Liên kết ion là liên kết mà hiệu độ âm điện giữa hai nguyên tử tham gia liên kết ≥ 1,7.
| Phân tử | HCl | NH3. | H2O | MgCl2 |
|---|---|---|---|---|
| Hiệu độ âm điện | 0,96 | 0,84 | 1,24 | 1,85 |
Bài 15: Liên kết hoá học giữa các nguyên tử trong phân tử H2O là liên kết
A. cộng hoá trị không phân cực.
B. hiđro.
C. cộng hoá trị phân cực.
D. ion
Lời giải:
Chọn đáp án: C.
Giải thích: Nguyên tử oxi có độ âm điện lớn hơn nhiều so với nguyên tử hidro, và hiệu độ âm điện trong phân tử H2O = XO-XH = 1,24 ⇒ Liên kết cộng hóa trị phân cực
Bài 16: Số oxi hoá của nguyên tố nitơ trong các hợp chất : NH4Cl, HNO3, NO, NO2, N2, N2O lần lượt là :
A. - 4, +6, +2, +4, 0, +1
B. 0, +1,–4, +5, –2, 0
C. -3, +5, +2,+4, 0,+1
D. 0, +1.+3, –5, +2, –4
Lời giải:
Chọn đáp án: C.
Giải thích: Gọi số oxi hóa của N là x, số oxi hóa trong hợp chất của H =+1, O = -2.
| NH4Cl | HNO3 | NO | NO2 | N2 | N2O |
|---|---|---|---|---|---|
x + (+1).4 + (-1) = 0 x = -3 | (+1) + x + (-2).3 = 0 x = +5 | X = +2 | x = +4 | 0 | x.2 + (-2) = 0 ⇒ x = +1 |
Bài 17: Chọn nội dung đúng để hoàn thành câu sau : “Trong tất cả các hợp chất,...”
A. Số oxi hoá của hiđro luôn bằng +1.
B. Số oxi hoá của natri luôn bằng +1.
C. Số oxi hoá của oxi luôn bằng –2.
D. Cả A, B, C.
Lời giải:
Chọn đáp án: B.
Giải thích:
Trong NaH, số oxi hóa của H = -1.
Trong H2O2, số oxi hóa của O = -1
Bài 18: Chỉ ra nội dung sai khi hoàn thành câu sau : “Trong tất cả các hợp chất,...”
A. kim loại kiềm luôn có số oxi hoá +1
B. halogen luôn có số oxi hoá –1.
C. hiđro hầu hết có số oxi hoá +1, trừ một số trường hợp như hiđrua kim loại (NaH, CaH2....).
D. kim loại kiềm thổ luôn có số oxi hoá +2.
Lời giải:
Chọn đáp án: B.
Giải thích: Ví dụ trong KClO, số oxi hóa của Cl là + 1.

Bài 19: Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là
A. O2, H2O, NH3
B. H2O, HF, H2S
C. HCl, O3, H2S
D. HF, Cl2, H2O
Lời giải:
Chọn đáp án: B
Giải thích: Đáp án A loại O2, đáp án C loại O3, đáp án D loại Cl2. Đây là các phân tử không phân cực
Bài 20: Các chất mà phân tử không phân cực là:
A. HBr, CO2, CH4
B. Cl2, CO2, C2H2
C. HCl, C2H2, Br2
D. NH3, Br2, C2H4
Lời giải:
Chọn đáp án: B
Giải thích: Đáp án A loại HBr (∆X = 0,76, liên kết cộng hóa trị phân cực), đáp án C loại HCl (∆X = 0,96), đáp án D loại NH3 (∆X = 0,84).
Bài 21: Cho giá trị độ âm điện của các nguyên tố: F (3,98), O (3,44), C (2,55), H(2,20), Na(0,93), Hợp chất nào sau đây là hợp chất ion:
A. NaF
B. CH4
C. H2O
D. CO2
Lời giải:
Chọn đáp án: A
Giải thích: Liên kết ion là liên kết mà hiệu độ âm điện giữa hai nguyên tử tham gia liên kết ≥ 1,7.
| Phân tử | NaF | CH4 | H2O | CO2 |
|---|---|---|---|---|
| Hiệu độ âm điện | 3,05 | 0,35 | 1,24 | 0,89 |
Bài 22: Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
A. Ở giữa hai nguyên tử.
B. Lệch về một phía của một nguyên tử.
C. Chuyển hẳn về một nguyên tử.
D. Nhường hẳn về một nguyên tử.
Lời giải:
Chọn đáp án: B.
Bài 23: Hoàn thành nội dung sau : “Nói chung, các chất chỉ có …………….. không dẫn điện ở mọi trạng thái”.
A. Liên kết cộng hoá trị
B. Liên kết cộng hoá trị có cực
C. Liên kết cộng hoá trị không có cực
D. Liên kết ion
Lời giải:
Chọn đáp án: C.
Bài 24: Liên kết cộng hóa trị là liên kết:
A. Giữa các phi kim với nhau
B. Trong đó cặp electron chung bị lệch về một nguyên tử
C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau
D. Được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung
Lời giải:
Chọn đáp án: D.
Bài 25: Chất nào dưới đây chứa ion đa nguyên tử:
A. CaCl2
B. NH4Cl
C. AlCl3
D. HCl
Lời giải:
Chọn đáp án: B.
Giải thích: Ion đa nguyên tử là NH4+
Bài 26: Số electron trong các cation: Na+, Mg2+, Al3+ là:
A. 11 B. 12
C. 10 D. 13
Lời giải:
Chọn đáp án: C
Giải thích: Nguyên tử Na, Mg, Al đã lần lượt nhường đi 1, 2, 3e để đạt cấu hình của Ne.
Bài 27: Số oxi hóa của nitơ trong NH4+, NO2- và HNO3 lần lượt là:
A. + 5, -3, + 3
B. +3, -3, +5
C. -3, + 3, +5
D. + 3, +5, -3
Lời giải:
Chọn đáp án: B
Giải thích: Gọi số oxi hóa của N là x.
| NH4+ | NO2- | HNO3 |
|---|---|---|
x + (+1).4 = +1 x = -3 | x + (-2).2 = -1 x = +3 | (+1) + x + (-2).3 = 0 x = +5 |
Bài 28: Trong phản ứng : 2Na + Cl2 → 2NaCl, có sự hình thành
A. cation natri và clorua.
B. anion natri và clorua.
C. anion natri và cation clorua.
D. anion clorua và cation natri.
Lời giải:
Chọn đáp án: D.
Giải thích:
Na → Na+ + 1e
Cl + 1e → Cl-
Bài 29: Chỉ ra nội dung sai khi nói về tính chất chung của hợp chất ion :
A. Khó nóng chảy, khó bay hơi.
B. Tồn tại dạng tinh thể, tan nhiều trong nước.
C. Trong tinh thể chứa các ion nên dẫn được điện.
D. Các hợp chất ion đều khá rắn.
Lời giải:
Chọn đáp án: C.
Giải thích: Hợp chất ion chỉ dẫn được điện khi tan trong nước hay ở trạng thái nóng chảy.
Bài 30: Phân tử nào phân cực mạnh nhất?
A. NaF
B. NaCl
C. NaBr
D. NaI
Lời giải:
Chọn đáp án: A.
Giải thích:
∆X = Xphi kim - XNa
Do F có độ âm điện lớn nhất, nên NaF sẽ phân cực mạnh nhất
Bài 31: Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là:
A. Lk ion
B. Lk cộng hóa trị
C. Lk cho- nhận
D. Không xác định được
Lời giải:
Chọn đáp án: A.
Giải thích:
Cấu hình của X: 1s22s22p63s23p5 (Cl)
Cấu hình của Y: 1s22s22p63s1 (Na)
Bài 32: Cho các nguyên tố A (ns1), B (ns2), X (ns2np5) đều thuộc chu kì nhỏ. Chọn phát biểu sai:
A. Liên kết giữa A và X: liên kết ion
B. A, B đều có xu hướng nhận e
C. X có xu hướng nhận thêm 1e.
D. A và B là kim loại, X là phi kim
Lời giải:
Chọn đáp án: B.
Giải thích: B là kim loại nhóm IIA, X là phi kim điển hình nhóm VIIA. Liên kết tạo thành là liên kết ion.
Bài 33: Số oxi hóa của Mn, Fe trong Fe3+, S trong SO3, P trong PO43- lần lượt là:
A. 0, +3, +6, +5
B. +3, +5, 0, +6
C. 0, +3, +5, +6
D. + 5, +6, + 3, 0
Lời giải:
Chọn đáp án: A.
Giải thích:
SO3: x + (-2).3 = 0 ⇒ x = +6
PO43-: x + (-2).4 = -3 ⇒ x = +5
Bài 34: Số oxi hóa của các nguyên tố Al, Ba, Cl, O, Na trong các hợp chất BaCl2, Al2O3, Na2O lần lượt là:
A. A. +3, + 2, -1, -2, + 1
B. + 1 , + 2 , +3, -1, -2
C. 3+ , 2+ , 1+ , 2- , 1-
D. 3+ , 2+ , 1- , 2- , 1+
Lời giải:
Chọn đáp án: A.
Bài 35: Hợp chất nào sau đây nitơ có cộng hóa trị 4:
A. NH4+
B. NH3
C. NO
D. N2
Lời giải:
Chọn đáp án: A
Bài 36: Nguyên tử X có cấu hình electron 1s22s22p63s23p3. Công thức phân tử hợp chất khí của X với hiđro:
A. H2S
B. HCl
C. NH3
D. PH3
Lời giải:
Chọn đáp án: D
Giải thích: X là P (có 15e, thuộc nhóm VA, hợp chất tạo với H có dạng XH3)

Bài 37: Số oxi hóa của Mn trong hợp chất KMnO4 :
A. + 1
B. + 7
C. - 7
D. - 1
Lời giải:
Chọn đáp án: B
Bài 38: Dãy chất nào sau đây đều chứa các chất có đồng thời ion đơn và ion đa nguyên tử:
A. NH4Cl, Na2SO4, H2S
B. KOH, Na2SO3, Ca(NO3)2
C. BaO, K3PO4, Al2(SO4)3
D. K2SO3, NH4NO3, Ca3(PO4)2
Lời giải:
Chọn đáp án: B
Bài 39: Hoàn thành nội dung sau : “Các ……….... thường tan nhiều trong nước. Khi nóng chảy và khi hoà tan trong nước, chúng dẫn điện, còn ở trạng thái rắn thì không dẫn điện”.
A. Hợp chất vô cơ
B. Hợp chất hữu cơ
C. Hợp chất ion
D. Hợp chất cộng hoá trị
Lời giải:
Chọn đáp án: C.
Bài 40: Nếu nguyên tử X có 3 e hoá trị và nguyên tử Y có 6 e hoá trị, thì công thức của hợp chất ion đơn giản nhất tạo bởi X và Y là :
A. XY2.
B. X2Y3.
C. X2Y2.
D. X3Y2.
Lời giải:
Chọn đáp án: B.
Giải thích:
X sẽ có xu hướng nhường 3e tạo cation X3+, Y có xu hướng nhận 2e để tạo anion Y2-
Hợp chất tạo thành có dạng: X2Y3
Bài 41: Liên kết ion tạo thành giữa hai nguyên tử
A. kim loại điển hình.
B. phi kim điển hình.
C. kim loại và phi kim.
D. kim loại điển hình và phi kim điển hình.
Lời giải:
Chọn đáp án: D
Bài 42: Hợp chất nào dưới đây chỉ có liên kết cộng hóa trị trong phân tử?
A. Na2O
B. HClO
C. KCl
D. NH4Cl
Lời giải:
Chọn đáp án: B.
Giải thích:
Đáp án A có liên kết ion giữa Na+ và O2-
Đáp án C có liên kết ion giữa K+ và Cl-
Đáp án D có liên kết ion giữa NH4+ và Cl-
Bài 43: Trong các chất sau đây, chất nào có liên kết cộng hoá trị ?
(1) H2S; (2) SO2 ;
(3) NaCl; (4) CaO ;
(5) NH3; (6) HBr ;
(7) H2SO4; (8) CO2; (9) K2S
A. (1), (2), (3), (4), (8), (9).
B. (1), (4), (5), (7), (8), (9).
C. (1), (2), (5), (6), (7), (8).
D. (3), (5), (6), (7), (8), (9).
Lời giải:
Chọn đáp án: C.
Bài 44: Cho các hợp chất sau : MgCl2, Na2O, NCl3, HCl, KCl. Hợp chất nào sau có liên kết cộng hoá trị ?
A. MgCl2 và Na2O.
B. Na2O và NCl3.
C. NCl3 và HCl.
D. HCl và KCl.
Lời giải:
Chọn đáp án: C.
Giải thích: Đáp án A, B, D đều chứa các hợp chất có liên kết ion lần lượt là MgCl2, Na2O, KCl.
Bài 45: Số electron trong các ion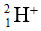
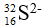
A. 1 và 16
B. 2 và 18
C. 1 và 18
D. 0 và 18
Lời giải:
Chọn đáp án: D.
Giải thích:
| Nguyên tử H | Ion H+ | Nguyên tử S | Ion S2- | |
|---|---|---|---|---|
| Số electron | 1 | 0 (nhường đi 1e) | 16 | 18 (nhận thêm 2e) |
Bài 46: số nơtron trong các ion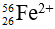
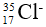
A. 26 và 17
B. 30 và 18
C. 32 và 17
D. 24 và 18
Lời giải:
Chọn đáp án: B
Giải thích:
Số nơtron trong Fe2+ = 56 - 26 = 30 hạt
Số nơtron trong Cl- = 35 – 17 = 18 hạt
Bài 47: Trong phân tử nitơ, các nguyên tử liên kết với nhau bằng liên kết :
A. cộng hóa trị không cực.
B. ion yếu.
C. ion mạnh.
D. cộng hóa trị phân cực.
Lời giải:
Chọn đáp án: A.
Giải thích: Công thức cấu tạo của N có dạng N ≡ N, hai phân tử Nito tạo liên kết cộng hóa trị không cực
Bài 48: Theo qui tắc bát tử thì công thức cấu tạo của phân tử SO2 là :
A. O – S – O.
B. O = S → O.
C. O = S = O.
D. O ← S → O.
Lời giải:
Chọn đáp án: B

Bài 49: Cho độ âm điện : Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion ?
A. H2S, NH3.
B. BeCl2, BeS.
C. MgO, Al2O3.
D. MgCl2, AlCl3.
Lời giải:
Chọn đáp án: C.
Giải thích: Dựa trên tính toán độ âm điện của các hợp chất. Ý A :H2S, ý B: BeCl2, ý D có AlCl3 là các chất có liên kết công hóa trị
Bài 50: Cho các chất : HF, NaCl, CH4, Al2O3, K2S, MgCl2. Số chất có liên kết ion là (Độ âm điện của K: 0,82; Al: 1,61; S: 2,58; Cl: 3,16 và O: 3,44; Mg: 1,31; H: 2,20; C: 2,55; F: 4,0) :
A. 3 B. 2
C. 1 D. 4
Lời giải:
Chọn đáp án: D.
Giải thích:
Các chất có liên kết ion là:
NaCl (∆X =2,23 ), K2S (∆X = 1,76), Al2O3 (∆X= 1,83) , MgCl2 (∆X = 1,85)
Bài 51: Ion nào có tổng số proton bằng 48 ?
A. NH4+
B. CO32-
C. SO42-
D. ClO3-
Lời giải:
Chọn đáp án: C
Giải thích:
Số proton của các nguyên tử N( p=7), H ( p=1), C (p = 6), O (p = 8), S (P = 16), Cl (P = 17)
NH4+ số proton = 7 + 1.4 = 11
Tương tự số proton trong CO32- = 30, SO42-= 48, ClO3- = 41.
Bài 52: Hoá trị trong hợp chất ion được gọi là
A. Điện hoá trị.
B. Cộng hoá trị.
C. Số oxi hoá.
D. Điện tích ion.
Lời giải:
Chọn đáp án: A
Bài 53: Hoàn thành nội dung sau : “Trong hợp chất cộng hoá trị, hoá trị của một nguyên tố được xác định bằng ............mà nguyên tử nguyên tố đó tạo ra được với các nguyên tố khác trong phân tử”.
A. số electron ghép đôi.
B. Số electron độc thân.
C. Số liên kết cộng hóa trị
D. Số obitan hoá trị.
Lời giải:
Chọn đáp án: C
Bài 54: Hoàn thành nội dung sau : “Số oxi hoá của một nguyên tố trong phân tử là ...(1)…của nguyên tử nguyên tố đó trong phân tử, nếu giả định rằng liên kết giữa các nguyên tử trong phân tử là ...(2)….”.
A. (1) : điện hoá trị; (2) : liên kết cộng hóa trị.
B. (1) : điện tích; (2) : liên kết ion.
C. (1) : cộng hoá trị; (2) : liên kết cộng hoá trị.
D. (1) : điện hoá trị; (2) : liên kết cho nhận.
Lời giải:
Chọn đáp án: C
Bài 55: Xét oxit của các nguyên tử thuộc chu kì 3, các oxit có liên kết ion là :
A. Na2O, MgO, Al2O3.
B. SiO2, P2O5, SO3.
C. SO3, Cl2O7, Cl2O.
D. Al2O3, SiO2, SO2.
Lời giải:
Chọn đáp án: A.
Giải thích: Liên kết ion thường được tạo thành bởi các kim loại và phi kim điển hình.
Bài 56: Hợp chất trong phân tử có liên kết ion là :
A. NH4Cl.
B. HCl.
C. NH3.
D. H2O.
Lời giải:
Chọn đáp án: A
Giải thích: Phân tử NH4Cl có liên kết ion tạo bởi ion NH4+ và Cl-
Bài 57: Công thức cấu tạo đúng của CO2 là :
A. O = C = O.
B. O = C → O.
C. O = C ← O.
D. O – C = O.
Lời giải:
Chọn đáp án: A.
Bài 58: Liên kết cộng hóa trị tồn tại do
A. các đám mây electron.
B. các electron hoá trị.
C. các cặp electron dùng chung.
D. lực hút tĩnh điện yếu giữa các nguyên tử.
Lời giải:
Chọn đáp án: C
Bài 59: Cho biết nguyên tử Clo có Z=17, cấu hình electron của ion Cl- là:
A. 1s22s22p63s23p5
B. 1s22s22p63s23p6
C. 1s22s22p63s23p4
D. 1s22s22p63s23p64s1
Lời giải:
Chọn đáp án: B
Giải thích: Theo quy tắc bát tử, Clo có xu hướng nhận thêm 1e
Bài 60: Chọn câu đúng nhất:
Độ âm điện của một nguyên tử đặc trưng cho
A. khả năng nhường electron của nguyên tử đó khi hình thành liên kết hoá học.
B. khả năng hút electron của nguyên tử đó khi hình thành liên kết hoá học.
C. khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
D. khả năng tạo thành liên kết hoá học.
Lời giải:
Chọn đáp án: B

Bài 61: Nguyên tố R là phi kim thuộc nhóm A. Hợp chất của R với hidro là RH3. Số oxi hóa của R trong oxit tương ứng với hóa trị cao nhất là
A. -3 B. -5
C. +5 D. +3
Lời giải:
Chọn đáp án: C
Giải thích: R tạo hợp chất RH3 ⇒ R thuộc nhóm VA trong bảng tuần hoàn.
Bài 62: Nguyên tố R có cấu hình electron lớp ngoài cùng là ns2np4. Công thức hợp chất của R với H và công thức oxit tương ứng với hóa trị cao nhất của R lần lượt là
A. RH2 và RO
B. RH2 và RO2
C. RH4 và RO2
D. RH2 và RO3
Lời giải:
Chọn đáp án: D
Giải thích: R có 6e lớp ngoài cùng, hóa trị cao nhất với oxi = 6, hidro = 2.
Bài 63: Cho một số hợp chất: H2S, H2SO3, H2SO4, NaHS, Na2SO3, SO3, K2S, SO2. Dãy các chất trong đó lưu huỳnh có cùng số oxi hóa là
A. H2S, H2SO3, H2SO4
B. H2SO3, H2SO4, Na2SO3, SO3
C. H2SO3, H2SO4, Na2SO3, SO2
D. H2S, NaHS, K2S
Lời giải:
Chọn đáp án: D
Giải thích: Số oxi hóa trong các chất lần lượt là:
| H2S | H2SO3 | H2SO4 | NaHS |
|---|---|---|---|
| -2 | +4 | +6 | -2 |
| Na2SO3 | SO3 | K2S | SO2 |
| +4 | +6 | -2 | +4 |
Bài 64: Cho biết nguyên tử Ca có Z=20, cấu hình electron của ion Ca2+ là:
A. 1s22s22p63s23p5
B. 1s22s22p63s23p6
C. 1s22s22p63s23p4
D. 1s22s2 2p63s23p64s2
Lời giải:
Chọn đáp án: B .
Giải thích:
Cấu hình e của Ca: 1s22s22p63s23p64s2Ca có xu hướng nhường 2e để đạt cấu hình của khí hiếm Ar.
Bài 65: Chọn câu đúng nhất trong các câu sau:
A. Liên kết cộng hoá trị không phân cực chỉ được tạo thành từ các nguyên tử giống nhau.
B. Trong liên kết cộng hoá trị, cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện nhỏ hơn.
C. Liên kết cộng hoá trị có cực được tạo thành giữa hai nguyên tử có hiệu độ âm điện lớn hơn 0,4.
D. Liên kết cộng hoá trị trong đó cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn được gọi là liên kết cộng hoá trị phân cực.
Lời giải:
Chọn đáp án: D
Bài 66: Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện. Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết ≥ 1,7 thì đó liên kết
A. ion.
B. cộng hoá trị không cực.
C. cộng hoá trị có cực.
D. kim loại.
Lời giải:
Chọn đáp án: A.
Bài 67: Nguyên tử X có cấu hình electron: 1s22s22p5 thì ion tạo ra từ nguyên tử X sẽ có cấu hình electron nào sau đây?
A. 1s22s22p4
B. 1s22s22p6
C. 1s22s22p63s23p64s24p6
D. 1s22s22p63s2
Lời giải:
Chọn đáp án: B.
Giải thích: X có xu hướng nhận thêm 1e theo quy tắc bát tử để đạt cấu hình của khí hiếm
Bài 68: Nguyên tử X (Z=7), nguyên tử Y(Z=8). Công thức phân tử của hợp chất có hoá trị cao nhất có thể là:
A. X2Y
B. X2Y3
C. XY2
D. X2Y5
Lời giải:
Chọn đáp án: D
Giải thích:
X là N (có 5e lớp ngoài cùng).
Y là Oxi (có 6e lớp ngoài cùng). Hợp chất tạo thành là N2O5
Bài 69: Cho biết nguyên tử Na, Mg, F lần lượt có số hiệu nguyên tử là 11, 12, 9. Các ion Na+, Mg2+, F- có đặc điểm chung là:
A. Có cùng số proton.
B. Có cùng notron.
C. Có cùng số electron.
D. Không có đặc điểm gì chung
Lời giải:
Chọn đáp án: C.
Giải thích: Các nguyên tử đều có xu hướng nhường hoặc nhận e để đạt được cấu hình của khí hiếm Ne.

Bài 70: Liên kết ion được tạo thành giữa
A. hai nguyên tử kim loại.
B. hai nguyên tử phi kim.
C. một nguyên tử kim loại mạnh và một nguyên tử phi kim mạnh.
D. một nguyên tử kim loại yếu và một nguyên tử phi kim yếu.
Lời giải:
Chọn đáp án: C
Bài 71: X, Y là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19. Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và liên kết trong hợp chất tạo thành từ X và Y là
A. 2s22p5, 4s1 và liên kết cộng hóa trị.
B. 2s22p3, 3s23p1 và liên kết cộng hóa trị.
C. 3s23p1, 4s1 và liên kết ion.
D. 2s22p5, 4s1 và liên kết ion.
Lời giải:
Chọn đáp án: D
Giải thích:
Cấu hình của X: 1s22s22p5
Cấu hình của Y: 1s22s22p63s23p64s1
Bài 72: Các nguyên tử liên kết với nhau để :
A. Tạo thành chất khí
B. Tạo thành mạng tinh thể
C. Tạo thành hợp chất
D. Đạt cấu hình bền của nguyên tử khí hiếm.
Lời giải:
Chọn đáp án: D
Bài 73: Nguyên tử oxi có cấu hình electron là :1s22s22p4. Sau khi tạo liên kết, nó có cấu hình là :
A. 1s22s22p2
B. 1s22s22p43s2.
C. 1s22s22p6 .
D. 1s22s22p63s1
Lời giải:
Chọn đáp án: C
Giải thích: Oxi sẽ nhận thêm 2e để đạt cấu hình của khí hiếm.
Bài 74: Ion nào sau đây có 32 electron :
A. CO32-
B. SO42-
C. NH4+
D. NO3-
Lời giải:
Chọn đáp án: A
Giải thích:
Số p = e của các nguyên tố lần lượt là: 6C, 8O, 7N, 1H, 16S
CO32- PC + PO.3 + 2= 32
Bài 75: Hầu hết các hợp chất ion
A. có nhiệt độ nóng chảy và nhiệt độ sôi cao.
B. Không tan trong nước
C. ở trạng thái nóng chảy không dẫn điện.
D. tan trong nước thành dung dịch không điện li.
Lời giải:
Chọn đáp án: A

