Các dạng bài tập Phản ứng oxi hóa, khử chọn lọc có đáp án chi tiết - Hoá học lớp 10
Các dạng bài tập Phản ứng oxi hóa, khử chọn lọc có đáp án chi tiết
Với Các dạng bài tập Phản ứng oxi hóa, khử chọn lọc có đáp án chi tiết Hoá học lớp 10 tổng hợp các dạng bài tập, trên 200 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Phản ứng oxi hóa, khử từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Tổng hợp Lý thuyết chương Phản ứng oxi hóa, khử
Lý thuyết Phản ứng hóa học - Phân loại phản ứng trong hóa học vô cơ
- Tóm tắt lý thuyết Hóa học 10 chương 4
Phương pháp giải Các dạng bài tập chương Phản ứng oxi hóa, khử
- 4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học có lời giải
- Dạng 1: Xác định loại phản ứng hóa học
- Dạng 2: Xác định chất khử, chất oxi hóa trong phản ứng hóa học
- Dạng 3: Cách xác định số oxi hóa của các nguyên tố
- Dạng 4: Phương pháp cân bằng phản ứng oxi hóa khử
- Dạng 5: Các dạng bài tập về oxi hóa - khử
- Dạng 6: Phương pháp bảo toàn electron
- Dạng 7: Kim loại tác dụng với axit
Bài tập trắc nghiệm
- 30 bài tập trắc nghiệm chương Phản ứng hóa học có đáp án
- 50 câu trắc nghiệm Phản ứng oxi hóa, khử có lời giải chi tiết (cơ bản)
- 50 câu trắc nghiệm Phản ứng oxi hóa, khử có lời giải chi tiết (nâng cao)
Phương pháp cân bằng phản ứng oxi hóa khử
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Theo trình tự 3 bước với nguyên tắc:
Tổng electron nhường = tổng electron nhận
Bước 1. Xác định sự thay đổi số oxi hóa.
Bước 2. Lập thăng bằng electron.
Bước 3. Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại.
Lưu ý:
- Ngoài phương pháp thăng bằng electron, còn có thể cân bằng phản ứng oxi hóa – khử theo phương pháp tăng – giảm số oxi hóa với nguyên tắc: tổng số oxi hóa tăng = tổng số oxi hóa giảm.
- Phản ứng oxi hóa – khử còn có thể được cân bằng theo phương pháp thăng bằng ion – electron: lúc đó vẫn đảm bảo nguyên tắc thăng bằng electron nhưng các nguyên tố phải được viết ở dạng ion đúng, như NO3-, SO42-, MnO4-, Cr2072-,...
- Nếu trong phản ứng oxi hóa – khử có nhiều nguyên tố có số oxi hóa cùng tăng (hoặc cùng giảm) mà:
+ Chúng thuộc một chất thì phải đảm bảo tỉ lệ số nguyên tử của các nguyên tố trong phân tử.
+ Chúng thuộc các chất khác nhau thì phải đảm bảo tỉ lệ số mol của các chất đó theo đề cho.
* Với hợp chất hữu cơ:
- Nếu hợp chất hữu cơ trước và sau phản ứng có một nhóm nguyên tử thay đổi và một số nhóm không đổi thì nên xác định số oxi hóa của C trong từng nhóm rồi cân bằng.
- Nếu hợp chất hữu cơ thay đổi toàn phân tử, nên cân bằng theo số oxi hóa trung bình của C.
Ví dụ minh họa
Ví dụ 1. Cân bằng phản ứng:
FeS + HNO3 → Fe(NO3)3 + N2O + H2SO4 + H2O
Hướng dẫn:
Bước 1. Xác định sự thay đổi số oxi hóa:
Fe+2 → Fe+3
S-2 → S+6
N+5 → N+1
Bước 2. Lập thăng bằng electron:
Fe+2 → Fe+3 + 1e
S-2 → S+6 + 8e
FeS → Fe+3 + S+6 + 9e
2N+5 + 8e → 2N+1
→ Có 8FeS và 9N2O.
Bước 3. Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại:
8FeS + 42HNO3 → 8Fe(NO3)3 + 9N2O + 8H2SO4 + 13H2O
Ví dụ 2. Cân bằng phản ứng trong dung dịch bazơ:
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr
Hướng dẫn:
CrO2- + 4OH- → CrO42- + 2H2O + 3e
Br2 + 2e → 2Br-
Phương trình ion:
2CrO2- + 8OH- + 3Br2 → 2CrO42- + 6Br- + 4H2O
Phương trình phản ứng phân tử:
2NaCrO2 + 3Br2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
Ví dụ 3. Cân bằng phản ứng trong dung dịch có H2O tham gia:
KMnO4 + K2SO3 + H2O → MnO2 + K2SO4
Hướng dẫn:
MnO4- + 3e + 2H2O → MnO2 + 4OH-
SO32- + H2O → SO42- + 2H+ + 2e
Phương trình ion:
2MnO4- + H2O + 3SO32- → 2MnO2 + 2OH- + 3SO42-
Phương trình phản ứng phân tử:
2KMnO4 + 3K2SO3 + H2O → 2MnO2 + 3K2SO4 + 2KOH
Ví dụ 4. Cân bằng phản ứng oxi hóa – khử sau:
C6H12O6 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + CO2 + H2O
Hướng dẫn:
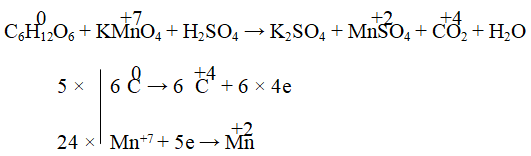
5C6H12O6 + 24KMnO4 + 36H2SO4 → 12K2SO4 + 24MnSO4 + 30CO2 + 66H2O
B. Bài tập trắc nghiệm
Câu 1. Cho phản ứng: Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
Tỉ lệ hệ số của chất khử và chất oxi hóa sau khi cân bằng là:
A. 4:3 B. 3:2 C. 3:4 D. 2:3
Lời giải:
Đáp án: B
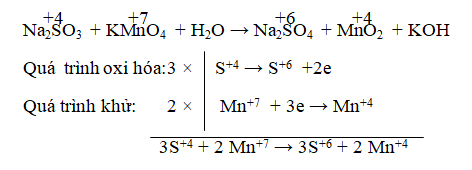
⇒ 3Na2SO3 + 2KMnO4 → 3Na2SO4 + 2MnO2
Kiểm tra hai vế: thêm 2KOH vào vế phải, thêm H2O vào vế trái.
⇒ 3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
Câu 2. Cho phản ứng: FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)2 + H2O. Hệ số cân bằng của FeSO4 và K2Cr2O7 lần lượt là:
A. 6 ; 2 B. 5; 2 C. 6; 1 D. 8; 3
Lời giải:
Đáp án:
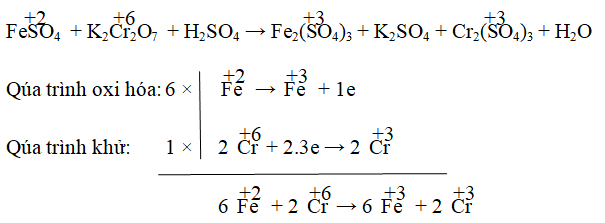
Hay 6FeSO4 + K2Cr2O7 → 3Fe2(SO4)3 + Cr2(SO4)3
Kiểm tra hai vế: thêm K2SO4 vào về phải; thêm 7H2SO4 vào vế trái → thêm 7H2O vào vế phải.
⇒ 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)2 + 7H2O
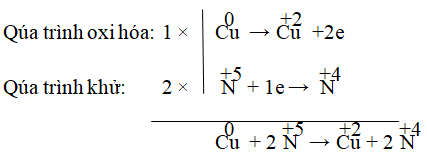
Hay Cu + 2HNO3 → Cu(NO3)2 + 2NO2
Kiểm tra hai vế: thêm 2HNO3 vào vế trái thành 4HNO3, thêm 2H2O vào vế phải.
⇒ Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Câu 3. Cân bằng phản ứng sau: Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Lời giải:
Đáp án:
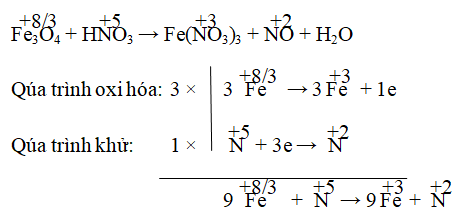
Hay 3Fe3O4 + HNO3 → 9Fe(NO3)3 + NO
Kiểm tra hai vế: thêm 28 vào HNO3 ở vế trái, thêm 14H2O ở vế phải.
⇒ 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Câu 4. Cân bằng phản ứng: As2S3 + HNO3 + H2O → H3AsO4 + NO + H2SO4
Lời giải:
Đáp án:
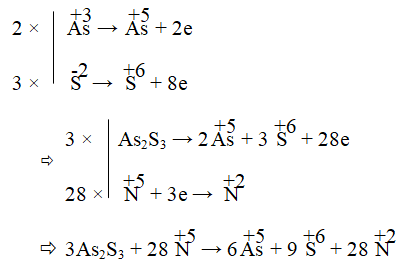
Hay 3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 28NO + 9H2SO4
Câu 5. Tính tổng hệ số cân bằng trong phản ứng sau:
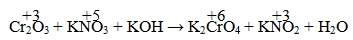
A. 15 B. 14 C. 18 D. 21
Lời giải:
Đáp án: A
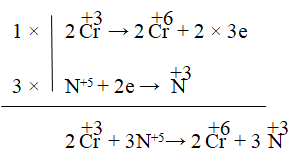
Phương trình: Cr2O3 + 3KNO3 + 4KOH → 2K2CrO4 +2H2O + 3KNO2
⇒ Tổng hệ số cân bằng là 15
Câu 6. Cân bằng phản ứng oxi hóa – khử sau:
CH3CH2OH + K2Cr2O7 + H2SO4 → CH3COOH + Cr2(SO4)3 + K2SO4 + H2O
Lời giải:
Đáp án:
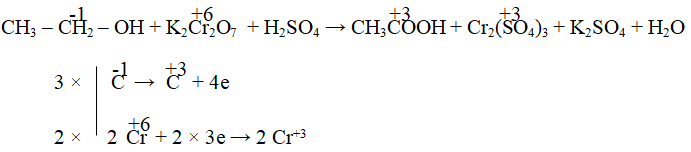
3CH3CH2OH + 2K2Cr2O7 + 8H2SO4 →3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
Câu 7. Xác định hệ số cân bằng của KMnO4 trong phản ứng sau:
SO2 + KMnO4 + H2O → K2SO4 + ...
A. 2 B. 5 C. 7 D. 10
Lời giải:
Đáp án: A
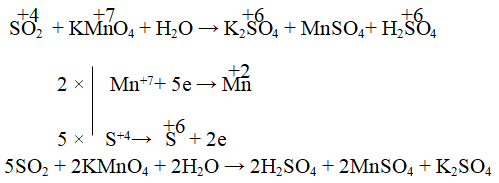
Câu 8. Cân bằng phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng e:
a) Fe2O3 + Al → Al2O3 + FenOm
b) FenOm + HNO3 → Fe(NO3)3 + NO + H2O
Lời giải:
Đáp án:
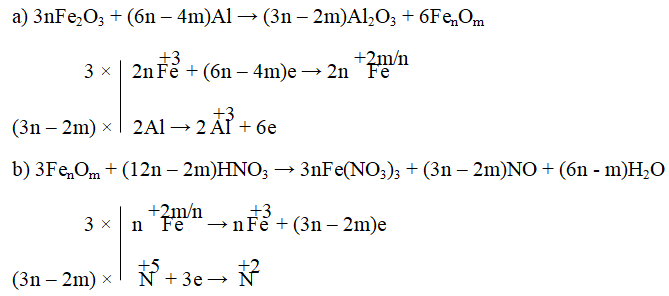
Các dạng bài tập về oxi hóa - khử
Phương pháp:
* Định luật bảo toàn electron
Trong phản ứng oxi hoá - khử, số mol electron mà chất khử cho bằng số mol electron mà chất oxi hoá nhận. ∑ne cho = ∑ne nhận
Sử dụng tính chất này để thiết lập các phương trình liên hệ, giải các bài toán theo phương pháp bảo toàn electron.
* Nguyên tắc
Viết 2 sơ đồ: sơ đồ chất khử nhường e- và sơ đồ chất oxi hoá nhận e-.
* Một số chú ý
- Chủ yếu áp dụng cho bài toán oxi hóa khử các chất vô cơ
- Có thể áp dụng bảo toàn electron cho một phương trình, nhiều phương trình hoặc toàn bộ quá trình.
- Xác định chính xác chất nhường và nhận electron. Nếu xét cho một quá trình, chỉ cần xác định trạng thái đầu và trạng thái cuối số oxi hóa của nguyên tố, thường không quan tâm đến trạng thái trung gian số oxi hóa của nguyên tố.
- Khi áp dụng PP bảo toàn electron thường sử dụng kèm các PP bảo toàn khác (bảo toàn khối lượng, bảo toàn nguyên tố).
- Khi cho KL tác dụng với dung dịch HNO3 và dung dịch sau phản ứng không chứa muối amoni: nNO3- = tổng số mol e nhường (hoặc nhận).
a/ Bài toán kim loại tác dụng với axit không có tính oxi hóa
- Công thức liên hệ giữa số mol kim loại và số mol khí H2
2. nH2 = n2 . nM1 + n2 .n-M2 +….. (với n1, n2 là số electron nhường của kim loại M1 và M2 ; nM1 , nM2 là số mol của kim loại M1, M2).
- Công thức tính khối lượng muối trong dung dịch:
Mmuối = mKL + mgốc ax (mSO42-, mX-…)
Trong đó, số mol gốc axit được cho bởi công thức:
Ngốc ax = tổng e trao đổi/ điện tích gốc axit.
+ Với H2 SO4 : mMuối = mKL + 96.nH2
+ Với HCl: mmuối =mKL + 71.nH2
+ Với HBr: mmuối =mKL + 160.nH2
Ví dụ 1: Hoà tan 7,8g hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau phản ứng khối lượng dung dịch axit tăng thêm 7,0g. Khối lượng nhôm và magie trong hỗn hợp đầu là:
A. 2,7g và 1,2g B. 5,4g và 2,4g C. 5,8g và 3,6g D. 1,2g và 2,4g
Hướng dẫn:
Áp dụng định luật bảo toàn khối lượng ta có :mH2 = 7,8-7,0 =0,8 gam
Mặt khác theo công thức 1 và theo đề ta có hệ phương trình:
(Khi tham gia phản ứng nhôm nhường 3 e, magie nhường 2 e và H2 thu về 2 e)
3.nAl + 2.nMg =2.nH2=2.0.8/2 (1)
27.nAl +24.nMg =7,8 (2)
Giải phương trình (1), (2) ta có nAl =0.2 mol và nMg = 0.1 mol
Từ đó ta tính được mAl =27.0,2 =5,4 gam và mMg =24.0,1 =2,4 gam chọn đáp án B
Ví dụ 2: Cho 15,8 gam KmnO4 tác dụng với dung dịch HCl đậm đặc. Thể tích khí clo thu được ở điều kiện tiêu chuẩn là:
A. 5,6 lít. B. 0,56 lít. C. 0,28 lít. D. 2,8 lít.
Hướng dẫn:
Ta có: Mn+7nhường 5 e (Mn+2),Cl-thu 2.e (Cl2)
Áp dụng định luật bảo toàn e ta có :
5.nKmnO4 =2.nCl2
⇒ nCl2 = 5/2 nKmnO4 =0.25 mol rArr; VCl2 =0,25 . 22,4 =0,56 lít
Ví dụ 3. Hòa tan hoàn toàn 20g hỗn hợp Mg và Fe vào dung dịch axit HCl dư thấy có 11,2 lít khí thoát ra ở đktc và dung dịch X. Cô cạn dung dịch X thì thu được bao nhiêu gam muối khan?
A. 55,5g. B. 91,0g. C. 90,0g. D. 71,0g.
Hướng dẫn:
Áp dụng công thức 2 ta có:
mmuối = m kim loại + mion tạo muối
= 20 + 71.0,5=55.5g
⇒ Chọn A
b/ Bài toán kim loại tác dụng với hỗn hợp axit có tính oxi hóa
Ví dụ 4. Hòa tan 15 gam hỗn hợp X gồm hai kim loại Mg và Al vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O. Phần trăm khối lượng của Al và Mg trong X lần lượt là:
A. 63% và 37%. B. 36% và 64%. C. 50% và 50%. D. 46% và 54%.
Hướng dẫn:
Ta có 24 nMg + 27 nAl =15 (1)
- Xét quá trình oxi hóa
Mg → Mg2++ 2e
Al → Al3++3e
⇒tổng số mol e nhường = 2nMg + 3 nAl
- Xét quá trình khử
2N+5 +2.4e → 2 N+1
S+6 + 2e → S+4
⇒tổng số mol e nhận = 2.0,4 + 0,2 = 1,4 mol
Theo định luật bảo toàn e ta có:
2nMg + 3 nAl = 1,4 (2)
Giải hệ (1) và (2) ta được nMg = 0,4 mol, nAl =0,2 mol
⇒% Al = 27.0,2/15 = 36%
⇒%Mg = 64%
⇒ Chọn B
Ví dụ 5: Một hỗn hợp X có khối lượng 18,2g gồm 2 Kim loại A (hóa trị 2) và B (hóa trị 3). Hòa tan X hoàn toàn trong dung dịch Y chứa H2SO4 và HNO3. Cho ra hỗn hợp khí Z gồm 2 khí SO2 và N2O. Xác định 2 kim loại A, B (B chỉ co thể là Al hay Fe). Biết số mol của hai kim loại bằng nhau và số mol 2 khí SO2 và N2O lần lượt là 0,1 mol mỗi khí.
A. Cu, Al B. Cu, Fe C. Zn, Al D. Zn, Fe
Hướng dẫn:
Quá trình khử hai anion tạo khí là:
4H+ + SO42- + 2e → SO2 + 2H2O
0,2 0,1 mol
10H+ + 2NO3- + 8e → N2O + 5H2O
0,8 0,1 mol
Tổng e (nhận) = 0,2 + 0,8 = 1 mol
A → A2+ + 2e
a 2a
B → B3+ + 3e
b 3b
Tổng e (cho) = 2a + 3b = 1 (1)
Vì số mol của hai kim loại bằng nhau nên: a= b (2)
Giải ( 1), (2 ) ta có a = b = 0,2 mol
Vậy 0,2A + 0,2B = 18,2 ⇒ A + B = 91 ⇒ A là Cu và B là Al.
c/ Bài toán kim loại tác dụng với axit có tính oxi hóa
Trong các phản ứng oxy hóa khử, sản phẩm tạo thành có chứa các muối mà ta thường gặp như muối sunfat SO42-(có điện tích là -2), muối nitrat NO3-, ( có điện tích là -1), muối halogen X-( có điện tích là -1), ... Thành phần của muối gồm caction kim loại (hoặc cation NH4+),và anion gốc acid. Muốn tính khối lượng muối tạo thành trong dung dịch ta tính như sau:
mmuối = mkim loại + mgốc acid
Trong đó: mgốc acid = Mgốc acid .ne (nhận)/(số điện tích gốc acid)
Ví dụ 6: Cho 6,3 g hỗn hợp Mg và Zn tác dụng hết với dung dịch HCl thấy thoát ra 3,36 lít H2 (đktc). Khối lượng muối tạo ra trong dung dịch là:
A. 15,69 g B. 16,95 g C. 19,65 g D. 19,56 g
Hướng dẫn:
Ta có: 2H++ 2e → H2
0,3 0,15 mol/
Vậy khối lượng muối trong dung dịch là:
Mmuối = mkim loại + mgốc acid = 6,3+35,5.0,3/1=16,95 g.
⇒ Chọn B
Một số lưu ý:
- Với kim loại có nhiều số oxy hóa khác nhau khi phản ứng với dung dịch axit HNO3 loãng, HNO3 đặc nóng sẽ đạt số oxi hóa cao nhất.
- Hầu hết các kim loại phản ứng được với HNO3 đặc nóng (trừ Pt, Au) và HNO3 đặc nguội (trừ Pt, Au, Fe, Al, Cr….) khi dó N+5trong HNO3 bị khử về mức oxi hóa thấp hơn trong những đơn chất khi tương ứng.
- Các kim loại tác dụng với ion trong môi trường axit H+coi như tác dụng với HNO3. Các kim loại Zn, Al tác dụng với ion trong môi trường kiềm OH-giải phóng NH3.
Ví dụ 7: Hòa tan 15g hỗn hợp X gồm 2 kim loại Mg, Al vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O. Phần tram khối lượng của Al, Mg trong X lần lượt là:
Hướng dẫn:
Gọi Mg, Al trong hỗn hợp X lần lượt là x, y (mol).


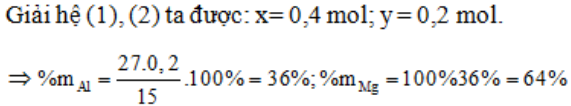
Phương pháp bảo toàn electron
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Trong phản ứng oxi hoá - khử, số mol electron mà chất khử cho bằng số mol electron mà chất oxi hoá nhận. ∑ne cho = ∑ne nhận
Sử dụng tính chất này để thiết lập các phương trình liên hệ, giải các bài toán theo phương pháp bảo toàn electron.
* Nguyên tắc
Viết 2 sơ đồ: sơ đồ chất khử nhường e- và sơ đồ chất oxi hoá nhận e-.
* Một số chú ý
- Chủ yếu áp dụng cho bài toán oxi hóa khử các chất vô cơ
- Có thể áp dụng bảo toàn electron cho một phương trình, nhiều phương trình hoặc toàn bộ quá trình.
- Xác định chính xác chất nhường và nhận electron. Nếu xét cho một quá trình, chỉ cần xác định trạng thái đầu và trạng thái cuối số oxi hóa của nguyên tố, thường không quan tâm đến trạng thái trung gian số oxi hóa của nguyên tố.
- Khi áp dụng PP bảo toàn electron thường sử dụng kèm các PP bảo toàn khác (bảo toàn khối lượng, bảo toàn nguyên tố).
- Khi cho KL tác dụng với dung dịch HNO3 và dung dịch sau phản ứng không chứa muối amoni: nNO3- = tổng số mol e nhường (hoặc nhận).
Ví dụ minh họa
Ví dụ 1. Cho 15,8 gam KMnO4 tác dụng với dung dịch HCl đậm đặc. Thể tích khí clo thu được ở điều kiện tiêu chuẩn là:
A. 5,6 lít. B. 0,56 lít. C. 0,28 lít. D. 2,8 lít.
Hướng dẫn:
Ta có: Mn+7 nhường 5 e (Mn+2),Cl- thu 2.e (Cl2)
Áp dụng định luật bảo toàn e ta có :
5.nKMnO4 = 2.nCl2
⇒ nCl2 = 5/2 nKMnO4 =0.25 mol⇒ VCl2 = 0,25 . 22,4 = 0,56 lít
Ví dụ 2. Cho hỗn hợp chứa 0,05 mol Fe và 0,03 mol Al tác dụng với 100ml dd Y gồm AgNO3 và Cu(NO3)2 cùng nồng độ mol. Sau phản ứng được chất rắn Z gồm 3 kim loại. Cho Z tác dụng với dd HCl dư thu được 0,35mol khí.Nồng độ mol mỗi muối trong Y là?
Hướng dẫn:
3 kim loại trong chất rắn Z là Ag, Cu và Fe dư ⇒ Al và 2 muối trong Y hết
Z + HCl:

B. Bài tập trắc nghiệm
Câu 1. Cho m gam bột Cu vào 400 ml dung dịch AgNO3 0,2M, sau một thời gian phản ứng thu được 7,76 gam hỗn hợp chất rắn X và dung dịch Y. Lọc tách X, rồi thêm 5,85 gam bột Zn và Y, sau khi phản ứng xảy ra hoàn toàn thu được 10,53 gam chất rắn Z. Giá trị của m là?
Lời giải:
Đáp án:
Ta có: nAgNO3 = 0,08 mol; nZn = 0,09 mol

Dựa vào sơ đồ (quan tâm đến trạng thái đầu và trạng thái cuối)
⇒ Ag+ là chất nhận e và Zn là chất nhường e
Ag+ + 1e → Ag
0,08 0,08 0,08
Zn – 2e → Zn2+
x 2x
Bảo toàn e ⇒ 2x = 0,08 ⇒ x = 0,04
nZn dư = 0,09 – 0,04 = 0,05 mol
Ta thấy: hỗn hợp rắn X và hỗn hợp rắn Z gồm 3 kim loại Ag, Cu, Zn dư với
∑mkl = 7,76 + 10,53 = 18,29g
mCu = 18,29 – (mAg + mZn dư) = 18,29 – (0,08.108 + 0,05.65) = 6,4g
Câu 2. Hòa tan hết 7,44 gam hỗn hợp Al, Mg trong thể tích vừa đủ là 500 ml dung dịch HNO3 loãng thu được dung dịch A và 3,136 lít (đktc) hỗn hợp hai khí đẳng mol có khối lượng 5,18 gam, trong đó có một khí bị hóa nâu trong không khí. Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp.
Lời giải:
Đáp án:
nhh = 3,136/22,4 = 0,14; (M- khí ) = 5,18/0,14 = 37
NO (M = 30) → Khí 2: N2O (M = 44)
nNO = nNO2 = 0,14/2 = 0,07 mol
Al – 3e → Al3+
x mol
Mg – 2e → Mg2+
y mol
N+5 + 3e → N+2 (NO)
3a a
2N+5 + 8e → 2N+1 (N2O)
8a a
Theo định luật bảo toàn e ⇒ 3x + 2y = 3a + 8a = 0,77
Lại có : 27x + 24y = 7,44
→ x = 0,2; y = 0,085
%mMg = 27,42%; %mAl = 72,85%
Câu 3. Hòa tan 19,2 gam kim loại M trong H2SO4 đặc dư thu được khí SO2. Cho khí này hấp thụ hoàn toàn trong 1 lít dung dịch NaOH 0,6M, sau phản ứng đem cô cạn dung dịch thu được 37,8 gam chất rắn. Xác định M.
Lời giải:
Đáp án:
nNaOH = 0,6 mol
Nếu chất rắn là NaHSO3 thì: nNaHSO3 = 0,3635 mol
Nếu chất rắn là Na2SO3 thì: nNa2SO3 = 0,3 mol
Nhận thấy: nNaOH = 2nNa2SO3 nên phản ứng giữa SO2 với NaOH là:
SO2 + 2NaOH → Na2SO3 + H2O
0,3 0,6 0,3
Ta có: M – ne → Mn+
S+6 + 2e → S+4 (SO2)
0,6 0,3
Áp dụng định luật bảo toàn e ta có:
nM = 0,6/n → M = 19,2/(0,6/n) = 32n
Chọn n = 2 → M = 64 (Cu)
Câu 4. Cho 19,2g Cu tác dụng hết với dung dịch HNO3. Tất cả lượng khí NO sinh ra đem oxi hóa thành NO2 rồi sục vào nước cùng với dòng khí oxi để chuyển hết thành HNO3. Tính thể tích Oxi (đktc) đã tham gia vào quá trình trên.
Lời giải:
Đáp án:
Phương pháp bảo toàn e
Cu – 2e → Cu+2
0,3 0,6
O2 + 4e → 2O-2
x 4x
→ 4x = 0,6 → x = 0,15
→ VO2 = 0,15 × 22,4 = 3,36l
Câu 5. Cho a gam hỗn hợp A gồm FeO, CuO, Fe3O4, (có số mol bằng nhau) tác dụng vừa đủ với 250ml dung dịch HNO3 thu được dung dịch B và 3,136 lít hỗn hợp NO2 và NO có tỉ khối 90 với hidro là 20,143. Tính a và CM của HNO3.
Lời giải:
Đáp án:
Số mol e cho = số mol e nhận ⇒ 0,09 + (0,05 × 3) = 0,24 (mol)
→ Số mol Fe+2 = 0,24 mặt khác nFeO = nFe3O4 = 0,12 (mol)
a = 0,12(80 + 72 + 232) = 46,08
nHNO3 = nNO + nNO2 + 3nFe + 2nCu = 0,14 + 3(0,12 × 4) + 2 × 0,12 = 1,82 (mol)
Vậy CMHNO3 = 1,82 : 0,25 = 7,28M
Câu 6. Để m g phoi bào sắt (A) ngoài không khí sau một thời gian biến thành hỗn hợp (B) có khối lượng 30g gồm Fe và các oxit FeO, Fe3O4, Fe2O3. Cho B tác dụng hoàn toàn axit nitric thấy giải phóng ra 5,6 lít khí NO duy nhất (đktc). Tính m?
Lời giải:
Đáp án:
Fe + 1/2 O2 → FeO (1)
3Fe + 2 O2 → Fe3O4 (2)
2Fe + 3/2 O2 → Fe2O3 (3)
Fe + 4 HNO3 → Fe(NO3)3 + NO↑ + 2H2O (4)
3FeO + 10 HNO3 → 3Fe(NO3)3 + NO↑ + 5H2O (5)
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑ + 14H2O (6)
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O (7)
7 phương trình phản ứng trên được biểu diễn bằng các quá trình oxi hóa khử sau:
Fe - 3e → Fe+3
O (O2) + 2e → O-2
N+5 + 3e → N+2
Vậy nNO = 0,25 (theo giả thiết), số mol Fe là x và số mol nguyên tử oxi là y
Theo quy tắc bảo toàn e ta có: 3x = 2y + 0,75 (I)
Mặt khác B chỉ gồm Fe và O nên ta còn có 56x + 16y = 30 (II)
Giải hệ ta được: x = 0,45 và m = 0,45 × 56 = 25,2g

