Xác định tên nguyên tố dựa vào đặc điểm chu kì, nhóm - Hoá học lớp 10
Xác định tên nguyên tố dựa vào đặc điểm chu kì, nhóm
Với Xác định tên nguyên tố dựa vào đặc điểm chu kì, nhóm Hoá học lớp 10 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Xác định tên nguyên tố dựa vào đặc điểm chu kì, nhóm từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Lý thuyết và Phương pháp giải
Cần nhớ:
- Tổng số hiệu nguyên tử 4 < ZT < 32 thì A, B sẽ thuộc các chu kỳ nhỏ hay ZA - ZB = 8.
- Nếu ZT > 32 thì ta phải xét cả 3 trường hợp:
+ A là H.
+ A và B cách nhau 8 đơn vị.
+ A và B cách nhau 18 đơn vị.
Do hai nguyên tố thuộc cùng một nhóm nên tính chất tương tự nhau, vì vậy với những bài toán liên quan đến hỗn hợp phản ứng ta thay hỗn hợp bằng một công thức chung, sau đó tìm M− rồi chọn hau nguyên tố thuộc hau chu kì của cùng nhóm sao cho:
MA < M− < MB (MA < MB)
Ví dụ minh họa
Ví dụ 1: A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. Hãy viết cấu hình electron của A, B và của các ion mà A và B có thể tạo thành.
Hướng dẫn:
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; D = 25.
Cấu hình electron:
A : 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.

Ví dụ 2. Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp nhau và thuộc nhóm IIIA, tác dụng với HCl dư thì thu được 6,72 lít khí hidro (đktc). Dựa vào bảng tuần hoàn cho biết tên hai kim loại đó.
Hướng dẫn:
Kí hiệu hai kim loại nhóm IIIA là M, nguyên tử khối trung bình là M−
Phương trình hóa học có dạng: 2M + HCl → 2MCl2 + 3H2
nH2 = 6,72/22,4 = 0,3 (mol)
nM = 2/3 nH2 = 0,2 (mol)
theo đầu bài: M− .0,2 = 8,8 → M− = 44
hai kim loại thuộc hai chu kì liên tiếp, một kim loại có nguyên tử khối nhỏ hơn 44 và một kim loại có nguyên tử khối lơn hơn 44.
Dựa vào bảng tuần hoàn, hai kim loại đó là:
Al (M = 27 < 44) và Ga (M = 69,72 > 44).
Ví dụ 3: Hòa tan 20,2 gam hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp thuộc nhóm IA trong bảng tuần hoàn tác dụng với nước thu được 6,72 lít khí (đktc) và dung dịch A. Xác định tên và khối lượng hai kim loại.
Hướng dẫn:

Gọi R là kí hiệu chung của hai kim loại nhóm IA, R cũng là nguyên tử khối trung bình của hai kim loại.
2R + 2H2O → 2ROH + H2 ↑
0,6 0,3
nH2 = 6,72/22,4 = 0,3 (mol)
R = 20,2/0,6 = 33,67
Vì hai kim loại thuộc hai chu kì liên tiếp nên một kim loại phải có nguyên tử khối nhỏ hơn 33,67 và kim loại còn lại có nguyên tử khối lớn hơn 33,67.
Vậy ta có: R1 = 23 (Na) < R = 33,67 < R2 = 39 (K)
Dựa vào bảng tuần hoàn hai kim loại đó là Na, K
2Na + 2H2O → 2NaOH + H2 ↑
x x/2
2K + 2H2O → 2KOH + H2 ↑
y y/2
Ta có hệ phương trình:
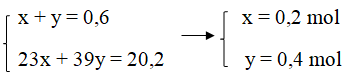
mNa = 23.0,2 = 4,6 (gam)
mK = 39.0,4 = 15,6 (gam)

