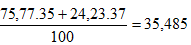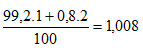Các dạng bài tập Nguyên tử chọn lọc có đáp án chi tiết - Hoá học lớp 10
Các dạng bài tập Nguyên tử chọn lọc có đáp án chi tiết
Với Các dạng bài tập Nguyên tử chọn lọc có đáp án chi tiết Hoá học lớp 10 tổng hợp các dạng bài tập, trên 300 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nguyên tử từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Tổng hợp Lý thuyết chương Nguyên tử
Lý thuyết Luyện tập về: thành phần cấu tạo nguyên tử. Khối lượng của nguyên tử. Obitan nguyên tử
Lý thuyết Đồng vị. Nguyên tử khối và nguyên tử khối trung bình
Lý thuyết Sự chuyển động của electron trong nguyên tử. Obitan nguyên tử
Lý thuyết Năng lượng của các electron trong nguyên tử. Cấu hình electron nguyên tử
Phương pháp giải Các dạng bài tập chương Nguyên tử
- 4 dạng bài tập Nguyên tử Hóa 10 trong đề thi Đại học có lời giải
- Dạng 1: Xác định nguyên tố dựa vào số hạt
- Dạng 2: Xác định thành phần nguyên tử
- Dạng 3: Cách viết cấu hình electron
- Dạng 4: Bài tập lớp và phân lớp
- Dạng 5: Tính phần trăm đồng vị, tính nguyên tử khối trung bình
- Dạng 6: Trắc nghiệm lý thuyết về nguyên tử
- Dạng 7: Tính kích thước, khối lượng, khối lượng riêng, bán kính nguyên tử
Bài tập trắc nghiệm
- 40 bài tập trắc nghiệm chương Nguyên tử có đáp án
- 100 câu trắc nghiệm Nguyên tử có lời giải chi tiết (cơ bản)
- 100 câu trắc nghiệm Nguyên tử có lời giải chi tiết (nâng cao)
Bài tập lớp và phân lớp
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Cần nắm vững các kiến thức về lớp và phân lớp:
+ Các electron trên cùng một lớp có mức năng lượng gần bằng nhau.

+ Mỗi lớp electron phân chia thành nhiều phân lớp.
+ Các electron trên cùng một phân lớp có mức năng lượng bằng nhau. Số phân lớp trong một lớp = số thứ tự của lớp đó.
+ Số obitan có trong một phân lớp
| Phân lớp | s | p | d | f |
| Số obitan | 1 | 3 | 5 | 7 |
Lưu ý: Cách tính nhanh số obitan: trong lớp n sẽ có n2 obitan
Ví dụ minh họa
Ví dụ 1. Hãy cho biết tên của các lớp electron ứng với các giá trị của n = 1, 2, 3, 4 và cho biết các lớp đó lần lượt có bao nhiêu phân tử lớp electron.
Hướng dẫn:
Ta có:
n: 1 2 3 4
Tên lớp: K L M N
Lớp K có 1 phân lớp 1s
Lớp L có 2 phân lớp 2s, 2p
Lớp M có 3 phân lớp 3s, 3p, 3d
Lớp N có 4 phân lớp 4s, 4p, 4d, 4f
Ví dụ 2. Hãy cho biết số phân lớp, số obitan có trong lớp N và M.
Hướng dẫn:
- Lớp N có:
+ 4 phân lớp 4s, 4p, 4d, 4f
+ 16 obitan: 1 obitan 4s, 3 obitan 4p, 5 obitan 4d, 7 obitan 4f
- Lớp M có:
+ 3 phân lớp: 3s, 3p, 3d
+ 9 obitan: 1 obitan 3s, 3 obitan 3p, 5 obitan 3d
B. Bài tập trắc nghiệm
Câu 1. Lớp electron thứ 3 có bao nhiêu phân lớp:
A. 1 B. 2 C. 3 D. 4
Lời giải:
Đáp án: C
Lớp thứ 3 có 3 phân lớp 3s, 3p, 3d
Câu 2. Chọn câu phát biểu đúng:
A. Số phân lớp electron có trong lớp N là 4
B. Số phân lớp electron có trong lớp M là 4
C. Số obitan có trong lớp N là 9
D. Số obitan có trong lớp M là 8
Lời giải:
Đáp án: A
Lớp N là lớp thứ 4 nên có 4 phân lớp
Số obitan trong lớp N ( n = 4) là 42 = 16 obitan, gồm 1 obitan 4s, 3 obitan 4p, 5 obitan 4d và 7 obitan 4f.
Câu 3. Chọn phát biểu đúng khi nói về các obitan trong một phân lớp e
A. Có cùng sự định hướng không gian
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Lời giải:
Đáp án: B
Câu 4. Lớp M có bao nhiêu obitan?
A. 9 B. 6 C. 12 D. 16
Lời giải:
Đáp án: A
Câu 5. Lớp e thứ 4 có tên là gì
A. K B. L C. M D. N
Lời giải:
Đáp án: D
Câu 6. Lớp L có bao nhiêu obitan?
A. 2 B. 3 C. 4 D. 6
Lời giải:
Đáp án: C
Lớp L có 2 phân lớp 2s, 2p nên có 4obitan (22= 4) gồm: 1 obitan phân lớp 2s và 3 obitan phân lớp 2p.
Câu 7. Chọn phát biểu đúng:
A. Lớp K là lớp xa hạt nhân nhất
B. Các electron trong cùng một lớp có mức năng lượng bằng nhau
C. Các electron trên cùng phân lớp có mức năng lượng bằng nhau.
D. Lớp N có 4 obitan
Lời giải:
Đáp án: C
A. Lớp K là lớp gần hạt nhân nhất
B. Các electron trong cùng một lớp có mức năng lượng gần bằng nhau
D. Lớp N có 42= 16 obitan
Câu 8. Chọn phát biểu sai:
A. Lớp M có 9 phân lớp
B. Lớp L có 4 obitan
C. Phân lớp p có 3 obitan
D. Năng lượng của electron trên lớp K là thấp nhất.
Lời giải:
Đáp án: A
Lớp M có 3 phân lớp và 32= 9 obitan.
Lưu ý: phân biệt cách tính số phân lớp và số obitan.
Tính phần trăm đồng vị, tính nguyên tử khối trung bình
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Áp dụng công thức tính nguyên tử khối trung bình:
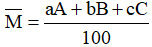
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
- Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Cách 2: phương pháp giải nhanh sử dụng đường chéo để làm bài
Ví dụ minh họa
Ví dụ 1: Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về:
A. số electron B. số notron C. số proton D. số obitan
Hướng dẫn:
⇒ Chọn B.
Nhắc lại: Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số notron, do đó số khối A khác nhau.
Ví dụ 2: Trong dãy kí hiệu các nguyên tử sau: .
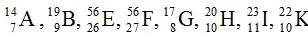
Các kí hiệu nào cùng chỉ cùng 1 nguyên tố hoá học?
A. A, G và B B. H và K C. H, I và K D. E và F
Hướng dẫn:
H và K cùng 1 nguyên tố hóa học do có cùng số p là 10
⇒ Chọn B.
Ví dụ 3: Nguyên tố Cacbon có 2 đồng vị bền: 612C chiếm 98,89% và 613C chiếm 1,11%. Nguyên tử khối trung bình của C là bao nhiêu?
Hướng dẫn:
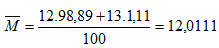
Vậy NTK trung bình của C là 12,0111
Ví dụ 4: Đồng có 2 đồng vị là 2963Cu và 2965Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm số nguyên tử của mỗi đồng vị.
Hướng dẫn:
Đặt thành phần phần trăm của 2963Cu và 2965Cu lần lượt là x và 1-x (%)
M− = 63.x +65.(1-x) = 63.54
Giải PT ⇒ x= 0,73 (73%)
% 2963Cu = 73%; và % 2965Cu = 27%
Ví dụ 5: Trong tự nhiên, X có hai đồng vị 1735X và 1737X, chiếm lần lượt 75,77% và 24,23% số nguyên tử X. Y có hai đông vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y.
a) Trong tự nhiên có bao nhiêu loại phân tử XY?
A. 2 B. 4 C. 5 D. 6
b) Phân tử khối trung bình của XY là
A. 36,0. B. 36,5. C. 37,5. D. 37,0.
Hướng dẫn:
a) Các loại phân tử XY là : 35X – 1Y, 35X – 2Y, 37X – 1Y, 37X – 2Y
b) Nguyên tử khối trung bình của X :
Nguyên tử khối trung bình Y là:
Phân tử khối trung bình của XY: 35,485 + 1,008 =36,493 ≈ 36,5.
B. Bài tập trắc nghiệm
Câu 1. Nguyên tố hóa học bao gồm các nguyên tử:
A. Có cùng số khối A. B. Có cùng số proton.
C. Có cùng số nơtron. D. Có cùng số proton và số nơtron.
Lời giải:
Đáp án: B
Nguyên tố hóa học bao gồm các nguyên tử có cùng số proton khắc số notron ( hay khác số khối)
Câu 2. Trong dãy kí hiệu các nguyên tử sau, dãy nào chỉ cùng một nguyên tố hóa học:
A. 6A14 ; 7B15 B. 8C16; 8D17; 8E18 C. 26G56; 27F56 D. 10H20 ; 11I22
Lời giải:
Đáp án: B
Câu 3. Cho ba nguyên tử có kí hiệu là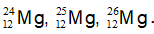
A. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14.
B. Đây là 3 đồng vị.
C. Ba nguyên tử trên đều thuộc nguyên tố Mg.
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Lời giải:
Đáp án: A
Kí hiệu của nguyên tử có dạng với Z là số hiệu nguyên tử, A là số khối
Nhận thấy 3 nguyên tử đều có cùng số Z, khác số khối → 3 nguyên tử là đồng vị của nguyên tố Mg → B, C đúng
Luôn có Z = số p = số e = 12
Câu 4. Nguyên tố clo có hai đồng vị bền 1735Cl chiếm 75,77% và 1737Cl chiếm 24,23%. Tính nguyên tử khối trung của clo?
A. 35 B. 35,5 C. 36 D. 37
Lời giải:
Đáp án: B
Nguyên tử khối trung bình của clo là:
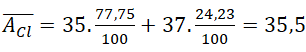
Câu 5. Có 3 nguyên tử: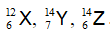
A. X, Y B. Y, Z C. X, Z D. X, Y, Z
Lời giải:
Đáp án: C
Đồng vị là những nguyên tử có cùng số proton ( số hiệu nguyên tử) khác nhau số khối
Thấy X, Z có cùng số proton là 6 , khác nhau số khối → X và Z là đồng vị của nguyên tố Cacbon.
Câu 6. Nguyên tử khối trung bình của đồng là 63,54. Trong tự nhiên, đồng có hai đồng vị 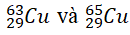
A. 28% B. 73% C 42% D. 37%
Lời giải:
Đáp án: B
Gọi x là % số nguyên tử của 2963Cu ⇒ 100 – x là % của 2965Cu
Ta có 63,54 = (63x + 65(100 - x))/100 ⇒ x = 73
Vậy 2963Cu chiếm 73%
Câu 7. Trong tự nhiên có hai đồng vị bền: 1737Cl chiếm 24,23% tổng số nguyên tử, còn lại là 1735Cl. Thành phần % theo khối lượng của 1737Cl trong HClO4 là:
A. 8,92% B. 8,43% C. 8,56% D. 8,79%
Lời giải:
Đáp án: A

Câu 8. Nguyên tố cacbon có hai đồng vị bền: 12Cchiếm 98,89% và 13C chiếm 1,11%. Nguyên tử khối trung bình của nguyên tố cacbon là
A. 12,5245 B. 12,0111 C. 12,0219 D. 12,0525
Lời giải:
Đáp án: B
Mtb = 98.89% x 12 + 1.11% x 13 = 12,0111
Câu 9. Trong tự nhiên Oxi có 3 đồng vị 16O(x1%) , 17O(x2%) , 18O(4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O và 17O lần lượt là
A. 35% & 61% B. 90% & 6% C. 80% & 16% D. 25% & 71%
Lời giải:
Đáp án: B
Luôn có x1 + x2 + 4 = 100
Nguyên tử khối trung bình của O là 16.14 = (16x1 + 17x2 + 18.4)/100
Ta có hệ 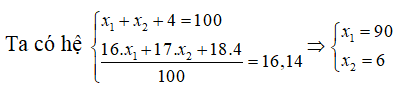
Câu 10. Một nguyên tố X gồm hai đồng vị là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Xác định nguyên tử khối trung bình của X?
A. 13 B. 19 C. 12 D. 16
Lời giải:
Đáp án: A
Các hạt trong đồng vị X1 bằng nhau nên: P = E = N = 18/3 = 6
⇒ Số khối của đồng vị X1 là: P + N= 12
⇒ Số khối của đồng vị X2 là: 20 – 6 = 14
Trắc nghiệm lý thuyết về nguyên tử
Câu 1. Đặc điểm của electron là
A. Mang điện tích dương và có khối lượng
B. Mang điện tích âm và có khối lượng.
C. Không mang điện và có khối lượng.
D. Mang điện tích âm và không có khối lượng.
Lời giải:
Đáp án: B
Câu 2. Nhận định nào sau đây không đúng
A. Tất cả các hạt nhân nguyên tử đều chứa proton và notron
B. Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện
C. Vỏ electron mang điện tích âm và chuyển động xung quanh hạt nhân
D. Khối lượng nguyên tử tập trung ở hạt nhân
Lời giải:
Đáp án: A
Hạt nhân của của nguyên tử Hidro không chứa notron, chỉ chứa proton → A sai
Câu 3. Phát biểu nào dưới đây không đúng?
A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, nơtron và electron.
B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và nơtron.
C. Vỏ nguyên tử được cấu thành bởi các hạt electron.
D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Lời giải:
Đáp án: D
Nguyên tử có cấu tạo rỗng.
Câu 4. Cho các phát biểu sau:
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và notron.
(2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3). Trong nguyên tử số electron bằng số proton.
(4). Trong hạt nhân nguyên tử hạt mang điện là proton và electron.
(5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1 B. 2 C. 3 D. 4
Lời giải:
Đáp án: B
(1) sai vì như Hiđro không có notron.
(2) sai vì khối lượng nguyên tử tập trung ở phần hạt nhân nguyên tử.
(3) đúng.
(4) sai vì hạt nhân không có electron.
(5) đúng.! ⇒ có 2 phát biểu đúng.
Câu 5. Có các phát biểu sau
(1) Trong một nguyên tử luôn luôn có số proton bằng số electron bằng số đơn vị điện tích hạt nhân.
(2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối.
(3) Số khối A là khối lượng tuyệt đối của nguyên tử.
(4) Số proton bằng số đơn vị điện tích hạt nhân.
(5) Đồng vị là các nguyên tố có cùng số proton nhưng khác nhau về số nơtron.
Sô phát biểu không đúng là
A. 1 B. 2 C. 3 D. 4
Lời giải:
Đáp án: C
Tổng số proton và số notron trong một hạt nhân được gọi là số khối → (2) sai
Số khối A là khối lượng tương đối của nguyên tử, khối lượng tuyệt đối là tổng khối lượng của proton, notron và electron → (3) sai
Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số nơtron → (5) sai
Câu 6. Cho các phát biểu sau, phát biểu nào đúng về đồng vị?
A. Những phân tử có cùng số hạt proton nhưng khác nhau về số hạt nơtron là đồng vị của nhau.
B. Những nguyên tử có cùng số hạt nơtron nhưng khác nhau về số hạt nơtron là đồng vị của nhau.
C. Những chất có cùng số hạt proton nhưng khác nhau về số hạt nơtron là đồng vị của nhau.
D. Những nguyên tử có cùng số hạt proton nhưng khác nhau về số hạt nơtron là đồng vị của nhau.
Lời giải:
Đáp án: D
Câu 7. Chọn phương án sai trong các phương án sau:
A. Trong nguyên tử các electron được sắp xếp theo mức năng lượng từ thấp đến cao.
B. Trong một ô lượng tử có tối đa 2 electron có chiều tự quay cùng chiều.
C. Các electron được sắp xếp vào các ô lượng tử sao cho số electron độc thân là cực đại.
D. Trong một ố lượng tử có tối đa 2 electron có chiều tự quay ngược nhau.
Lời giải:
Đáp án: B
Câu 8. Chọn câu phát biểu sai:
A. Số khối bằng tổng số hạt p và n.
B. Tổng số p và số e được gọi là số khối.
C. Trong 1 nguyên tử số p = số e = số điện tích hạt nhân .
D. Số p bằng số e.
Lời giải:
Đáp án: B