Bài tập về Halogen trong đề thi đại học có đáp án - Hoá học lớp 10
Bài tập về Halogen trong đề thi đại học có đáp án
Với Bài tập về Halogen trong đề thi đại học có đáp án Hoá học lớp 10 tổng hợp 23 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Halogen từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Câu 1 (ĐHB 2012): Cho m gam bột sắt vào dung dịch hỗn hợp gồm 0,15 mol CuSO4 và 0,2 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,725m gam hỗn hợp kim loại. Giá trị của m là
A. 16,0. B. 18,0. C. 16,8. D. 11
Lời giải:
Đáp án A.
(HD : Kết quả sau phản ứng thu được hỗn hợp kim loại ⇒ Fe dư
Fe + 2H+ → Fe2++ H2
Fe + Cu2+ → Fe2++ Cu
Có: nFe2+ = 0,5nH+ + nCu2+ = 0,25 mol
Bảo toàn khối lượng: mFe + mCu2+ + mH+ = mhh KL + mH2 + mFe2+
⇒ m + 64.0,15 + 0,2 = 0,725m + 2.0,1 + 56.0,25
⇒ m = 16g)
Câu 2 (ĐHB 2010): Phương pháp để loại bỏ tạp chất HCl có lẫn trong khí H2S là: Cho hỗn hợp khí lội từ từ qua một lượng dư dung dịch
A. Pb(NO3)2. B. NaHS. C. AgNO3. D. NaOH.
Lời giải:
Đáp án B.
Câu 3 (CĐ 2007): Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
A. 24,24%. B. 11,79%. C. 28,21%. D. 15,76%.
Lời giải:
Đáp án B.
(HD: Fe+2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b ; mddHCl = 36,5/20% .2.(a + b) = 365(a + b)
mFeCl2 = 127a; mMgCl2 = 95b, mH2 = 2(a + b)
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
C%FeCl2 = 127a / (419a +387b) = 15,76
Giải PT ⇒ a = b
⇒ C%MgCl2 = 95/(419+387) = 11,79%)
Câu 4 (CĐ 2007): Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol (hoặc mol/l) của HCl trong dung dịch đã dùng là
A. 0,75M. B. 1M. C. 0,25M. D. 0,5M.
Lời giải:
Đáp án D.
(HD: Gọi số mol HCl là x mol
Giả sử KOH hết ⇒ mKCl = 74,5 . 0,1 = 7.45(g) > 6,525 ⇒KOH dư ,HCl hết.
ta có : (0,1 - x).56 + x.(39 + 35,5) = 6,525 ⇒ x = 0,05 Mol ⇒CM = 0,5M)
Câu 5 (CĐ 2009): Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị hai không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Kim loại M
A. Mg. B. Ca. C. Be. D. Cu.
Lời giải:
Đáp án A.
(HD: mrắn sau − mM = mCl2 + mO2 ⇒ 71nCl2 + 32nO2 = 23 − 7,2 = 15,8 g (1)
⇒nkhí = nCl2 +nO2 = 0,25 mol (2) Giải hệ (1) và (2) ⇒nCl2 = 0,2; nO2 = 0,05 mol
Gọi hóa trị của M là x
⇒ Bảo toàn e: x × nM = 2nCl2 + 4nO2 ⇒ x × 7,2M = 2×0,2+4×0,05 ⇒ M = 12x
⇒x = 2 thỏa mãn ⇒ M = 24 g (Mg)).

Câu 6:(ĐHB 2009): Khi hoà tan hoàn toàn 0,02 mol Au bằng nước cường toan thì số mol HCl phản ứng và số mol NO (sản phẩm khử duy nhất) tạo thành lần lượt là
A. 0,03 và 0,02. B. 0,06 và 0,01. C. 0,03 và 0,01. D. 0,06 và 0,02.
Lời giải:
Đáp án B.
(HD: Au + 3HCl + HNO3 → AuCl3 + NO + 2H2O
0,02
nNO = nAu = 0,02 mol , nHCl =3. nAu = 0,06 mol)
Câu 7: (ĐH B – 2008) Dãy các nguyên tố sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải là
A. N, P, F, O. B. N, P, O, F. C. P, N, O, F. D. P, N, F, O.
Lời giải:
Đáp án C.
Câu 8: (B-2013): Trong các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu
(c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5, +7
(e) Tính khử của các halogenua tăng dần theo thứ tự F-, Cl-, Br-, I-.
Trong số các phát biểu trên, số phát biểu đúng là
A. 2 B. 3 C. 4 D. 5
Lời giải:
Đáp án B ( a, b, c, e)
Câu 9: (ĐH B – 2009) Cho các phản ứng sau
4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 3. B. 1. C. 4. D. 2.
Lời giải:
Đáp án D (Pt 1,3)
Câu 10: (ĐH A – 2008) Cho các phản ứng sau
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
2HCl + Fe → FeCl2 + H2.
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
6HCl + 2Al → 2AlCl3 + 3H2.
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
A. 4. B. 2. C. 3. D. 1.
Lời giải:
Đáp án B (Pt 2, 4)
Câu 11: (ĐH B – 2008) Cho dãy các chất và ion: Cl2, F2, SO2, Na+, Ca2+, Fe2+, Al3+, Mn2+, S2-, Cl-. Số chất và ion trong dãy đều có tính oxi hoá và tính khử là
A. 3. B. 4. C. 5. D. 6.
Lời giải:
Đáp án B (Cl2, SO2, Fe2+, Mn2+)
Câu 12: (ĐH A – 2009) Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là
A. KMnO4. B. CaOCl2. C. K2Cr2O7. D. MnO2.
Lời giải:
Đáp án C
Câu 13: (ĐH B – 2009) Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
A. 52,8%. B. 58,2%. C. 47,2%. D. 41,8%.
Lời giải:
(HD: TH 1: Cả hai muối NaX và NaY đều cho kết tủa khi pư với AgNO3
NaZ + AgNO3 → NaNO3 + AgZ↓
a_______________________a
Ap dụng pp tăng giảm khối lượng a = (8,61 - 6,03 )/ (108-23)
→ a = 0,03 → MNaZ= 6,03/0,03 → Z = 178
X và Y là I(127) và At(210), nhưng At không có tự nhiên nên TH này loại
TH 2: Chỉ có 1 muối tạo kết tủa nghĩa là hai muối này là NaF và NaCl
nAgCl = 8,61/143,5 = 0,06 mol
NaCl + AgNO3 → NaNO3 + AgCl↓
0,06____________________0,06
mY = mNaCl = 0,06.58,5 = 3,51g
mX = mNaF = 6,03 - 3,51 = 2,52g
%NaF = 2,52/6,03 .100% = 41,8% )
Đáp án D

Câu 14: (CĐ A – 2009) Trong các chất: FeCl2, FeCl3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3. Số chất có cả tính oxi hoá và tính khử là
A. 3. B. 2. C. 5. D. 4.
Lời giải:
Đáp án A (FeCl2, Fe(NO3)2, FeSO4).
Câu 15: Phản ứng giữa hydro và chất nào sau đây thuận nghịch
A. Flo. B. Clo. C. Iot. D. Brom
Lời giải:
Đáp án C
Câu 16: (ĐH A – 2007) Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. Điện phân dung dịch NaCl có màng ngăn.
B. Điện phân nóng chảy NaCl.
C. Cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
D. Cho dd HCl đặc tác dụng với MnO2, đun nóng.
Lời giải:
Đáp án D
Câu 17: (ĐH B – 2007) Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dung dịch KOH ở 100oC. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là (cho Cl = 35,5; K = 39)
A. 0,48M. B. 0,24M. C. 0,4M. D. 0,2M.
Lời giải:
(HD: nCl2 = 0,6 mol, nKCl = 0,5 mol.
Phản ứng với KOH ở 100 độ C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O.
0,6 mol 0,5 mol
Từ PT ⇒ Cl2 dư nên số mol KOH tính theo số mol KCl
⇒ nKOH = 0,6 mol ⇒ CMKOH= 0,6/2,5 = 0,24 M
Đáp án B
Câu 18: (ĐH B – 2009) Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 28,7. B. 68,2. C. 57,4. D. 10,8.
Lời giải:
(HD: Gọi số mol của FeCl2 là x
→ 127x + 58,5 × 2x = 24,4 ⇒ x = 0,1
PTHH: FeCl2 + 2AgNO3 → 2AgCl + Fe(NO3)2
0,1 mol
NaCl + AgNO3 → AgCl + NaNO3
0,2 mol
Fe(NO3)2 + AgNO3 → Fe(NO3)3+ Ag
0,1 mol
m = mAgCl + mAg = (0,2 + 0,2) × 143,5 + 108 × 0,1 = 68,2 (g) )
Đáp án B
Câu 19: (ĐH B – 2007) Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA (phân nhóm chính nhóm II) tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là (cho Be = 9, Mg = 24, Ca = 40, Sr = 87, Ba = 137)
A. Ca và Sr. B. Sr và Ba. C. Mg và Ca. D. Be và Mg.
Lời giải:
(HD: Kim loại nhóm IIA, có mức oxi hóa = +2 trong hợp chất.
nH2 = 0,03 mol
Gọi X là kí hiệu chung của 2 kim loại
X + 2HCl → XCl2 + H2O
⇒ M = 1,67/0,03 = 55,67
MCa = 40 < 55,67 < MSr = 88)
Đáp án A
Câu 20: (CĐ A – 2009) Chất dùng để làm khô khí Cl2 ẩm là
A. dung dịch H2SO4 đậm đặc . B. Na2SO3khan.
C. dung dịch NaOH đặc D. CaO .
Lời giải:
Đáp án A

Câu 21: (ĐH A – 2009) Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là
A. Mg(HCO3)2, HCOONa, CuO. B. AgNO3, (NH4)2CO3, CuS.
C. KNO3, CaCO3, Fe(OH)3. D. FeS, BaSO4, KOH.
Lời giải:
Đáp án A
Câu 22 (A-2014): Cho phản ứng sau: NaXrắn + H2SO4 đặc 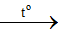
Các hiđro halogennua (HX) có thể điều chế theo phản ứng trên là
A. HCl, HBr, HI B. HF, HCl
C. HBr, HI D. HF, HCl, HBr, HI
Lời giải:
Đáp án B
Câu 23 (B-2014): Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (ở đktc) đã phản ứng là
A. 17,92 lít B. 6,72 lít C. 8,96 lít D. 11,2 lít
Lời giải:
(HD: Bảo toàn khối lượng mCl2 = mMuối − mKL = 28,4 gm
⇒ nCl2 = 0,4 mol ⇒ V = 8,96 (l) )
Đáp án C

