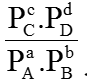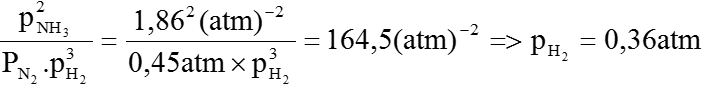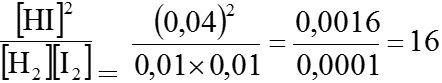Các dạng bài tập về cân bằng hóa học - Hoá học lớp 10
Các dạng bài tập về cân bằng hóa học
Với Các dạng bài tập về cân bằng hóa học Hoá học lớp 10 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập cân bằng hóa học từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

A. Phương pháp & Ví dụ
1. Xác định nồng độ, áp suất tại thời điểm cân bằng
Lý thuyết và Phương pháp giải
Dựa vào định luật tác dụng khối lượng cho các cân bằng thông qua mối quan hệ giữa nồng độ cân bằng với hằng số cân bằng nồng độ hay quan hệ giữa áp suất riêng phần tại thời điểm cân bằng với hằng số cân bằng áp suất.
- Trong dung dịch tồn tại cân bằng: aA + bB 
KC = 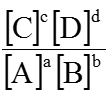
- Phản ứng xảy ra trong pha khí: aA (k) + bB (k) 
Hằng số cân bằng tính theo nồng độ: KC = 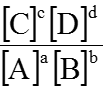
Hằng số cân bằng tính theo áp suất: KP =
Ví dụ minh họa
Ví dụ 1: Cân bằng của phản ứng khử CO2 bằng C: C(r) + CO2 (k) ⇋ 2CO(k)
Xảy ra ở 1000K với hằng số cân bằng KP =
a) Tìm hàm lượng khí CO trong hỗn hợp cân bằng, biết áp suất chung của hệ là 2,5atm.
b) Muốn thu được hỗn hợp khí có tì khối hơi so với H2 là 18 thì áp suất chung của hệ là bao nhiêu?
Hướng dẫn:
a) Ta có cân bằng C(r) + CO2 (k) 
Ta có:Pco+Pco2 =2,5 và Kp = 
⇒ pCO = 2,071 atm; Pco2= 0,429 atm
Trong hệ cùng điều kiện nhiệt độ và thể tích ⇒ tỉ lệ về áp suất bằng tỉ lệ về số mol hay tỉ lệ về thể tích riêng. Vậy hỗn hợp lúc cân bằng chứa:
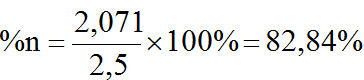
b) Khi khối lượng mol trung bình của hỗn hợp CO và CO2 là 18.2=36 thì số mol CO và CO2 bằng nhau nên ta có Pco= Pco2= 0,5P
Suy ra Kp = 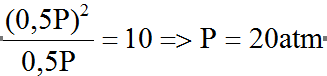

Ví dụ 2: Người ta tiến hành phản ứng: PC15 ⇋ PC13 + Cl2 trong một bình kín có dung tích không đổi ở nhiệt độ xác định. Nếu cho vào bình 0,5 mol PCl5 thì áp suất đầu là 1,5 atm. Khi cân bằng được thiết lập, áp suất đo được bằng 1,75 atm
a) Tính độ phân li và áp suất riêng của từng cấu tử.
b) Thiết lập biểu thức liên hệ giữa độ phân li và áp suất chung của hệ.
Hướng dẫn:
Cân bằng: PCl5 ⇋ PCl3 + Cl2 (1)
Ban đầu: x
Phản ứng: αx αx αx
Cân bằng: x(1 – α) αx αx
Tổng số mol hỗn hợp khí tại thời điểm cân bằng: n= x (1 + α)
Trong cùng điều kiện nhiệt độ, thể tích hỗn hợp phản ứng không đổi nên tỉ số mol bằng tỉ lệ áp suất.
Vậy ta có: 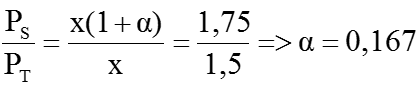
Áp suất riêng phần của PCl5 : 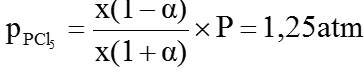
Áp suất riêng phần của PCl3 = áp suất riêng phần của Cl2:
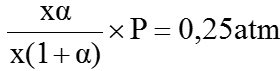
b) Theo cân bằng (1) trong hệ có thể tích và nhiệt độ không đổi thì:
PS = PT × (1 + α)
Ví dụ 3: Trong một bình kín có dung tích không đổi, người ta thực hiện phản ứng:
Ở nhiệt độ thí nghiệm, khi phản ứng đạt tới cân bằng, ta có:PN2= 0,38atm, PH2= 0,4atm, PNH3= 2atm. Hãy tính Kp.
Hút bớt H2 ra khỏi bình một lượng cho đến khi áp suất riêng phần cửa N2 ở trạng thái cân bằng mới là 0,45atm thì dừng lại. Tính áp suất riêng phần của H2 và NH3 ở trạng thái cân bằng mới, biết rằng nhiệt độ của phản ứng không đổi.
Hướng dẫn:
Cân bằng: N2 + 3H2 ⇋ 2NH3 (1)
Áp dụng định luật tác dụng khối lượng cho cân bằng (1):
Kp = 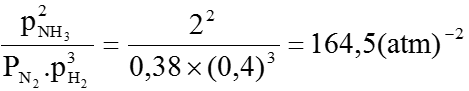
Khi hút bớt H2 theo nguyên lí chuyển dịch cân bằng thì cân bằng (1) sẽ chuyển dịch theo chiều nghịch (chống lại sự giảm nồng độ hay áp suất riêng phần của H2). Do đó áp suất của N2 tăng là: 0,45 – 0,38 = 0,07 (atm), do đó áp suất riêng của NH3 giảm đi bằng 2 lần áp suất của N2 tăng: 0,07×2=0,14 (atm)
Vậy áp suất riêng phần của NH3 tại thời điểm cân bằng mới là:
2 – 0,14 = 1,86 (atm)
Áp dụng định luật tác dụng khối lượng cho cân bằng (1):
Kp =
2. Xác định sư chuyển dịch cân bằng
Lý thuyết và Phương pháp giải
Dựa vào nguyên lí chuyển dịch cân bằng: “ Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ sẽ chuyển dịch cân bằng theo chiều làm giảm tác đọng bên ngoài.”
Ví dụ minh họa
Ví dụ 1: Xét cân bằng sau trong một bình kín:
CaCO3(rắn) 
Ở 820oc hằng số cân bằng KC = 4,28.10-3.
a) Phản ứng trên là phản ứng tỏa nhiệt hay thu nhiệt ?
b) Khi phản ứng đang ở trạng thái cân bằng, nếu biến đổi một trong những điều kiện sau đây thì hằng số cân bằng KC biến đổi như thê nào? Giải thích.
+) Giảm nhiệt độ của phản ứng xuống.
+) Thêm khi CO2 vào.
+) Tăng dung tích của bình phản ứng lên.
+) Lấy bớt một lượng CaCO3 ra.
Hướng dẫn:
Phản ứng: CaCO3(rắn)
a) Phản ứng thu nhiệt vì ΔH> 0
b) KC = [CO2]
+) Khi giảm nhiệt độ của phản ứng xuống thì cân bằng sẽ chuyển dịch theo chiều nghịch (chiều tỏa nhiệt) để đến trạng thái cân bằng mới và ở trạng thái cân bằng mới này thì nồng độ CO2 giảm ⇒ KC giảm +) Khi thêm khí CO2 vào ⇒ Nồng độ CO2 tăng ⇒ Cân bằng chuyển dịch theo chiều nghịch nhưng ở trạng thái cân bằng mới nồng độ CO2 không thay đổi KC không đổi.
+) Khi tăng dung tích của bình phản ứng lên ⇒ Áp suất của hệ giảm (nồng độ CO2 giảm) ⇒ Cân bằng chuyển dịch theo chiều thuận làm tăng nồng độ CO2 nhưng chỉ tăng đến khi nồng độ CO2 trước khi dung tích của bình lên thì dừng lại và cân bằng thiết lập ⇒ KC không đổi.
+) Lấy bớt một lượng CaCO3 ra thì hệ cân bằng không chuyển dịch ⇒ KC không đổi.

Ví dụ 2: Cho cân bằng hóa học: 2NO2 ⇋ N2O4 ΔH= -58,04kJ. Cân bằng sẽ chuyển dịch như thế nào, giải thích, khi:
a) Tăng nhiệt độ, tăng áp suất.
b) Thêm xúc tác.
Hướng dẫn:
Phản ứng hóa học: 2NO2 ⇋ N2O4 ΔH = -58,04kJ ΔH<0 là phản ứng tỏa nhiệt.
a) Khi tăng nhiệt độ, phản ứng thu nhiệt nên cân bằng được chuyển dịch sang trái.
Tăng áp suất, cân bằng được chuyển dịch sang phải để tạo thành số moi khí nhỏ hơn.
b) Khi thêm chất xúc tác, chỉ làm tăng tốc độ phản ứng chứ không chuyển dịch cân bằng.
3. Xác định hằng số cân bằng
Lý thuyết và Phương pháp giải
-Với phản ứng dạng : aA + bB 
Hằng số cân bằng: K =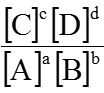
Ví dụ minh họa
Ví dụ 1 . Cho biết phản ứng thuận nghịch sau:
H2(k) + I2(k)
Nồng độ các chất lúc cân bằng ở nhiệt độ 430oC như sau:
[H2 ]=[I2]= 0,107M; [HI]= 0,768M
Tìm hằng số cân bằng KC của phản ứng ở 430oC
Hướng dẫn:
Biếu thức tính hằng số cân bằng: KC = 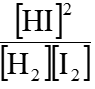
Thay các giá trị [HI]= 0,786M; [H2]=[I2]=0,107M
Vậy: KC =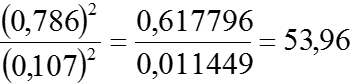
Ví dụ 2. Nồng độ ban đầu của H2 và I2 đều là 0,03 mol/l. Khi đạt đến cân bằng, nồng độ của HI là 0,04 mol/l
a) Tính nồng độ cân bằng của H2 và I2
b) Tính nồng độ cân bằng K của phản ứng tổng hợp HI
Hướng dẫn:
Nồng độ của H2 và I2 ban đầu đề là 0,03 mol/l. Chúng phản ứng với nhau theo
phương trình:
H2 + I2 → 2HI
a) Lúc cân bằng: Nồng độ HI là 0,04mol/l. Như vậy đã có:
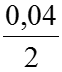
⇒Nồng độ cân bằng của H2 và I2 là:
[H2]=[I2]=0,03 – 0,02 =0,01 (mol/l)
b) Hằng số cân bằng K của phản ứng tổng hợp HI.
c) KC =
B. Bài tập trắc nghiệm
Câu 1. Cho phản ứng thuận nghịch sau:
2NaHCO3 (r) ⇋ Na2CO3 (r) + CO2(k) + H2O (k) ΔH = 129kJ
Có thể dùng những biện pháp gì để chuyển hóa nhanh và hoàn toàn NaHCO3 thành Na2CO3.
Lời giải:
Đáp án:
Nhận thấy chiều thuận của phản ứng có ΔH = 129kJ > 0: thu nhiệt và có số mol khí tăng lên.
Vây biện pháp để cân bằng chuyển dịch hoàn toàn theo chiều thuận là
- Đun nóng (tăng nhiệt độ).
- Giảm áp suất bằng cách thực hiện phản ứng trong bình hở.
Câu 2. Cho phản ứng: 2SO2 (k) + O2 (k) ⇋ 2SO3 (k) ΔH < 0
Cân bằng chuyển dịch theo chiều nào khi:
a) Tăng nồng độ SO2
b) Giảm nồng độ O2
c) Giảm áp suất
d) Tăng nhiệt độ.

Lời giải:
Đáp án:
a) Khi tăng nồng độ SO2 thì cân bằng chuyển dịch theo chiều thuận nghĩa là chiều làm giảm nồng độ SO2.
b) Khi giảm nồng độ O2 thì cân bằng chuyển dịch theo chiều nghịch nghĩa là chiều tạo ra O2.
c) Khi giảm áp suất thì cân bằng chuyển dịch theo chiều nghịch nghĩa là chiều tăng số mol khí.
d) Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch nghĩa là chiêu phản ứng thu nhiệt.
Câu 3. Sản xuất amoniac trong công nghiệp dựa trên phương trình hóa học sau:
2N2(k) + 3H2(k) ⇋ 2NH3(k) ΔH = -92kJ
Cân bằng hóa học sẽ chuyển dịch về phía tạo ra amoniac nhiều hơn khi thực hiện. những biện pháp kĩ thuật nào? Giải thích.
Lời giải:
Đáp án:
Để thu được nhiều amoniac, hiệu quả kinh tế cao có thể dùng các biện pháp kĩ thuật sau đây:
- Tăng nồng độ N2 và H2.
- Tăng áp suất chung của hệ lên khoảng 100 atm, vì phản ứng thuận có sự giảm thể tích khí.
- Dùng nhiệt độ phản ứng thích hợp khoảng 400 - 450oC và chất xúc tác để tăng tốc độ phản ứng tạo thành NH3. Chú ý rằng chất xúc tác không làm chuyển dịch cân bằng.
- Tận dụng nhiệt của phản ứng sinh ra để sấy nóng hỗn hợp N2 và H2.
- Tách NH3 ra khỏi hỗn hợp cân bằng và sử dụng lại N2 và H2 còn dư.
Câu 4. Sự tăng áp suất ảnh hưởng như thế nào đến trạng thái cân bằng của các phản ứng hóa học sau:
a) 3O2 (k) ⇋ 2O3 (k)
b) H2(k) + Br2(k) ⇋ 2HBr(k)
c) N2O4(k) ⇋ 2NO2(k)
Lời giải:
Đáp án:
Để đánh giá tác động của áp suất cần so sánh sự biến đổi của thể tích khí trước và sau phản ứng. Nếu sau phản ứng có sự giảm thể tích thì áp suất tăng làm cân bằng chuyển dịch theo chiều thuận và ngược lại, áp suất không có ảnh hưởng tới cân bằng của các phản ứng không thay đổi thể tích khí.
3O2 (k) ⇋ 2O3 (k)
Phản ứng (a) có sự giảm thể tích, cân bằng chuyển theo chiều thuận khi áp suất tăng.
H2(k) + Br2(k) ⇋ 2HBr(k)
Phản ứng (b) không có sự thay đổi thể tích, cân bằng không phụ thuộc vào áp suất.
c) N2O4(k) ⇋ 2NO2(k)
Phản ứng (c) có sự tăng thể tích, cân bằng chuyển theo chiều nghịch khi áp suất tăng.
Câu 5. Cho phản ứng: CO (k) + Cl2 (k) ⇋ COCl2 (k) được thực hiện trong bình kín ở nhiệt độ không đổi, nồng độ ban đầu của CO và Cl2 bằng nhau và bằng 0,4M.
a) Tính hằng số cân bằng của phản ứng biết rằng khi hệ đạt trạng thái cân bằng thì chỉ còn 50% lượng CO ban đầu.
b) Sau khi cân bằng được thiết lập ta thêm 0,1 mol CO vào 1 lít hỗn hợp. Tính nồng độ các chất lúc cân bằng mới được thiết lập.
Lời giải:
Đáp án:
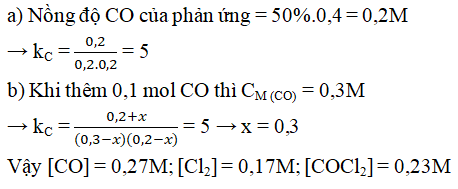

Câu 6. Cho cân bằng hóa học sau:
2SO2(k) + O2 (k) ⇋ 2SO3 (k); ΔH < 0
Để cân bằng dịch chuyển theo chiều nghịch thì:
A. Tăng áp suất, giảm nhiệt độ, giảm nồng độ O2
B. Giảm áp suất, tăng nhiệt độ, lấy SO2 ra khỏi hệ
C. Lấy SO3 ra liên tục
D. Không dùng xúc tác nữa.
Lời giải:
Đáp án:
B.
Câu 7. Phát biểu nào về chất xúc tác là không đúng?
A. Chất xúc tác làm tăng tốc độ phản ứng
B. Chất xúc tác làm giảm thời gian đạt tới cân bằng của phản ứng
C. Chất xúc tác được hoàn nguyên sau phản ứng
D. Chất xúc làm cho phản ứng dịch chuyển theo chiều thuận.
Lời giải:
Đáp án:
D. Lưu ý: chất xúc tác không làm chuyển dịch cân bằng.
Câu 8. Cho phản ứng thuận nghịch sau:
A2(k) + B2(k) ⇋ 2AB(k); ΔH > 0
Để cân bằng dịch chuyển sang chiều thuận thì:
A. Tăng nhiệt độ, giảm áp suất
B. Tăng nhiệt độ, giữ nguyên áp suất
C. Giảm nhiệt độ, tăng áp suất
D. Nhiệt độ và áp suất đều tăng
Lời giải:
Đáp án:
B. Phản ứng thu nhiệt theo chiều thuận
Do số mol không thay đổi nên áp suất không ảnh hưởng đến cân bằng hóa học