Phương pháp giải Các dạng bài tập chương Bảng tuần hoàn các nguyên tố hóa học - Hoá học lớp 10
Phương pháp giải Các dạng bài tập chương Bảng tuần hoàn các nguyên tố hóa học
Với Phương pháp giải Các dạng bài tập chương Bảng tuần hoàn các nguyên tố hóa học Hoá học lớp 10 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Bảng tuần hoàn các nguyên tố hóa học từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

- 6 dạng bài tập Bảng tuần hoàn trong đề thi Đại học có lời giải
- Dạng 1: Xác định tên nguyên tố khi biết thành phần nguyên tố trong hợp chất
- Dạng 2: Mối quan hệ giữa cấu hình e và vị trí, cấu tạo
- Dạng 3: Bài tập về sự biến thiên tính chất của các nguyên tố hóa học
- Dạng 4: Xác định nguyên tố thuộc 2 nhóm A liên tiếp trong Bảng HTTH
- Dạng 5: Xác định 2 nguyên tố thuộc 2 nhóm A liên tiếp
- Dạng 6: Xác định nguyên tố thông qua nguyên tử khối
- Tổng hợp: Xác định tên nguyên tố dựa vào đặc điểm chu kì, nhóm
Bài tập trắc nghiệm
- 40 bài tập trắc nghiệm chương Bảng tuần hoàn các nguyên tố hóa học có đáp án
- 70 câu trắc nghiệm Bảng tuần hoàn các nguyên tố hóa học có lời giải chi tiết (cơ bản)
- 70 câu trắc nghiệm Bảng tuần hoàn các nguyên tố hóa học có lời giải chi tiết (nâng cao)
Xác định tên nguyên tố khi biết thành phần nguyên tố trong hợp chất
Lý thuyết và Phương pháp giải
Cần nhớ một số điểm sau:
- Hóa trị cao nhất với oxi của nguyên tố = STT nhóm A.
- Hóa trị với H( nếu có) = 8 - hóa trị cao nhất với oxi.
- % khối lượng của A trong hợp chất AxBy là: %A= MA*100/M.
- Muốn xác định nguyên tố đó là nguyên tố nào cần tìm được M =?.
Ví dụ minh họa
Ví dụ 1. Nguyên tố R có hóa trị cao nhất trong oxit gấp 3 lần hóa trị trong hợp chất với hiđro. Hãy cho biết hóa trị cao nhất của R trong oxit.
Hướng dẫn:
Gọi hóa trị cao nhất của R trong oxit là m, hóa trị trong hợp chất với hiđro là n. Ta có: m + n = 8.
Theo bài: m = 3n. Từ đây tìm được m = 6; n = 2.
Ví dụ 2. Một nguyên tố tạo hợp chất khí với hidro có công thức RH3.Nguyên tố này chiếm 25,93% về khối lượng trong oxit bậc cao nhất. Xác định tên nguyên tố.
Hướng dẫn:
Hợp chất với Hiđro là RH3 ⇒ Chất cao nhất với oxi có công thức là: R2 O5
Ta có : (2.R) / (16.5) = 25,93/74,07
⇒ R= 14 ⇒ R là nguyên tố Nitơ
Ví dụ 3. Oxit cao nhất của một nguyên tố chứa 72,73% oxi, còn trong hợp chất khí với hidro chứa 75% nguyên tố đó.Viết công thức oxit cao nhất và hợp chất khi với hidro.
Hướng dẫn:
Gọi hợp chất với hidro có công thức là : RHx
⇒ Hợp chất với oxi có công thức là R2 Ox-8
Ta có:
(1) (2.R) / 16(8-x )= 27,27/72,73.
(2) R/x = 75/ 25 = 3
⇒ R= 3x thay vào pt(1) ta có đáp án : x= 4 và ⇒ R = 12
Vậy R là cacbon ⇒ CO2 và CH4
Ví dụ 4. Oxit cao nhất của nguyên tố R thuộc nhóm VIA có 60% oxi về khối lượng. Hãy xác nguyên tố R và viết công thức oxit cao nhất.
Hướng dẫn:
Nhóm VIA nên hợp chất oxit bậc cao là RO3
Ta có: R/ 48 = 40/60 vậy R= 32 ( Lưu huỳnh)
⇒ Công thưc Oxit cao nhất là : SO3
Ví dụ 5. Oxit cao nhất của nguyên tố R có dạng R2O5 . Trong hợp chất của R với hiđro ở thể khí có chứa 8,82 % hiđro về khối lượng. Công thức phân tử của hợp chất khí với hiđro là ( C = 12, N= 14, P= 31, S= 32)
A. NH3. B.H2S. C. PH3. D. CH4.
Hướng dẫn:
Oxit cao nhất của R là R2O5 nên R thuộc nhóm VA.
⇒ Hợp chất với H là RH3
Ta có 3/R = 8,82 / 91,18 ⇒ R=31 (P)
⇒ Chọn C
B. Bài tập trắc nghiệm
Câu 1. Oxit cao nhất của một nguyên tố ứng với công thức R2O5. Hợp chất của nó với hidro là một chất có thành phần không đổi với R chiếm 82,35% và H chiếm 17,65% về khối lượng. Tìm nguyên tố R.
Lời giải:
Nguyên tố có oxit cao nhất là R2O5 → R thuộc nhóm VA.
→ Hợp chất với hidro: RH3
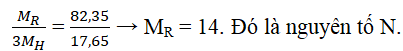
Câu 2. Oxit cao nhất của một nguyên tố ứng với công thức RO3. Hợp chất của nó với hidro có 5,88% H về khối lượng. Xác định R.
Lời giải:
Oxit cao nhất là RO3 → R thuộc nhóm VIA.
Hợp chất với hidro có dạng RH2.
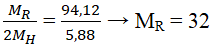
Đó là nguyên tố lưu huỳnh (S).
Câu 3. Một nguyên tố Q tạo hợp chất khí với hiđro có công thức QH3. Nguyên tố này chiếm 25,93% theo khối lượng trong oxit bậc cao nhất. Định tên nguyên tố Q.
Lời giải:
Từ hợp chất QH3 ⇒ Q có hóa trị III
⇒ Hợp chất oxit cao nhất lầ: Q2O5.
Theo đề bài, ta có: %Q = 2Q/(2Q + 80) × 100 = 25,93
⇔ Q + 40 = 3,875Q ⇒ Q = 14: Nitơ
Câu 4. Oxit cao nhất của nguyên tố R có dạng R2O7. Sản phầm khí của R với hidro chứa 2,74% hidro về khối lượng. Xác định nguyên tử khối của R.
Lời giải:
Oxit cao nhất của nguyên tố R có công thức R2O7.
→ Công thức hợp chất khí với hidro có dạng RH theo đề:
%H = 1/(R+1) . 100% = 2,74%
Giải ra ta có: R = 35,5 (clo). Cl
→ Công thức phân tử của oxit là Cl2O7
Công thức hợp chất khí với hidro là HCl.
Câu 5. Tỉ số phần trăm của nguyên tố R trong oxit bậc cao nhất với phần trăm của R trong hợp chất khí với hiđro là 0,6994. R là nguyên tố phi kim ở nhóm lẻ. Xác định R.
Lời giải:
Đặt oxit cao nhất có dạng R2On (X)
Hợp chất khí với hiđro có dạng RH8-n (Y)
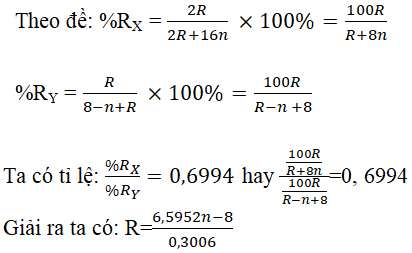
Vì R là nguyên tố phi kim ở nhóm lẻ nên n = 5 hoặc n = 7
| n | 5 | 7 |
| R | 83,07 (loại) | 127 (nhận) |
R là iot (I) ⇒ Công thức oxit cao nhất: I2O7; hợp chất khí : HI
Câu 6. Nguyên tử Y có hóa trị cao nhất với oxi gấp 3 lần hóa trị trong hợp chất khí với hidro. Gọi X là công thức hợp chất oxit cao nhất, Z là công thức hợp chất khí với hidro của Y. Tỉ khối hơi của X đối với Z là 2,353. Xác định nguyên tố Y.
Lời giải:
Gọi hóa trị cao nhất với H là nH và với oxi là nO.
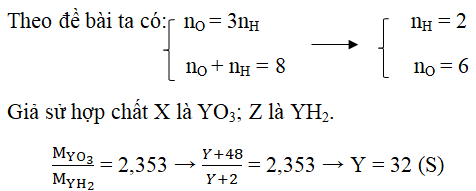
Câu 7. Hợp chất khí với hiđro của một nguyên tố ứng với công thức RH4. Oxit cao nhất của nó chứa 53,3% oxi theo khối lượng. Xác định tên nguyên tố R.
Lời giải:
Từ công thức RH4 ⇒ R có hóa trị IV
⇒ Công thức oxit cao nhất của R là: RO2
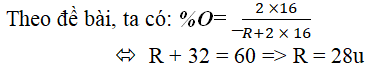
Vậy nguyên tố R là silic (Si).
Câu 8. Nguyên tử của nguyên tố C có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của X với hidro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là:
A.50,00% B.27,27% C.60,00% D.40,00%
Lời giải:
X: ns2np4 → X thuộc nhóm IVA → hợp chất khí với H là XH2
→ oxit cao nhất là XO3.
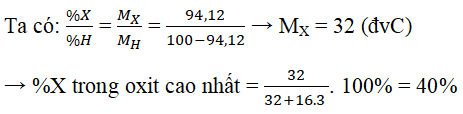
Mối quan hệ giữa cấu hình e và vị trí, cấu tạo
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Cần nhớ :
- Số thứ tự ô nguyên tố = tổng số e của nguyên tử.
- Số thứ tự chu kì = số lớp e.
- Số thứ tự nhóm:
+ Nếu cấu hình e lớp ngoài cùng có dạng nsanpb (a = 1 → 2 và b = 0 → 6): Nguyên tố thuộc nhóm (a + b)A.
+ Nếu cấu hình e kết thúc ở dạng (n - 1)dxnsy(x = 1 → 10; y = 1 → 2): Nguyên tố thuộc nhóm B:
* Nhóm (x + y)B nếu 3 ≤ (x + y) ≤ 7.
* Nhóm VIIIB nếu 8 ≤ (x + y) ≤ 10.
* Nhóm (x + y - 10)B nếu 10 < (x + y).
Ví dụ minh họa
Ví dụ 1. Xác định vị trí (số thứ tự, chu kỳ, nhóm, phân nhóm) các nguyên tố sau đây trong bảng tuần hoàn, cho biết cấu hình electron của nguyên tử các nguyên tố đó như sau:
1. 1s22s22p63s23p64s2 2. 1s22s22p63s23p63d54s2
Hướng dẫn:
1. Số thứ tự 20, chu kì 4, nhóm IIA.
2. Số thứ tự 25, chu kì 4, nhóm VIIB.
Ví dụ 2. Giả sử nguyên tố M ở ô số 19 trong bảng tuần hoàn chưa được tìm ra và ô này vẫn còn được bỏ trống. Hãy dự đoán những đặc điểm sau về nguyên tố đó:
a. Tính chất đặc trưng.
b. Công thức oxit. Oxit đó là oxit axit hay oxit bazơ?
Hướng dẫn:
a, Cấu hình electron của nguyên tố đó là: 1s22s22p63s23p64s1
⇒ Electron lớp ngoài cùng là 1 nên tính chất đặc trưng của M là tính kim loại.
b, Nguyên tố đó nằm ở nhóm IA nên công thức oxit là M2O. Đây là một oxit bazơ.
Ví dụ 3. Ion M3+có cấu hình electron lớp ngoài cùng là 3s23p63d5.
a, Xác định vị trí (số thứ tự, chu kỳ, nhóm) của M trong bảng tuần hoàn. Cho biết M là kim loại gì?
b, Trong điều kiện không có không khí, cho M cháy trong khí Cl2 thu được một chất A và nung hỗn hợp bột (M và S) được một hợp chất B. Bằng các phản ứng hóa học, hãy nhận biết thành phần và hóa trị của các nguyên tố trong A và B.
Hướng dẫn:
a, Tổng số electron của nguyên tử M là 26. Số thứ tự 26, chu kì 4, nhóm VIIIB. M là Fe.
b, Fe cháy trong khí clo:
2Fe + 3Cl2 → 2FeCl3
Hòa tan sản phẩm thu được vào nước thu được dung dịch. Lấy vài ml dung dịch cho tác dụng với dung dịch AgNO3, có kết tủa trắng chứng tỏ có gốc clorua:
FeCl3 + 3AgNO3 → Fe(NO3 ) 3 + 3AgCl
Lặp lại thí nghiệm với dung dịch NaOH, có kết tủa nâu đỏ chứng tỏ có Fe(III):
FeCl3 + 3NaOH → Fe(OH) 3 + 3NaCl
- Nung hỗn hợp bột Fe và bột S:
Fe + S → FeS
Cho B vào dung dịch H2 SO4 loãng, có khí mùi trứng thối bay ra chứng tỏ có gốc sunfua:
FeS + H2 SO4 → FeSO4 + H2 S (trứng thối)
Nhỏ dung dịch NaOH vào dung dịch thu được, có kết tủa trắng xanh chứng tỏ có Fe(II):
FeSO4 + 2NaOH → Na2 SO4 + Fe(OH) 2 (trắng xanh)
Ví dụ 4. Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
A. 12. B. 13. C. 11. D. 14.
Hướng dẫn:
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2
Cấu hình e của X là: 1s22s22p63s2
X có 12 e nên có 12 p nên số hiệu nguyên tử của nguyên tố X là 12.
⇒ Chọn A
Ví dụ 5. Cho biết tổng số electron trong anion AB32-là 42. Trong các hạt nhân A và B đều có số proton bằng số nơtron.
a. Tìm số khối của A và B
b. Cho biết vị trí của A, B trong bảng tuần hoàn
Hướng dẫn:
a. Gọi số hạt proton của A là P và của B là P’, ta có:
P + 3P’ = 42 - 2. Ta thấy 3P’ < P + 3P’ = 40 nên P’ < 30/3= 13,3.
Do B tạo được anion nên B là phi kim. Mặt khác P’ < 13,3 nên B chỉ có thể là nitơ, oxi hay flo.
Nếu B là nitơ (P’ = 7) → P = 19 (K). Anion là KN32- -: loại
Nếu B là oxi (P’ = 8) → P = 16 (S). Anion là SO32- -: thỏa mãn
Nếu B là flo (P’ = 9) → P = 13 (Al). Anion là AF32- -: loại
Vậy A là lưu huỳnh, B là oxi.
b. O (P’ = 8) : 1s22s22p4 ⇒ ô số 8, chu kỳ 2, nhóm VIA.
S (P = 16) : 1s22s22p63s23p4 ⇒ ô số 16, chu kỳ 3, nhóm VIA.
Ví dụ 6. Nguyên tử R tạo được Cation R+. Cấu hình e của R+ở trạng thái cơ bản là 3p6. Tổng số hạt mang điện trong R là.
A.18 B.22 C.38 D.19
Hướng dẫn:
Cấu hình của R+là 3p6
⇒ R sẽ là 3p64s1
⇒ R có cấu hình đầy đủ là 1s22s22p63s23p64s1
⇒ Tổng hạt mang điện trong R là ( p + e ) = 38
⇒ Chọn C
Ví dụ 7. Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số notron. Tổng số proton trong phân tử XY2 là 32.
a. Viết cấu hình electron của X và Y.
b. Xác định vị trí của X và Y trong bảng tuần hoàn.
Hướng dẫn:
a. Gọi số hạt prroton, nơtron, electron của nguyên tử X là P, N, E và của Y là P’, N’, E’.
Theo bài: P = N = E và P’ = N’ = E’ ⇒ Mx = 2P, My = 2P’
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
Mx /(2. My )= 50/50 =1 ⇒ 2P /2.2P’ =1 ⇒ P = 2P’.
Tổng số proton trong phân tử XY2 là 32 nên P + 2P’ = 32.
⇒ P = 16 (S) và P’ = 8 (O). ⇒ Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4
b. Lưu huỳnh ở ô số 16, chu kỳ 3, nhóm VIA.
Oxi ở ô số 8, chu kỳ 2, nhóm VIA.
Ví dụ 8. Cho biết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố (thuộc chu kỳ 3) A, M, X lần lượt là ns1, ns2np1, ns2np5. Xác định vị trí của A, M, X trong bảng tuần hoàn và cho biết tên của chúng.
Hướng dẫn:
A, M, X thuộc chu kỳ 3 nên n = 3.
Cấu hình electron, vị trí và tên nguyên tố:
A: 1s22s22p63s1(ô số 11, nhóm IA), A là kim loại Na.
M: 1s22s22p63s23p1(ô số 13, nhóm IIIA), M là kim loại Al.
X: 1s22s22p63s23p5(ô số 17, nhóm VIIA), X là phi kim Cl.
B. Bài tập trắc nghiệm
Câu 1. Cho các nguyên tố có cấu hình electron như sau:
1s22s22p2, 1s22s22p5, 1s22s22p63s23p6, 1s22s22p63s1
a) Xác định số electron hóa trị của từng nguyên tử.
b) Xác định vị trí của chúng (chu kì, nhóm, phân nhóm trong bảng tuần hoàn các nguyên tố hóa học).
Lời giải:
Đáp án:
a) Xác định số electron hóa trị:
1s22s22p2: có 4 electron hóa trị.
1s22s22p5: có 7 electron hóa trị.
1s22s22p63s23p6: có 8 electron hóa trị.
1s22s22p63s1: có 1 electron hóa trị.
b) Xác định vị trí của các nguyên tố trong bảng tuần hoàn:
1s22s22p2: Nguyên tố thuộc chu kì 2, nhóm IVA
1s22s22p5: Nguyên tố thuộc chu kì 2, nhóm VIIA
1s22s22p63s23p6: Nguyên tố thuộc chu kì 3, nhóm VIIIA
1s22s22p63s1: Nguyên tố thuộc chu kì 3, nhóm IA
Câu 2. Cho các hạt vi mô X+, Y- , Z2- và Q có cấu hình electron: ls22s22p6. Xác định vị trí các nguyên tố X, Y, Z và Q trong bảng tuần hoàn các nguyên tố hóa học.
Lời giải:
Đáp án:
- Nguyên tố Q cấu hình electron: ls22s22p6 nên Z = 10 là nguyên tố khí hiếm thuộc ô thứ 10, chu kì 2 nhóm VIIIA.
- Cation X+ hình thành do: X → X+ + 1e nên Z = 11; X có cấu electron: ls22s22p63s1. Vậy X ở ô thứ 11, chu kì 3 nhóm IA.
- Anion Y- hình thành do: Y + 1e → Y- nên Z = 9; Y có cấu hình electron: ls22s22p6. Vậy Y ở ô thứ 9, chu kì 2 nhóm VIIA.
- Anion Z2- hình thành do: Z + 2e → Z2- nên Z = 8. Z có cấu hình electron: ls22s22p4. Vậy Z ở ô thứ 8, chukì 2 nhóm VIA.
Câu 3. Một nguyên tố ở chu kì 2, nhóm VA trong bảng tuần hoàn các nguyên tố hóa học. Hỏi:
a. Nguyên tử của nguyên tố đó có bao nhiên electron ở lớp ngoài cùng?
b. Các electron ngoài cùng nằm ở lớp thứ mấy?
c. Viết cấu hình electron nguyên tử của nguyên tố trên?
Lời giải:
Đáp án:
a) Vì thuộc nhóm VA nên nguyên tố có 5 electron ở lớp ngoài cùng.
b) Vì thuộc chu kì 2 nên các electron ngoài cùng nằm ở lớp thứ hai.
c) Cấu hình electron: 1s22s22p3
Câu 4. Xác định vị trí của nguyên tố có Z = 20 và nguyên tố có Z = 29.
Lời giải:
Đáp án:
- Với nguyên tố có Z = 20 thì cấu hình electron: 1s22s22p63s23p64s2 trong bảng tuần hoàn nguyên tố đó ở
+) Ô thứ 20.
+) Chu kì 4: vì có 4 lớp electron.
+) Nhóm IIA vì có 2 electron cuối cùng chiếm obitan 4s2 ở lớp ngoài cùng.
- Với nguyên tố có Z = 29 thì cấu hình electron: 1s22s22p63s23p63d104s1 trong bảng tuần hoàn nguyên tố đó ở.
+) Ô thứ 29.
+) Chu kì 4 vì có 4 lớp electron.
+) Nhóm IB vì có electron ứng với mức năng lượng cao nhất chiếm obitan 3d; tổng số electron ở (n - l)d và ns là 11 nên thuộc nhóm 11 - 10 = 1.
Câu 5. Biết nguyên tố R thuộc chu kì 2 nhóm VA của bảng tuần hoàn. Hãy viết cấu hình electron của nguyên tử R.
Lời giải:
Đáp án:
E thuộc chu kì 2 ⇒ Có 2 lớp electron. R thuộc nhóm VA ⇒ Có 5 electron lớp ngoài cùng ⇒ Cấu hình electron của R: ls32s22p3.
Câu 6. Một nguyên tố có cấu hình electron nguyên tử như sau:
1s22s22p4; 1s22s22p3;
1s22s22p63s23p1; 1s22s22p63s23p5.
a) Hãy xác định số electron hóa trị của từng nguyên tố.
b) Hãy xác định vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn các nguyên tố hóa học.
Lời giải:
Đáp án:
a) số electron hóa trị của từng nguyên tố:
+) 1s2 2s2 2p4: Có 6 electron hóa trị.
+) 1s2 2s2 2p3: Có 5 electron hóa tri
+) 1s2 2s2 2p6 3s2 3p1: Có 3 electron hóa trị
+) 1s2 2s2 2p6 3s2 3p5: Có 7 electron hóa trị
b) Ví trí (chu kỳ, nhóm) cửa các nguyên tố:
Dựa vào cấu hình electron của nguyên tử cho biết:
Số lớp electron suy ra số thứ tự của chu kì.
Các electron lớp ngoài cùng là electron s và electron p nên chúng đều là nguyên tố p, do vậy chúng thuộc nhóm A, vì thế số electron ngoài cùng cho biết số thứ tự của nhóm.
+) 1s2 2s2 2p4: Thuộc chu kì 2, nhóm VIA.
+) 1s2 2s2 2p3: Thuộc chu kì 2, nhóm VA.
+) 1s2 2s2 2p6 3s2 3p1: Thuộc chu kì , nhóm IIIA
+) 1s2 2s2 2p6 3s2 3p5: Thuộc chu kì 3, nhóm VIIA
Câu 7. Nguyên tử X, anion Y-, cation Z- đều có cấu hình electron ở lớp ngoài cùng là 4s24p6. Cho biết vị trí (chu kì, nhóm) và tính chất (phi kim hay kim loại) của X, Y, Z trong bảng hệ thống tuần hoàn.
Lời giải:
Đáp án:
Từ cấu hình electron ở lớp ngoài cùng là 4s24p6 suy ra cấu hình electron đầy đủ là: ls22s22p63s23p63d104s24p6.
+) Nguyên tố X: ls22s22p63s23p63d104s24p6.
Thuộc chu kì 4, nhóm VIIIA; có 8e lớp ngoài cùng X là khí hiếm.
+) Nguyên tố Y: Từ Y + 1e = Y-
Nên cấu hình của Y là: ls22p22p63s23p63d104s24p6, thuộc chu kì 4, nhóm VIIA; có 7e lớp ngoài cùng ⇒ Y là phi kim.
+) Nguyên tố Z: Từ z = z+ + le
Nên cấu hình của z là: 1s22s22p63s23p63d104s24p65s1, thuộc chu kì 5, nhóm IA; có 1e lớp ngoài cùng z là kim loại.
Câu 8. Cation (ion dương) X+ có cấu hình electron ở phân lớp ngoài cùng là 2p6.
a) Viết cấu hình electron và sự phân bố electron theo obitan của nguyên tố X.
b) Cho biết vị trí của X.
Lời giải:
Đáp án:
a) Viết cấu hình electron và sự phân bố electron vào obitan.
Vì cation X+ là do nguyên tử X mất đi 1 electron nên cấu hình electron của X: 1s22s22p62s2 3s1 và sự phân bố các obitan như sau:
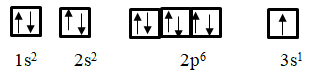
b) X thuộc chu kì 3 vì có 3 lớp electron.
X thuộc nhóm IA vì có 1 electron ở lớp ngoài cùng.
X thuộc ô 11 vì có tổng điện tích 11.
Bài tập về sự biến thiên tính chất của các nguyên tố hóa học
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Dựa vào quy luật biến thiên tính chất theo chu kì và theo nhóm.
- Trong chu kì: Theo chiều tăng của diện tích hạt nhân (tức Z tăng): tính kim loại giảm, phi kim tăng, tính bazơ giảm, axit tăng.
- Trong nhóm A: Theo chiều Z tăng: Tính kim loại tăng, phi kim giảm, tinh bazơ tăng, tính axit giảm.
Ví dụ minh họa
Ví dụ 1. Dãy các nguyên tố nào dưới đây được sắp xếp theo chiều tăng dần tính kim loại?
A. Li, Be, Na, K. B. Al, Na, K, Ca.
C. Mg, K, Rb, Cs. D. Mg, Na, Rb, Sr.
Hướng dẫn:
Trong 1 chu kì, tính kim loại giảm dần (đi từ trái qua phải).
Trong 1 nhóm, tính kim loại tăng dần (đi từ trên xuống dưới).
Do đó dãy sắp xếp tăng dần tính kim loại là: Mg, K, Rb, Cs
⇒ Chọn C
Ví dụ 2. Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20. Phát biểu nào sau đây sai?
A. Các nguyên tố này đều là các kim loại mạnh nhất trong chu kì.
B. Các nguyên tố này không cùng thuộc 1 chu kì.
C. Thứ tự tăng dần tính bazo là: X(OH)2, Y(OH) 2, Z(OH) 2
D. Thứ tự tăng dần độ âm điện là: Z < Y < X
Hướng dẫn:
Zx= 4 ⇒ cấu hình e lớp ngoài cùng của X là … 2s2 ⇒ X thuộc nhóm II, chu kì 2
Zy = 12 ⇒ cấu hình e lớp ngoài cùng của Y là ….3s2 ⇒ Y thuộc nhóm II, chu kì 3
Zz = 20 ⇒ cấu hình e lớp ngoài cùng của Z là ….4s2⇒ Z thuộc nhóm II, chu kì 4
A sai vì nguyên tố nhóm IA mới là KL mạnh nhất trong 1 CK
B đúng X thuộc CK 2, Y thuộc CK 3, Z thuộc CK 4.
C đúng Trong cùng 1 nhóm tính bazo tăng dần theo chiều tăng dần của điện tích hạ nhân.
D đúng Trong cùng 1 nhóm độ âm điện giảm dần theo chiều tăng dần của điện tích hạt nhân.
⇒ Chọn A
Ví dụ 3. Cho các phát biểu sau:
(I) F là phi kim mạnh nhất.
(II) Li là KL có độ âm điện lớn nhất
(III) He là nguyên tử có bán kính nhỏ nhất.
(IV) Be là KL yếu nhất trong nhóm IIA.
Số các phát biểu đúng là?
A. 1 B. 2 C. 3 D. 4
Hướng dẫn:
⇒ Chọn C (I, III, IV).
Ví dụ 4. Cho 3 nguyên tố X, Y, Z lần lượt ở vị trí 11, 12, 19 của bảng tuần hoàn. Hidroxit của X, Y, Z tương ứng là X’, Y’, Z’. Thứ tự tăng dần tính bazo là:
A. X’ < Y’ < Z’ C. Z’ < Y’< X’
B. Y’ < X’ < Z’ D. Z’ < X’ < Y’.
Hướng dẫn:
ZX = 11 có cấu hình e lớp ngoài cùng là 3s1
ZY = 11 có cấu hình e lớp ngoài cùng là 3s2
ZZ = 19 có cấu hình e lớp ngoài cùng là 4s1
Trong cùng 1 nhóm tính kim loại tăng dần theo chiều tăng của điện tích hạt nhân do đó tính bazo tương ứng của X’ < Z’
Trong cùng 1 CK tính kim loại giảm dần theo chiều tăng của điện tích hạt nhân do đó tính bazo tương ứng của X’> Y’
⇒ Chọn B
B. Bài tập trắc nghiệm
Câu 1. Tính kim loại tăng dần trong dãy :
A. Ca, K, Al, Mg B. Al, Mg, Ca, K
C. K, Mg, Al, Ca D. Al, Mg, K, Ca
Lời giải:
Đáp án: B
Câu 2. Tính phi kim giảm dần trong dãy :
A. C, O, Si, N
B. Si, C, O, N
C. O, N, C, Si
D. C, Si, N, O
Lời giải:
Đáp án: C
Câu 3. Tính bazơ tăng dần trong dãy :
A. Al(OH)3 ; Ba(OH)2; Mg(OH)2
B. Ba(OH)2; Mg(OH)2; Al(OH)3
C. Mg(OH)2; Ba(OH)2; Al(OH)3
D. Al(OH)3; Mg(OH)2; Ba(OH)2
Lời giải:
Đáp án: D
Câu 4. Tính axit tăng dần trong dãy :
A. H3PO4; H2SO4; H3AsO4 B. H2SO4; H3AsO4; H3PO4
C. H3PO4; H3AsO4; H2SO4 D. H3AsO4; H3PO4 ;H2SO4
Lời giải:
Đáp án: D
Câu 5. Bán kính nguyên tử các nguyên tố : Na, Li, Be, B. Xếp theo chiều tăng dần là:
A. B < Be < Li < Na B. Na < Li < Be < B
C. Li < Be < B < Na D. Be < Li < Na < B
Lời giải:
Đáp án: A
Câu 6. Độ âm điện của các nguyên tố : Na, Mg, Al, Si. Xếp theo chiều tăng dần là:
A. Na < Mg < Al < Si B. Si < Al < Mg < Na
C. Si < Mg < Al < Na D. Al < Na < Si < Mg
Lời giải:
Đáp án: A
Câu 7. Các nguyên tố C, Si, Na, Mg được xếp theo thứ tự năng lượng ion hoá thứ nhất giảm dần là :
A. C, Mg, Si, Na B. Si, C, Na, Mg
C. Si, C, Mg, Na D. C, Si, Mg, Na
Lời giải:
Đáp án:
Câu 8. Hãy so sánh tính bazơ của các cặp chất sau và giải thích ngắn gọm
a) Magie hiđroxit và canxi hiđroxit.
b) Natri hiđroxit và magie hiđroxit.
Lời giải:
Đáp án:
a) Mg(OH)2 có tính bazơ yếu hơn Ca(OH)2 vì Mg và Ca đều thuộc nhóm IIA, theochiều từ trên xuống, trong một nhóm A tính kim loại tăng dần, tính phi kim loại giảm dần. Đồng thời tính axit của hiđroxit giảm dần, tính bazơ tăng dần.
b) Mg(OH)2 có tính bazơ yếu hơn NaOH vì Mg và Na đều thuộc cùng một chu kì theo chiều từ trái sang phải tính kim loại giảm dần, tính phi kim tăng dần. Đồng thời axit của hiđroxit tăng dần, tính bazơ giảm dần.
Câu 9.
Hãy so sánh tính chất axit của các chất trong mỗi cặp sau và giải thích: Axit cacbonic và axit silicic; axit photphoric và axit sunfuric; axit silisic và axit sunfuric.
Lời giải:
Đáp án:
- Trong một nhóm A, khi đi từ trên xuống tính bazơ của các oxit và hiđroxit tăng dần, tính axit giảm dần. Nên H2CO3 có tính axit mạnh hơn H2SiO3.
- Trong một chu kì tính bazơ giảm dần và tính axit của các oxit và hiđroxit tăng khi đi từ đầu chu kì cho đến cuối chu kì. Nên tính axit của H2SO4 mạnh hơn H3PO4
- Tính axit của H2SiO3 yếu hơn H3PO4 (trong 1 chu kì) và H3PO4 yếu hơn H2SO4 do vậy tính axit của H2SiO3 yếu hơn H2SO4
Câu 10.
Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt 9, 16,17:
a) Xác định vị trí của chúng trong bảng tuần hoàn.
b) Xếp các nguyên tố đó theo thứ tự tính phi kim tăng dần,
Lời giải:
Đáp án:
Câu 10.
+) X (Z = 9) ls22s22p5: Thuộc chu kì 2, nhóm VIIA. Là F (Flo).
+) Y (Z = 16) ls22s22p63s23p4: Thuộc chu kì 3, nhóm VIA .Là S (luu huỳnh).
+) Z (Z = 17) ls22s22p63s23p5: Thuộc chu kì 3, nhóm VIIA Là Cl (Clo).
So sánh X và Z (vì thuộc cùng chu kì) thì: Tính phi kim X > Z
So sánh Y và Z (vì thuộc cùng nhóm A) thì: Tính phi kim Z > Y.
Vậy tính phi kim tăng dần theo thứ tự: Y, Z, X.

