Các dạng bài tập Nhóm halogen chọn lọc có đáp án chi tiết - Hoá học lớp 10
Các dạng bài tập Nhóm halogen chọn lọc có đáp án chi tiết
Với Các dạng bài tập Nhóm halogen chọn lọc có đáp án chi tiết Hoá học lớp 10 tổng hợp các dạng bài tập, trên 300 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nhóm halogen từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Tổng hợp Lý thuyết chương Nhóm Halogen
Lý thuyết Tính chất của Hidro clorua (Axit Clohidric - HCl) và muối clorua
Phương pháp giải Các dạng bài tập chương Nhóm Halogen
- 7 dạng bài tập Halogen trong đề thi Đại học có lời giải
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế Halogen
- Dạng 2: Bài tập nhận biết, tách chất Nhóm Halogen
- Dạng 3: Hoàn thành phương trình hóa học về Halogen
- Dạng 4: Kim loại tác dụng với Halogen
- Dạng 5: Halogen tác dụng với muối của halogen yếu hơn
- Dạng 6: Muối halogen tác dụng với AgNO3
- Dạng 7: Bài tập về nhóm Halogen
- Bài tập về Clo cực hay, có lời giải chi tiết
- Bài tập về Flo, Brom, Iot cực hay, có lời giải chi tiết
- Bài tập về Axit clohidric HCl cực hay, có lời giải chi tiết
- Bài tập về Hợp chất có oxi của clo cực hay, có lời giải chi tiết
Bài tập trắc nghiệm
- 45 bài tập trắc nghiệm chương Nhóm Halogen có đáp án
- Bài tập về Halogen trong đề thi đại học có đáp án
- 100 câu trắc nghiệm Nhóm Halogen có lời giải chi tiết (cơ bản)
- 100 câu trắc nghiệm Nhóm Halogen có lời giải chi tiết (nâng cao)
Kim loại tác dụng với Halogen
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Một số lưu ý:
Khi kim loại tác dụng với các chất oxi hóa mạnh như F2, Cl2, Br2 sẽ được oxi hóa lên hóa trị cao nhất.
Ví dụ: 2Fe + 3Cl2 → 2FeCl3; Fe + 2HCl → FeCl2 + H2
Ví dụ minh họa
Ví dụ 1. Cho 5,25 gam hỗn hợp bột nhôm và magie vào dung dịch HCl dư, thu được 5,88 lít khí (đktc). Viết phản ứng xảy ra và tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu?
Hướng dẫn:
Gọi a là số mol của Al và b là số mol của Mg

Ví dụ 2: Cho 4,8 g một kim loại R thuộc nhóm IIA tác dụng hết với dung dịch HCl thu được 4,48 lít khí H2 (đktc).
a) Viết phương trình hóa học của phản ứng xảy ra và tính số mol hiđro thu được.
b) Xác định tên kim loại R.
c) Tính khối lượng muối khan thu được
Hướng dẫn:
a, PTHH: R + 2HCl → RCl2 + H2
nH2 = 4,48/22,4 = 0,2 mol
b, nR = nH2 = 0,2 mol
MR = 4,8/0,2 = 24 (Mg)
c, mMgCl2 = (24 + 71) . 0,2 = 19g
Ví dụ 3: Để hoà tan hoàn toàn 8,1g một kim loại X thuộc nhóm IIIA cần dùng 450 ml dung dịch HCl 2M, thu được dung dịch A và V lít khí H2 (đktc).
a) Xác định X
b) Tính giá trị V.
c) Tính nồng độ mol của dung dịch A, xem như thể tích dung dịch thay đổi không đáng kể.
Hướng dẫn:
a, PTHH: 2X + 6HCl → 2XCl3 + 3H2
nHCl = 0,45 .2 =0,9 mol ⇒ nX = 0,9/3= 0,3 mol
MX = 8,1 /0,3 = 27 (Al)
b, nH2 = 1/2nHCl =0,45 mol
VH2 = 0,45 .22,4 = 10,08 l
c, Dung dịch A là AlCl3
nAlCl3 = nX = 0,3 mol
CM = n/V = 0,3/0,45 = 0,67M
B. Bài tập trắc nghiệm
Câu 1. Lấy một lượng kim loại M tác dụng với khí clo dư thu được 39 gam muối clorua. Cũng lượng kim loại đó tác dụng với dung dịch HCl dư, cô cạn dung dịch thu được 39,48 gam muối clorua khan. Hỏi kim loại M đem dùng là gì?
Lời giải:
Đáp án:
Gọi α là số mol kim loại M tham gia trong mỗi thí nghiệm.
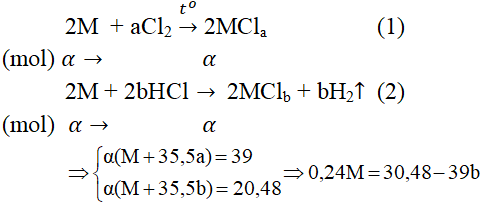
Bảng biện luận
| a | 1 | 1 | 2 | 2 | 3 | 3 |
| b | 1 | 2 | 1 | 3 | 2 | 1 |
| M | < 0 | < 0 | 91,5 | < 0 | 56(Fe) | 218,5 |
| Loại | Loại | Loại | Loại | Nhận | Loại |
Câu 2. Cho 16,2 gam nhôm phản ứng vừa đủ với 90,6 gam hỗn hợp hau halogen thuộc hai chu kì liên tiếp nhau trong bảng tuần hoàn. Xác định tên của halogen đem dùng.
Lời giải:
Đáp án:
Gọi công thức chung của hai halogen là: X−2 (gồm halogen A và B, giả sử MA < MB)
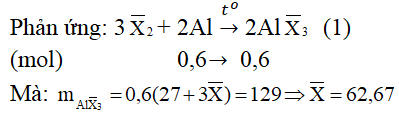
Suy ra: A là clo(35,5); B là brom (80)
Câu 3. Cho 2, 8 gam kim loại M (chưa biết hóa trị) tác dụng với khí clo dư thu được 8,125 gam muối clorua.
a. Hãy xác định kim loại M
b. Để hòa tan hết 8,4 gam kim loại M ở trên cần dùng bao nhiêu ml dung dịch HCl 20% (d = 1,1 g/ml) ?
Lời giải:
Đáp án:

+) Nếu n = 1 ⇒ M = 18,67 (loại)
+) Nếu n = 2 ⇒ M = 37,33 (loại)
+) Nếu n = 3 ⇒ M = 56 (Kim loại M là Fe)
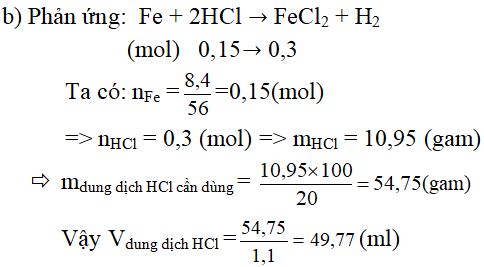
Câu 4. Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (ở đktc) đã phản ứng là bao nhiêu?
Lời giải:
Đáp án:
Bảo toàn khối lượng mCl2 = mMuối − mKL = 28,4 gm
⇒ nCl2 = 0,4 mol ⇒ V = 8,96 (l)
Câu 5. Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam magie và 8,1 gam nhôm tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của hai kim loại. Xác định thành phần phần trăm theo khối lượng và theo thể tích của hỗn hợp A.
Lời giải:
Đáp án:
Các phương trình hóa học:
Mg + Cl2 → MgCl2 (1)
2Al + 3Cl2 → AlCl3 (2)
3Mg + O2 → 2MgO (3)
4Al + 3O2 → 2AlO3 (4)
Khối lượng hỗn hợp sau phản ứng tăng = khối lượng oxi và clo tham gia phản ứng:
37, 05 – (4,80 + 8,10) = 24, 15 (gam)
nMg = 4,8/24 = 0,2(mol); nAl = 8,1/27 = 0,3 (mol);
Gọi số mol O2 trong hỗn hợp là x, số mol Cl2 là y
Phương trình nhường e:
Al → Al3+ + 3e
Mg → Mg2+ + 2e
Tổng số mol e nhường là: 0,2 × 2 + 0,3 × 3 = 1,3 (mol)
Phương trình nhận e:
O2 + 4e → 2O2-
Cl2 + 2e → 2Cl-
Tổng số mol e nhận là: 4x + 2y
Số e nhường = số e nhận nên: 4x + 2y = 1,3 (*)
Khối lượng Cl2 và O2 tham gia phản ứng là 24, 15 gam, ta có:
32x + 71y = 24,15 (**)
Kết hợp (*) và (**), ta có hệ phương trình:

Câu 6. Hòa tan 8,3 gam hỗn hợp gồm Al và Fe bằng dung dịch HC1 dư, thu được 5,6 lít H2 (đktc) và dung dịch A.
a. Tính phần trăm theo khối lượng mỗi muối trong hỗn hợp ban đầu.
b. Tính thể tích dung dịch HCl 2M đã dùng biết đã dùng dư 10cm3 so với lí thuyết.
c. Dẫn khí Cl2 dư vào dung dịch A. Cô cạn dung dịch sau phản ứng thì thu được bao nhiêu gam muối khan.
Lời giải:
Đáp án:
a)Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu:
Ta có: nH2 = 5,6/22,4 = 0,25(mol)
Gọi a là số mol của Al và b là số mol của Fe
Phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2 ↑ (1)
(mol) a → 3a 3a/2
Fe + 2HCl → FeCl2 + H2 ↑ (2)
(mol) b → 2b b
Gọi a là số mol của Al và b là số mol của Fe.
Theo đề bài, ta có hệ phương trình:
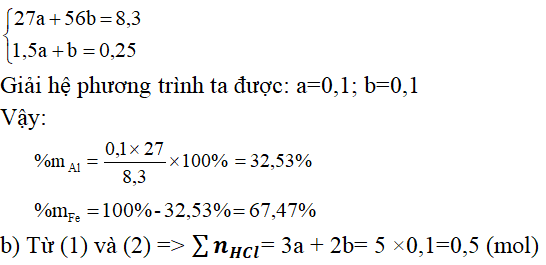
VHCl phản ứng = 0,5/2 = 0,25 (lít) = 250(ml)
Vậy VHCl đã dùng = 250 + 10 = 260 (ml)
c) Khối lượng muối khan:
Cl2 + AlCl3 → không phản ứng
Cl2 + 2FeCl2 → 2FeCl3
(mol) 0,1 → 0,1
Khối lượng muối khan thu được là:
mmuối khan = mAlCl3 + mFeCl3 = 0,1 ×(133,5 + 162,5) = 29,6 (gam)
Halogen tác dụng với muối của halogen yếu hơn
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
*Lưu ý : F2 không tác dụng được với muối của các halogen khác.
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
- Nên vận dụng phương pháp tăng giảm khối lượng để giải nhanh dạng bài này.
Ví dụ minh họa
Ví dụ 1. Dẫn Cl2 vào 200 gam dung dịch KBr. Sau khi phản ứng hoàn toàn khối lượng muối tạo thành nhỏ hơn khối lượng muối ban đầu là 4,45 gam. Nồng độ phần trăm KBr trong dung dịch ban đầu.
Hướng dẫn:
Cl2 + KBr → KCl + Br2
Áp dụng PP tăng giảm khối lượng ⇒ nMuối= 4,45 / (80-35,5) = 0,1 mol
⇒ mKBr = 0,1 . 119 =11,9 g
C%KBr = 11,9/200 = 5,95%
Ví dụ 2. Cho Cl2 tác dụng với 30,9 gam NaBr sau một thời gian thu được 26,45 gam muối X. Tính hiệu suất của phản ứng
Hướng dẫn:
Cl2 + NaBr → NaCl + Br2
nNaBr = 30,9/103 = 0,3 mol
nNaBr (phản ứng) = (30,9-26,45)/(80-35,5)= 0,1 mol
Hiệu suất của phản ứng là: 0,1/0,3 = 33,33%
Ví dụ 3. Hỗn hợp rắn A chứa KBr và KI. Cho hỗn hợp A vào nước brom lấy dư. Sau khi phản ứng xong, làm bay hơi dung dịch và nung nóng ta được sản phẩm rắn khan B. Khối lượng của B nhỏ hơn khối lượng A là m gam. Cho sản phẩm B vào nước clo lấy dư. Sau khi phản ứng xong, làm bay hơi dung dịch và nung nóng ta được sản phẩm rắn khan C. Khối lượng của C nhỏ hơn khối lượng B là m gam. Vậy % về khối lượng từng chất trong A là:
A. KBr 3,87%, KI 96,13% B. KBr 5,6%, KI 94,6%
C. KBr 3,22%, KI 96,88% D. KBr 4,4%, KI 95,6%
Hướng dẫn:
Gọi x, y là số mol của KBr và KI
Khi dẫn A vào nước Brom:
2KI + Br2 → 2KBr + I2
y y mol
Sản phẩm B chưa (x + y) mol KBr
Ta có: 119x + 166y – 119(x – y) = m
→ m = 47y (1)
Khi dẫn B vào nước clo
2KBr + Cl2 → 2KCl + Br2
x + y x + y
Theo đề ra: 119(x + y) – 74,5(x + y) = m
→ m = 44,5 (x + y) (2)
Từ (1) và (2) ta có: 44,5(x + y) = 47y hay 44,5x = 2,5y → y = 17,8x
%KBr = 119x/(119x + 166y) × 100% = 3,87%
%KI = 100% - 3,87% = 96,13%
B. Bài tập trắc nghiệm
Câu 1. Nước biển chứa một lượng nhỏ muối natri bromua. Bằng cách làm bay hơi nước biển, người ta thu được dung dịch chứa NaBr với hàm lượng 40g/l. Cần dùng bao nhiêu lít dung dịch đó và bao nhiêu lít khí clo (ở đktc) để điều chế 3 lít brom lỏng (khối lượng riêng 3,12 kg/l ).
Lời giải:
Đáp án:
Cl2 + 2NaBr → 2NaCl + Br2
nBr2 = (3.3,12.103)/160 = 58,5 mol
→ nCl2 = 58,5 mol ứng với VCl2 = 58,5.22,4 = 1310,4l
nNaBr = 2nBr2 = 2.58,5 = 117 mol
Ứng với Vdd NaBr = (117 .103)/40 = 301,275 ≈ 301,3l.
Câu 2. Có hỗn hợp muối NaCl và NaBr trong đó NaBr chiếm 20% khối lượng hỗn hợp. Hòa tan hỗn hợp vào nước, rồi cho khí clo lội qua dung dịch cho đến dư. Làm bay hơi dung dịch tới khi thu dược muối khan. Hãy cho biết khối lượng hỗn hợp đầu đã thay đổi bao nhiêu phần trăm?
Lời giải:
Đáp án:
Phản ứng:
Cl2 + 2NaBr → 2NaCl + Br2
Vì Cl2 dùng dư trên toàn bộ muối NaBr đã chuyển thành NaCl. Nghĩa là muối khan thu được chỉ chứa NaCl
Giả sử khối lượng của hỗn hợp ban đầu 100gam, trong đó khối lượng của NaBr là 20 gam và của NaCl là 80gam. Theo phản ứng ta có:
Cứ 103 gam NaBr tạo ra 58, 5 gam NaCl
20 gam NaBr tạo ra x gam NaCl
x = (20.58,5)/103 = 11,36 (gam)
Khối lượng muối khan là: 80 + 11,36 = 91, 36 (gam)
Khối lượng hỗn hợp ban đầu đã giảm: (100 - 91,36)/100 ×100 = 8,64%
Câu 3. Một hỗn hợp gồm 3 muối: NaF, NaCl và NaBr nặng 4,82 gam, đem hòa tan hoàn toàn chúng trong nước thu dược dung dịch A. Sục khí clo dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy một nửa lượng muối khan này hòa tan vào nước rồi cho phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. Viết các phản ứng xảy ra và tính thành phần phần trăm theo khối lượng mỗi muối trong hỗn hợp ban đầu.
Lời giải:
Đáp án:
Gọi a, b, c lần lượt là số mol của NaF, NaCl, NaBr
Khi dẫn khí Cl2 vào dung dịch A thì chỉ có NaBr phản ứng:
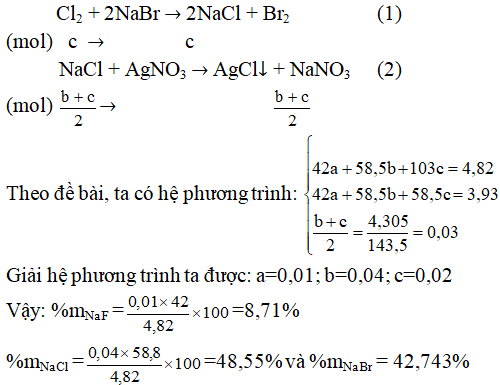
Câu 4. Cho 25 gam nước clo vào một dung dịch có chứa 2,5 gam KBr ta thấy dung dịch chuyển sang màu vàng.
a) Giải thích hiện tượng.
b) Cô cạn dung dịch sau thí nghiệm thì thu được 1,61 gam chất rắn khan. Giả sử toàn bộ clo trong nước clo đã tham gia phản ứng, hãy tính nồng độ phần trăm clo trong nước clo.
c) Tính khối lượng từng chất trong chất rắn khan thu được.
Lời giải:
Đáp án:
Phản ứng: Cl2 + 2KBr → 2KCl + Br2 (1)
(gam) 2×119 2×74,5
Hiện tượng: Phản ứng tạo ra brom làm dung dịch có màu càng
Theo phản ứng (1): Cứ 1 mol Cl2 tham gia phản ứng thì khối lượng muối tan trong dung dịch giảm
2×119 - 2×74,5 = 89 (gam)
Theo đề bài, khối lượng muối giảm: 2,5 – 1,61 = 0,98 (gam)
nCl2 phản ứng = nmuối = 0.98 / 98 = 0,01 (mol)
Vậy nồng độ phần trăm của Cl trong nước clo:
(0,01.71)/25 ×100% = 2,84%
Từ (1) ⇒ nKCl = 2 × nCl2 = 2 × 0,01 = 0,02(mol)
Vậy: mKCl = 0,02 × 74,5 = 1,49(gam); mKBr = 1,61 – 1, 49 = 0,12 (gam)
Câu 5. Cho Cl2 dư tác dụng hoàn toàn với 50 gam hỗn hợp X ( gồm NaCl và NaBr) thu được 41,1 gam muối khan Y. Tính % khối lượng của muối NaCl có trong X ?
Lời giải:
Đáp án:
Cl2 + NaBr → NaCl + Br2
nNaBr = (50-41,1)/(80-35,5) = 0,2 mol ⇒ mNaBr = 0,2 . 103= 20,6 mol
⇒ mNaCl = 50-20,6 = 29,4 g ⇒ %NaCl = 29,4/50=58,8%.
Muối halogen tác dụng với AgNO3
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Cần nhớ chỉ các muối Cl- , Br-, I- mới tạo kết tủa với dung dịch AgNO3. AgF tan nên muối F- không có phản ứng này.
- Sử dụng phương pháp tăng giảm khối lượng để giải nhanh dạng bài này.
Ví dụ minh họa
Ví dụ 1. Cho 3,87 gam hỗn hợp muối natri của hai hologen liên tiếp tác dụng với dung dịch AgNO3 dư thu được 6,63g kết tủa. Hai halogen kế tiếp là:
Hướng dẫn:
NaX + AgNO3 → AgX + NaNO3
mNaX = 3,87 , mAgX = 6,63
Áp dụng PP tăng giảm khối lượng ⇒ nNaX = (6,63-3,87)/(108-23)=0,324 mol
MNaX = 3,87/0,324 = 119,18 ⇒ MX = 96,1
⇒ 2 Halogen liên tiếp thỏa mãn là Br2 và I2
Ví dụ 2. Chất A là muối canxi halogenua. Cho dung dịch chứa 0,2 gam A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0,376 gam kết tủa bạc halogenua. Hãy xác định công thức chất A.
Hướng dẫn:
Phương trình hóa học:
CaX2 + 2AgNO3 → Ca(NO3)2 + 2AgX (X là halogen)
Áp dụng pp tăng giảm khối lượng:
Theo phương trình cứ 1 mol CaX2 tham gia phản ứng tạo 2 mol AgX.
Khối lượng AgX tăng so với khối lượng CaX2 là:
(2.108 + 2MX) – (40 – 2MX) = 176
Theo đề bài, số mol CaX2 tham gia phản ứng là:
(0,376-0,2)/176 = 10-3 (mol)
→ MCaX2 = 0,2/10-3 = 200 → 40 + 2MX = 200 → MX = 80
Vậy X là Brom (Br). Công thức của chất A là CaBr2
Ví dụ 3. Thêm 78ml dung dịch bạc nitrat 10% (khối lượng riêng 1,09 g/ml) vào một dung dịch có chứa 3,88g hỗn hợp kali bromua và natri iotua. Lọc bỏ kết tủa. Nước lọc phản ứng vừa đủ với 13,3 ml dung dịch axit clohiđric nồng độ 1,5 mol/1. Hãy xác định thành phần phần trăm khối lượng từng chất trong hỗn hợp muối ban đầu và tính thể tích hiđro clorua ở điều kiện tiêu chuẩn cần dùng để tạo ra lượng axit clohiđric đã dùng.
Hướng dẫn:
Ta có: nAgNO3= (78.1,09.10)/(100.170) = 0,05 mol; nHCl = 0,01333.1,5 = 0,0199 ≈ 0,02 mol
Phương trình hóa học:
AgNO3 + KBr → AgBr + KNO3 (1)
AgNO3 + NaI → AgI + NaNO3 (2)
AgNO3 + HCl → AgCl + HNO3 (3)
Gọi số mol KBr, NaI trong hỗn hợp lần lượt là x, y.
Theo đề bài: 119x + 150y = 3,88 (*)
Theo các phương trình (1), (2), (3): x + y + 0,02 = 0,05 (**)
Giải hệ, ta được: x = 0,02; y = 0,01
%mKBr = (0,02 .119)/3,88 . 100% = 61,34%; %mNaI = 100% - 61,34% = 38,66%
Vậy VHCl = 0,02 × 22,4 = 0,448 lít.
B. Bài tập trắc nghiệm
Câu 1. Cho 31,84 gam hỗn hợp NaX, NaY (X, Y là hai halogen ở 2 chu kỳ liên tiếp) vào dung dịch AgNO3 dư, thu được 57,34 gam kết tủa.
a) Tìm công thức của NaX, NaY.
b) Tính khối lượng mỗi muối.
Lời giải:
Đáp án:
a) Phương trình phản ứng của NaX và NaY với AgNO3.
NaX + AgNO3 → AgX↓ + NaNO3
a a
NaY + AgNO3 → AgY↓ + NaNO3
b b
- Lập hệ phương trình (gọi số mol NaX: a mol; số mol NaY: b mol)
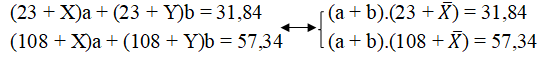
→ X− = 83,13
Vì X < X− < Y ⇔ X < 83,13 < Y
→ X = 80 < 83,13 nên X là brom và Y = 127 > 83,13 nên Y là iot.
Công thức của 2 muối là: NaBr và NaI.
b) ⇒ mNaBr = 0,28 × 103 = 28,84 g
mNaI = 0,02 × 150 = 3g
Câu 2. Một hỗn hợp ba muối NaF, NaCl, NaBr nặng 4,82 gam hòa tan hoàn toàn trong nước được dung dịch A. Sục khí clo dư vào dung dịch A rồi cô can hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy một nửa lượng muối khan này hòa tan vào nước rồi cho phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. Viết các phương trình xảy ra và tính thành phần trăm khối lượng mỗi muối trong hỗn hợp ban đầu.
Lời giải:
Đáp án:
Khi sục khí Cl2 vào dung dịch chứa hỗn hợp ở muối NaF, NaCl, NaBr chỉ có NaBr tác dụng.
Đặt số mol hỗn hợp ban đầu: NaF: a mol; NaCl: b mol; NaBr: c mol
Viết các phương trình phản ứng và lập hệ phương trình:

Câu 3. Có hỗn hợp gồm hai muối NaCl và NaBr. Khi cho dung dịch AgNO3 vừa đủ vào hỗn hợp trên người ta thu được lượng kết tủa bằng khối lượng AgNO3 tham gia phản ứng. Tìm % khối lượng mỗi muôi trong hỗn hợp ban đầu.
Lời giải:
Đáp án:
NaCl + AgNO3 → AgCl + NaNO3
a a a mol
NaBr + AgNO3 → AgBr + NaNO3
b b b mol
170a – 143,5a = 188b – 170b
26,5a = 18b
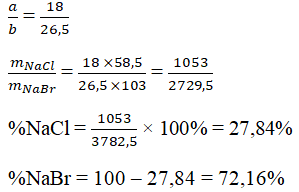
Câu 4. Cho 47,76 gam hỗn hợp gồm NaX, NaY (X, Y là hai halogen ở hai chu kì liên tiếp) vào dung dịch AgNO3 dư, thu được 86,01 gam kết tủa.
a) Tìm công thức của NaX, NaY.
b) Tính khối lượng mỗi muối
Lời giải:
Đáp án:
a) Gọi công thức của hai muối trên là: Na (MX < M− < MY).
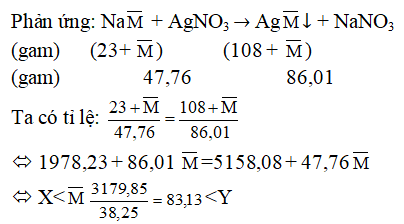
Vậy nghiệm hợp lý là: X: Brom(Br) và Y:Iot (I)
Công thức hai muối: NaBr và NaI
b) Theo đề bài, ta có hệ phương trình:
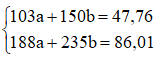
Giải hệ phương trình ta được: a = 0,42; b = 0,03
Vậy: mNaBr = 0,42 × 103= 43,26 (gam); mNaI = 0,03 × 150 = 4,5(gam)
Câu 5. Cho 300ml một dung dịch có hòa tan 5,85 gam NaCl tác dụng với 200ml dung dịch có hòa tan 34 gam AgNO3 , người ta thu được một kết tủa và nước lọc.
a) Tính khối lượng chất kết tủa thu được.
b) Tính nồng dộ mol chất còn lại trong nước lọc. Cho rằng thể tích nước lọc thu được không thể thay đổi đáng kể.
Lời giải:
Đáp án:
Ta có: nNaCl = 5,85/58,8 = 0,1(mol) và nAgNO3 = 34/170 = 0,2(mol)
a) Tính khối lượng kết tủa:
NaCl + AgNO3 → AgCl↓ + NaNO3
(mol) 0,1 → 0,1→ 0,1→ 0,1
Từ (1) ⇒ nAgCl = 0,1(mol) ⇒ mAgCl↓ = 0,1 × 143,5 = 14,35 (gam)
b) Ta có: Vdung dịch = 300 + 200= 500(ml) = 0,5 (lít)
Từ (1) ⇒ Dung dịch thu được chứa: NaNO3 = 0,1(mol) và AgNO3dư: 0,2-0,1 = 0,1(mol)
Vậy: CM(NaNO3) = CM(AgNO3)dư = 0,1/0,5 = 0,2
Câu 6. Cho 3,87 gam hỗn hợp muối natri của hai halogen liên tiếp tác dụng với dung dịch AgNO3 dư thu được 6,63g kết tủa . Tìm tên hai halogen .
Lời giải:
Đáp án:
Gọi x là số mol NaX
TH1: cả 2 halogen đều tạo kết tủa
NaX → AgX
3,87 6,63 g
Phương pháp tăng giảm khối lượng:
Δm = 6,63 – 3,87 = 2,76g = x.(108 – 23)
⇒ x = 0.0325 mol
MNaX = 3,87/0,0325 = 119 ⇒ Xtb = 96 ⇒ 2 halogen : Br và I.
TH2: chỉ có 1 halogen tạo kết tủa ⇒ 2 halogen là F và Cl
⇒ nAgCl = 0,042 mol ⇒ nNaCl = 0,042 mol
⇒ mNaCl = 0,042 . 58,5 = 2,458g
⇒ mNaF = 1,411g thỏa mãn
⇒ Có 2 cặp nghiệm thỏa mãn
Câu 7. Cho 78 ml dung dịch AgNO3 10% (d = 1,09) vào một dung dịch có chứa 3,88 gam hỗn hợp KBr và KI. Lọc kết tủa, nước lọc có thể phản ứng vừa đủ với 13,3 ml dung dịch HCl 1,5M. Vậy % khối lượng từng muối là:
A. KBr 72,8%, NaI 27,62% B. KBr 61,3%, NaI 38,7%
C. KBr 38,7%, NaI 61,3% D. KBr 59,3%, NaI 40,7%
Lời giải:
Đáp án:
Số mol các chất:
nAgNO3= (78 ×1,09 ×10)/(100 ×170) = 0,05 mol
nHCl = 0,01995 mol
Gọi a, b là số mol của KBr và KI trong hỗn hợp.
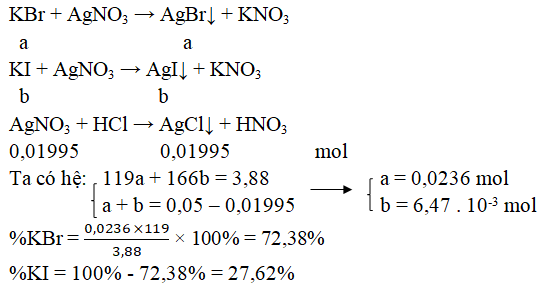
Câu 8. Hòa tan một muối kim loại halogenua chưa biết hóa trị vào nước để được dung dịch X. Nếu lấy 250 ml dung dịch X (chứa 27 gam muối) cho vào AgNO3 dư thì thu được 57,4 gam kết tủa. Mặt khác điện phân 125 ml dung dịch X trên thì có 6,4 gam kim loại bám ở catot. Xác định công thức muối.
Lời giải:
Đáp án:
Đặt ký hiệu kim loại là B, halogen là X.
Công thức của muối sẽ là BXn
BXn + AgNO3 → nAgX↓ + B(NO3)n
27 57,4 g
→13,5 28,7 g
BXn → B + nX
13,5 6,4 7,1 g
Trong 13,5g BXn có 7,1g X vậy trong đó 28,7 g AgX cũng chỉ có 7,1g X
→ mAg = 28,7 – 7,1 = 21,6g → nAg = 0,2 mol
Trong AgX tỉ lệ kết hợp theo số mol nAg : nX = 1 : 1 → nX = 0,2 mol
MX = 7,1/0,2 = 35,5 ⇒ X là Clo
BCln + nAgNO3 → nAgCl↓ + B(NO3)n
0,2/n 0,2 mol
MBCln = 13,5/(0,2/n) = 67,5n → MB + 35,5n = 67,5n; MB = 32n
Nếu n = 1 → MB = 32 (loại)
Nếu n = 2 → MB = 64 → B là Cu

