Tổng hợp Lý thuyết chương Bảng tuần hoàn các nguyên tố hóa học - Hoá học lớp 10
Tổng hợp Lý thuyết chương Bảng tuần hoàn các nguyên tố hóa học
Tài liệu Tổng hợp Lý thuyết chương Bảng tuần hoàn các nguyên tố hóa học Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Bảng tuần hoàn các nguyên tố hóa học từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.
Lý thuyết Sự biến đổi tuần hoàn một số tính chất của các nguyên tố
Sự biến đổi một số đại lượng vật lí của các nguyên tố hóa học
Sự biến đổi tính kim loại, tính phi kim của các nguyên tố hóa học. Định luật tuần hoàn
Lý thuyết Bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng. (chu kì)
- Các nguyên tố có cùng số e hóa trị trong nguyên tử được xếp thành một cột. (nhóm)
II. Cấu tạo bảng tuần hoàn
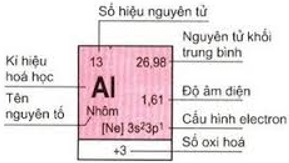
1. Ô nguyên tố
Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân).
2. Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
* Chu kì nhỏ: gồm chu kì 1, 2, 3.
* Chu kì lớn: gồm chu kì 4, 5, 6, 7.
Ví dụ: 12Mg: 1s2/2s22p6/3s2.
→ Mg thuộc chu kì 3 vì có 3 lớp electron.
3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
+ Nhóm A: bao gồm các nguyên tố s và p.
Số thứ tự nhóm A = tổng số e lớp ngoài cùng.
+ Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng dạng (n – 1)dxnsy:
* Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
* Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
* Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
- Khối các nguyên tố s, p, d, f
- Khối các nguyên tố s: gồm các nguyên tố nhóm IA và IIA
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
Ví dụ: 11Na: 1s22s22p63s1
- Khối các nguyên tố p: gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He).
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
Ví dụ: 13Al: 1s22s22p63s23p1
- Khối các nguyên tố d: gồm các nguyên tố thuộc nhóm B.
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
Ví dụ: 26Fe: 1s22s22p63s23p63d64s2
- Khối các nguyên tố f: gồm các nguyên tố thuộc họ Lantan và họ Actini.
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
Ví dụ: 58Ce: 1s22s22p63s23p63d104s24p64f25s25p66s2
Lý thuyết Sự biến đổi tuần hoàn cấu hình electron nguyên tử
I. Sự biến đổi tuần hoàn cấu hình electron nguyên tử
- Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A đựơc lặp đi lặp lại sau mỗi chu kì ⇒ ta nói chúng biến đổi một cách tuần hoàn.
- Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
II. Cấu hình electron nguyên tử của các nguyên tố nhóm A
1. Các nguyên tố nhóm A: nguyên tố s và p
- Số thứ tự nhóm = số electron hóa trị = số electron lớp ngoài cùng.
- Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố.
a/ Nhóm IA (Nhóm Kim Loại kiềm)
- Gồm các nguyên tố: Li, Na, K, Rb, Cs, Fr
- Cấu hình e lớp ngoài cùng chung: ns1 ⇒ Dễ nhường 1 electron để đạt cấu trúc bền vững của khí hiếm.
- Tính chất hoá học:
+ Tác dụng với oxi tạo oxít bazơ
+ Tác dụng với Phi kim tạo muối
+ Tác dụng với nuớc tạo hiđroxít + H2
c/ Nhóm VIIA (Nhóm Halogen)
- Gồm các nguyên tố: F, Cl, Br, I, At
- Cấu hình e lớp ngoài cùng chung: ns2np5 ⇒ Dễ nhận 1 electron để đạt cấu trúc bền vững của khí hiếm.
- Tính chất hoá học:
+ Tác dụng với oxi tạo oxít axít
+ Tác dụng với kim loại tạo muối
+ Tác dụng với H2 tạo hợp chất khí.
c/ Nhóm VIIIA (Nhóm khí hiếm)
- Gồm các nguyên tố: He, Ne, Ar, Kr, Xe, Rn
- Cấu hình e lớp ngoài cùng chung: ns2np6 (trừ He)
- Hầu hết các khí hiếm không tham gia phản ứng hoá học, tồn tại ở dạng khí, phân tử chỉ 1 nguyên tử.
III. Cấu hình electron nguyên tử của các nguyên tố nhóm B
Các nguyên tố nhóm B: nguyên tố d và f (còn gọi là các kim loại chuyển tiếp)
- Cấu hình electron nguyên tử có dạng : (n–1)dans2
- Số electron hóa trị = số electron lớp n + số electron phân lớp (n–1)d nhưng chưa bão hòa.
Đặt S = a + 2 , ta có :
+ S ≤ 8 thì S = số thứ tự nhóm.
+ 8 ≤ S ≤ 10 thì nguyên tố ở nhóm VIII B.


