Lý thuyết Liên kết cộng hóa trị - Hoá học lớp 10
Lý thuyết Liên kết cộng hóa trị
Tài liệu Lý thuyết Liên kết cộng hóa trị Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Liên kết cộng hóa trị từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Sự hình thành liên kết cộng hóa trị bằng cặp electron chung
1. Sự hình thành phân tử đơn chất
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
- Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị.
- Các phân tử đơn chất tạo nên từ các nguyên tử của cùng một nguyên tố (có độ âm điện như nhau), nên các cặp electron chung không bị hút lệch về phía nguyên tử nào. Do đó, liên kết trong các phân tử đó không bị phân cực. Đó là liên kết cộng hóa trị không cực.
2. Sự hình thành phân tử hợp chất
- Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
- Với những phân tử có cấu tạo thẳng như CO2: Liên kết giữa hai nguyên tử oxi và cacbon là phân cực, nhưng phân tử CO2 có cấu tạo thẳng nên độ phân cực của hai liên kết đôi (C=O) triệt tiêu nhau, kết quả là toàn bộ phân tử không bị phân cực.
- Liên kết cho - nhận
+ Trong một số trường hợp, cặp electron chung chỉ do một nguyên tử đóng góp thì liên kết giữa hai nguyên tử là liên kết cho - nhận.
+ Điều kiện để có liên kết cho – nhận:
* Có nguyên tử còn dư một cặp electron chưa sử dụng.
* Có nguyên tử còn thiếu một cặp electron.
Ví dụ: Đối với phân tử SO2 công thức electron, công thức cấu tạo có thể biểu diễn như sau:
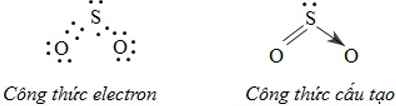
3. Tính chất của các chất có liên kết cộng hóa trị
- Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn như đường, lưu huỳnh, iot, ... có thể là chất lỏng: nước, ancol,... hoặc chất khí như khí cacbonic, clo, hiđro, ...
- Các chất có cực như ancol etylic, đường, ... tan nhiều trong dung môi có cực như nước.
- Phần lớn các chất không cực như iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua, ...
- Nói chung, các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
II. Liên kết cộng hóa trị và sự xen phủ các obitan nguyên tử
1. Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử đơn chất
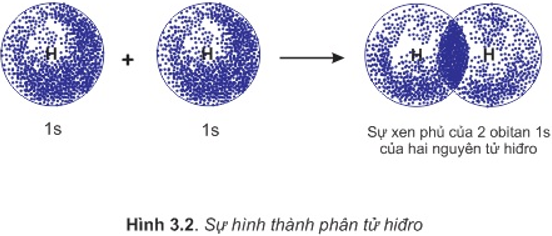
a. Sự hình thành phân tử H2
- Để hình thành liên kết giữa hai nguyên tử H trong phân tử hiđro, hai obitan 1s của hai nguyên tử H xen phủ với nhau tạo ra vùng xen phủ giữa hai hạt nhân nguyên tử.
- Ngoài lực đẩy tương hỗ giữa hai proton và hai electron còn có lực hút giữa các electron vơi hai hạt nhân hướng về tâm phân tử.
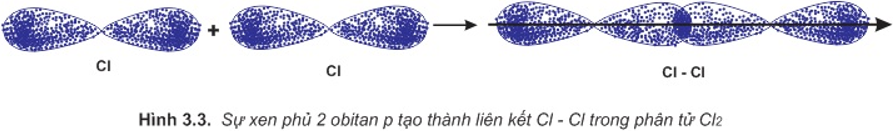
b. Sự hình thành phân tử Cl2

Để giải thích sự hình thành liên kết Cl−Cl, có thể dựa vào cấu hình electron của mỗi nguyên tử clo:
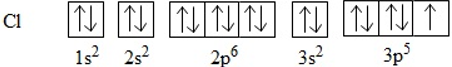
Sự hình thành liên kết giữa hai nguyên tử clo là do sự xen phủ giữa hai obitan p chứa electron độc thân của mỗi nguyên tử clo:
2. Sự xen phủ của các obitan nguyên tử khi hình thành các phân tử hợp chất
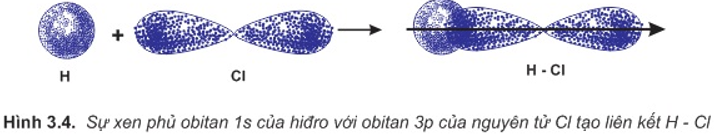
a. Sự hình thành phân tử HCl
Liên kết hóa học trong phân tử hợp chất HCl được hình thành nhờ sự xenphủ giữa obitan 1s của nguyên tử hiđro và obitan 3p có 1 electron độc thân của nguyên tử clo.
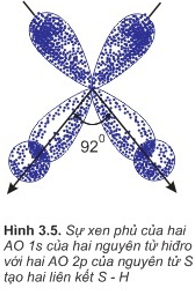
b. Sự hình thành phân tử H2S
- Là sự xen phủ giữa obitan 1s của các nguyên tử hiđro và 2 obitan p của nguyên tử lưu huỳnh.
- 2 obitan p có 2 electron độc thân của nguyên tử S xen phủ với 2 obitan 1s có của 2 nguyên tử H tạo nên liên kết S−H.