Lý thuyết Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị - Hoá học lớp 10
Lý thuyết Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
Tài liệu Lý thuyết Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Hạt nhân nguyên tử
1/ Điện tích hạt nhân
Điện tích hạt nhân chính là tổng điện tích của proton.
Z = số proton = số electron = E (Nguyên tử trung hòa về điện)
Ví dụ: Nguyên tử Na có: Z =13 => Nguyên tử Na có 13 proton và 13 electron.
2/ Số khối
Số khối của hạt nhân bằng tổng số proton (Z) với tổng số nơtron (N).
A = Z + N
Ví dụ: Hạt nhân nguyên tử Nhôm có 13 proton và 14 notron.
⇒ Số khối A = 13 + 14 = 27
II. Nguyên tố hóa học
1/ Định nghĩa
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
- Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.

2/ Số hiệu nguyên tử
- Là số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố.
- Số hiệu nguyên tử cho biết:
+ Số proton trong hạt nhân nguyên tử
+ Số electron trong nguyên tử
+ Từ đó cũng xác định được số notron trong nguyên tử
Z = số proton = số electron = E (Nguyên tử trung hòa về điện)
N = A – Z (A là số khối, Z là số hiệu nguyên tử)
3/ Kí hiệu nguyên tử của nguyên tố X.
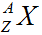
Trong đó:
A: Số khối
Z: Số hiệu nguyên tử
X: Kí hiệu hóa học của nguyên tố
Ví dụ: 168O ⇒ nguyên tử Oxi có số khối A = 16 và số hiệu nguyên tử Z = 8
....................................
....................................
....................................

