Lý thuyết Luyện tập về: thành phần cấu tạo nguyên tử. Khối lượng của nguyên tử. Obitan nguyên tử - Hoá học lớp 10
Lý thuyết Luyện tập về: thành phần cấu tạo nguyên tử. Khối lượng của nguyên tử. Obitan nguyên tử
Tài liệu Lý thuyết Luyện tập về: thành phần cấu tạo nguyên tử. Khối lượng của nguyên tử. Obitan nguyên tử Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Luyện tập về: thành phần cấu tạo nguyên tử. Khối lượng của nguyên tử. Obitan nguyên tử từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

1/ Cấu tạo nguyên tử
Nguyên tử có cấu taọ phức tạp gồm hai phần: Vỏ và Hạt nhân.
a) Vỏ nguyên tử: gồm các hạt electron mang điện âm (kí hiệu là e) chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định nào.
b) Hạt nhân nguyên tử: gồm nơtron và proton.
qe = 1-; qp = 1+; qn = 0
Điện tích của hạt nhân nguyên tử chỉ phụ thuộc vào số proton có trong hạt nhân của nguyên tử ⇒ Hạt nhân mang điện dương.
2/ Kích thước: nguyên tử có dạng hình cầu → rất nhỏ.
Đơn vị đo: Nanomet (nm) và Angstrom (Å).
1nm = 10-9m và 1Å = 10-10m ⇒ 1nm = 10Å
3/ Khối lượng: Rất nhỏ
1 đvC hay 1u = 1/12 . m12C = 1,6605.10-27 không gian.
Khối lượng e rất nhỏ có thể bỏ qua – vậy khối lượng nguyên tử tập trung vào hạt nhân.
4/ Trong nguyên tử:
- Số Electron = Số Proton.
- Số khối: A = Z + N.
- Số đơn vị ĐTHN nguyên tử của một nguyên tố được coi là số hiệu nguyên tố đó.
SHNT (Z) = Số đơn vị ĐTHN = số proton = số electron

5/ Kí hiệu nguyên tử
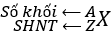
6/ Đồng vị
Đồng vị là những nguyên tử của cùng một nguyên tố hóa học có cùng số proton (hay ĐTHN Z) nhưng khác nhau về số nơtron (hay số khối A).
Công thức tính nguyên tử khối trung bình của một nguyên tố có nhiều đồng vị:
A1X (x%), A2X (y%), A3X (z%)…
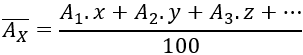
7/ Obitan nguyên tử
- Khu vực xung quanh hạt nhân mà tại đó xác suất có mặt của electron là lớn nhất được goi là obitan nguyên tử.
- Obitan s có dạng hình cầu, obitan p có dạng hình số 8 nổi, obitan d, f có hình phức tạp.

