Tóm tắt Lý thuyết Hóa 10 chương 3 - Hoá học lớp 10
Tóm tắt Lý thuyết Hóa 10 chương 3
Tài liệu Tóm tắt Lý thuyết Hóa 10 chương 3 Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Tóm tắt Lý thuyết Hóa 10 chương 3 từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. So sánh liên kết ion, liên kết cộng hóa trị và liên kết kim loại
1. So sánh liên kết ion, liên kết cộng hóa trị
a. Giống nhau: Liên kết ion và liên kết CHT giống nhau về nguyên nhân hình thành liên kết. Các nguyên tử liên kết với nhau tạo thành phân tử để có cấu hình electron bền vững của khí hiếm.
b. Khác nhau: Liên kết ion và liên kết CHT khác nhau về bản chất liên kết và điều kiện liên kết:
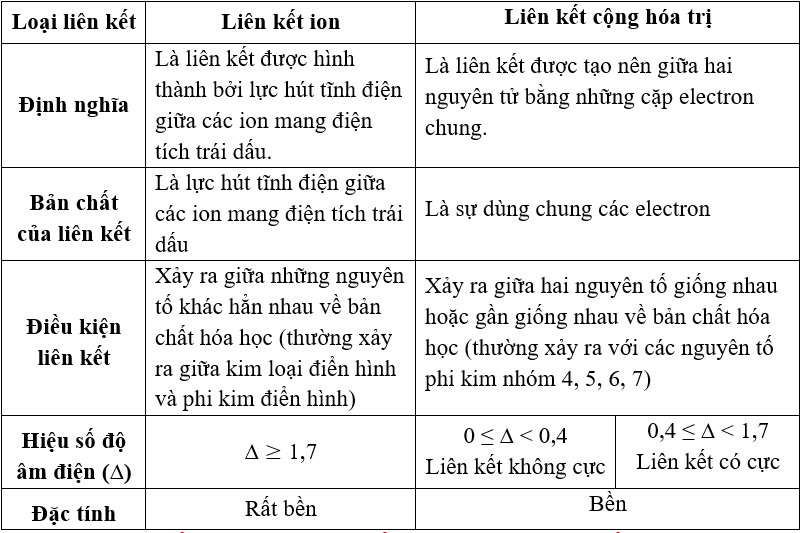
2. So sánh liên kết kim loại với liên kết cộng hóa trị và liên kết ion
- Liên kết kim loại và liên kết cộng hóa trị giống nhau là có những electron chung của các nguyên tử. Nhưng electron chung trong liên kết kết kim loại là của tất cả những nguyên tử kim loại có mặt trong đơn chất.
- Liên kết kim loại và liên kết ion cũng là lực hút tĩnh điện giữa các phần tử điện tích trái dấu. Khác nhau, các phần tử tích điện trái dấu trong liên kết KL là ion dương và các electron tự do.
II. Hóa trị và số oxi hóa
1. Hóa trị trong hợp chất ion
- Hóa trị của nguyên tố trong hợp chất ion được gọi là điện hóa trị.
- Điện hóa trị của một nguyên tố bằng số electron mà nguyên tử cả nguyên tố đó nhường hoặc thu để tạo thành ion.

2. Hóa trị trong hợp chất cộng hóa trị
- Hóa trị của một nguyên tố trong hợp chất cộng hóa trị được gọi là cộng hóa trị.
- Cộng hóa trị của một nguyên tố bằng số liên kết mà nguyên tử của nguyên tố đó tạo ra được với nguyên tử của nguyên tố khác trong phân tử.
3. Số oxi hóa
- Số oxi hóa của một nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định liên kết giữa các nguyên tử trong phân tử là liên kết ion.
- Cách xác định số oxi hóa:
+ Quy tắc 1: Số OXH của các nguyên tố trong các đơn chất bằng 0.
+ Quy tắc 2: Trong 1 phân tử, tổng số OXH của các nguyên tố bằng 0.
+ Quy tắc 3: Số OXH của các ion đơn nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử , tổng số OXH của các nguyên tố bằng điện tích của ion.
+ Quy tắc 4: Trong hầu hết các hợp chất, số OXH của H bằng +1 , trừ 1 số trường hợp như hidrua, kim loại (NaH, CaH2, …). Số OXH của O bằng –2 trừ trường hợp OF2, peoxit (chẳng hạn H2O2 …).

