Lý thuyết Phản ứng oxi hóa khử - Hoá học lớp 10
Lý thuyết Phản ứng oxi hóa khử
Tài liệu Lý thuyết Phản ứng oxi hóa khử Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Phản ứng oxi hóa khử từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Phản ứng oxi hóa - khử
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất trong phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
- Chất khử (chất bị oxh) là chất nhường electron
- Chất oxh (chất bị khử) là chất thu electron.
- Quá trình oxh (sự oxh) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình thu electron.
Ví dụ:
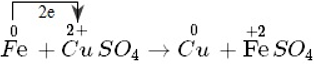
Quá trình thay đổi số oxi hóa:
Fe0 → Fe2+ + 2e
- Số oxi hóa của sắt tăng từ 0 đến +2. Nguyên tử sắt là chất khử. Sự làm tăng số oxi hóa của sắt được gọi là sự oxi hóa nguyên tử sắt.
- Nguyên tử sắt nhường electron, là chất khử. Sự nhường electron của nguyên tử sắt được gọi là sự oxi hóa nguyên tử sắt.
Cu2+ + 2e → Cu
- Số oxi hóa của đồng giảm từ +2 xuống 0. Ion đồng là chất oxi hóa. Sự làm giảm số oxi hóa của ion đồng được gọi là sự khử ion đồng.
- Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
⇒ Phản ứng của sắt với dung dịch đồng sunfat cũng là phản ứng oxi hóa - khử vì tồn tại đồng thời sự oxi hóa và sự khử.

II. Lập phương trình hóa học của phản ứng oxi hóa khử
Bước 1: Xác định số oxh của các nguyên tố để tìm chất oxi hoá và chất khử.
Bước 2: Viết quá trình oxh và quá trình khử, cân bằng mỗi quá trình.
Bước 3: Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH.
Ví dụ: Lập PTHH của phản ứng oxi hoá khử sau:
NH3 + Cl2 → N2 + HCl
Bước 1:

Số oxh của N tăng từ -3 lên 0: Chất khử.
Số oxh của Cl giảm từ 0 xuống -1: Chất oxh.
Bước 2:
Quá trình oxi hóa :
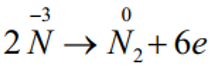
Quá trình khử:
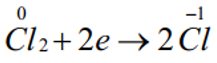
Bước 3:
Quá trình oxi hóa:
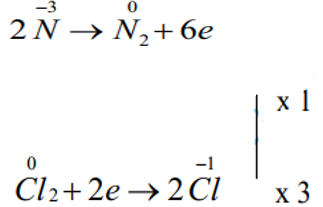
Bước 4: Viết PTHH
2NH3 + 3Cl2 → N2 + 6HCl
III. Ý nghĩa của phản ứng oxi hóa – khử
- Phản ứng oxi hóa - khử là một trong những quá trình quan trọng nhất của thiên nhiên:
Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hàng loạt quá trình sinh học khác đều có cơ sở là các phản ứng oxi hóa - khử.
- Ngoài ra: Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xảy ra trong pin và trong ăcquy đều bao gồm sự oxi hóa và sự khử.
Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học, ... đều không thực hiện được nếu thiếu các phản ứng oxi hóa - khử.

