Lý thuyết Tốc độ phản ứng hóa học - Hoá học lớp 10
Lý thuyết Tốc độ phản ứng hóa học
Tài liệu Lý thuyết Tốc độ phản ứng hóa học Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Tốc độ phản ứng hóa học từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Khái niệm về tốc độ phản ứng hóa học
1. Tốc độ phản ứng
- Tốc độ phản ứng là độ biến thiên nồng độ của một chất trong các phản ứng hoặc sản phẩm trong một đơn vị thời gian. Trong đó theo quy ước: nồng độ theo mol/lít, thời gian có thể là giây (s), phút (ph), giờ (h)... Tốc độ phản ứng được xác định bằng thực nghiệm.
2. Tốc độ trung bình
- Tốc độ trung bình của phản ứng hóa học là tốc độ biến thiên trung bình nồng độ của một chất trong khoảng thới gian t1 đến t2.
Ví dụ: Xét phản ứng aA → bB
Nếu tính tốc độ phản ứng theo chất A: Ở thời điểm t1 chất A có nồng độ C1 mol/lít, ở thời điểm t2 chất A có nồng độ C2 mol/lít. Tốc độ trung bình của phản ứng là:
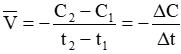
Còn nếu tính tốc độ phản ứng theo chất B thì tốc độ trung bình của phản ứng là:
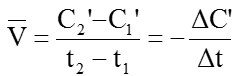
Để tốc độ phản ứng là đơn giá trị người ta sử dụng biểu thức:
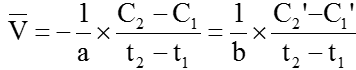
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Khi tăng nồng độ của chất phản ứng thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất khí tham gia, khi tăng áp suất thì tốc độ phản ứng tăng.
- Khi tăng nhiệt độ thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất rắn tham gia thì khi tăng diện tích bề mặt, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng không tiêu hao trong quá trình phản ứng.
- Chất ức chế phản ứng là chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong quá trình phản ứng.

III. Ý nghĩa thực tiễn của tốc độ phản ứng
Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng nhiều trong đời sống và sản xuất.
Ví dụ: Thực phẩm nấu trong nồi áp suất nhanh chín hơn khi nấu áp suất thường.
Các chất đốt như than, củi cháy nhanh hơn khi có kích thước nhỏ.

