Lý thuyết Bảng tuần hoàn các nguyên tố hóa học - Hoá học lớp 10
Lý thuyết Bảng tuần hoàn các nguyên tố hóa học
Tài liệu Lý thuyết Bảng tuần hoàn các nguyên tố hóa học Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Bảng tuần hoàn các nguyên tố hóa học từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng. (chu kì)
- Các nguyên tố có cùng số e hóa trị trong nguyên tử được xếp thành một cột. (nhóm)
II. Cấu tạo bảng tuần hoàn
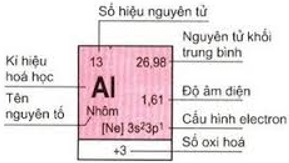
1. Ô nguyên tố
Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân).
2. Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
* Chu kì nhỏ: gồm chu kì 1, 2, 3.
* Chu kì lớn: gồm chu kì 4, 5, 6, 7.
Ví dụ: 12Mg: 1s2/2s22p6/3s2.
→ Mg thuộc chu kì 3 vì có 3 lớp electron.

3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
+ Nhóm A: bao gồm các nguyên tố s và p.
Số thứ tự nhóm A = tổng số e lớp ngoài cùng.
+ Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng dạng (n – 1)dxnsy:
* Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
* Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
* Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
- Khối các nguyên tố s, p, d, f
- Khối các nguyên tố s: gồm các nguyên tố nhóm IA và IIA
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
Ví dụ: 11Na: 1s22s22p63s1
- Khối các nguyên tố p: gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He).
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
Ví dụ: 13Al: 1s22s22p63s23p1
- Khối các nguyên tố d: gồm các nguyên tố thuộc nhóm B.
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
Ví dụ: 26Fe: 1s22s22p63s23p63d64s2
- Khối các nguyên tố f: gồm các nguyên tố thuộc họ Lantan và họ Actini.
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
Ví dụ: 58Ce: 1s22s22p63s23p63d104s24p64f25s25p66s2

