Lý thuyết Tính chất của Hidro clorua (Axit Clohidric - HCl) và muối clorua - Hoá học lớp 10
Lý thuyết Tính chất của Hidro clorua (Axit Clohidric - HCl) và muối clorua
Tài liệu Lý thuyết Tính chất của Hidro clorua (Axit Clohidric - HCl) và muối clorua Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Tính chất của Hidro clorua (Axit Clohidric - HCl) và muối clorua từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Hidro clorua
- Hiđro clorua (HCl) là chất khí, không màu, mùi xốc tan nhiều trong nước tạo thành dung dịch axit mạnh HCl; Nặng hơn không khí.
II. Axit Clohidric (HCl)
1/ Tính chất vật lí
- Hiđro clorua (HCl) tan vào nước tạo thành dung dịch Axit Clohidric (HCl).
- Axit HCl là chất lỏng không màu, dễ bay hơi. Dung dịch axit HCl không màu, HCl đặc bốc khói trong không khí ẩm.
2/ Tính chất hóa học
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
a/ Tác dụng chất chỉ thị:
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
b/ Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 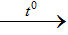
2Al + 6HCl 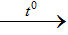
Cu + HCl → không có phản ứng
c/ Tác dụng với oxit bazo và bazo:
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 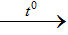
Fe2 O3 + 6HCl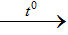
d/ Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 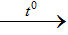
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3

3/ Điều chế
a/ Phương pháp sunfat: cho NaCl tinh thể vào dung dịch H2SO4 đậm đặc
2NaCltt + H2SO4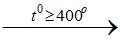
NaCltt + H2SO4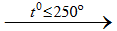
b/ Phương pháp tổng hợp: đốt hỗn hợp khí hidro và khí clo
H2 + Cl2
III. Muối clorua và nhận biết ion clorua
- Muối của axit clohiđric được gọi là muối clorua. Chứa ion âm clorua (Cl-) và các ion dương kim loại, NH4+như NaCl, ZnCl2 CuCl2,AlCl3
- Công thức tổng quát: MCln.
- Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2 Cl2.
- Để nhận biết ion Cl-có thể dùng thuốc thử là dung dịch AgNO3 do tạo thành AgCl kết tủa trắng (AgCl tan trong dung dịch amoniac do tạo phức với NH3):
AgNO3 + NaCl → AgCl + NaNO3
* Ứng dụng:
- NaCl dùng để ăn, sản xuất Cl2, NaOH, axit HCl
- KCl phân kali
- ZnCl2 tẩy gỉ khi hàn, chống mục gỗ.
- BaCl2 chất độc
- CaCl2 chất chống ẩm
- AlCl3 chất xúc tác

