Lý thuyết Khái quát về nhóm Halogen - Hoá học lớp 10
Lý thuyết Khái quát về nhóm Halogen
Tài liệu Lý thuyết Khái quát về nhóm Halogen Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Khái quát về nhóm Halogen từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Nhóm halogen trong bảng tuần hoàn các nguyên tố
- Gồm có các nguyên tố 9F 17Cl 35Br 53I 85At. Phân tử dạng X2 như F2 khí màu lục nhạt, Cl2 khí màu vàng lục, Br2 lỏng màu nâu đỏ, I2 tinh thể tím.
II. Cấu hình electron nguyên tử và cấu tạo phân tử của các nguyên tố trong nhóm halogen
- Cấu hình electron lớp ngoài cùng của nguyên tử các halogen là ns2np5
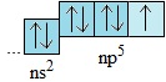
- Dễ nhận thêm một electron để đạt cấu hình bền vững của khí hiếm
X + 1e → X- (X: F, Cl, Br, I)
- Ở trạng thái cơ bản, nguyên tử các halogen đều có một electron độc thân.
- Lớp electron ngoài cùng của nguyên tử flo là lớp thứ hai nên không có phân lớp d. Nguyên tử clo, brom và iot có phân lớp d còn trống, khi được kích thích 1, 2 hoặc 3 electron có thể chuyển đến những obitan d còn trống:
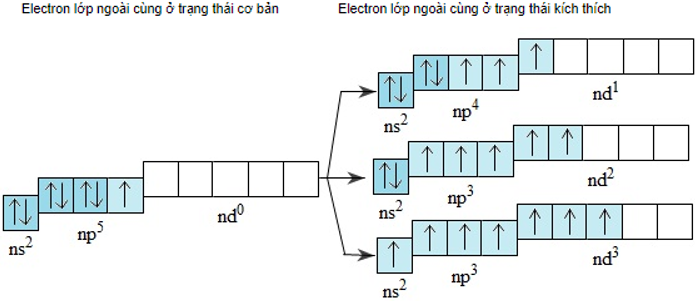
Do đó ở các trạng thái kích thích, nguyên tử clo, brom hoặc iot có thể có 3, 5 hoặc 7 electron độc thân.
III. Khái quát về tính chất của các halogen
1. Tính chất vật lý
- Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần từ F đến I.
- Nguyên tử halogen có 7e lớp ngoài cùng ns2np5, bán kính nguyên tử nhỏ, có độ âm điện lớn ⇒ dễ nhận e, halogen có tính oxi hóa mạnh và là phi kim điển hình.
Ion halogenua X- có mức oxi hóa thấp nhất nên thể hiện tính khử.
| I2 Br2 Cl2 F2 | Tính oxi hóa tăng dần |
| 2I- 2Br- 2Cl- 2F- | Tính khử giảm dần |
- Lí tính:
| Halogen | F2 | Cl2 | Br2 | I2 |
| Trạng thái | Khí | Khí | Lỏng | Rắn |
| Màu sắc | Xanh nhạt | Vàng lục | Đỏ nâu | Tím than |
- Giữa các phân tử X2 chỉ có lực hút Van der Waals yếu nên các halogen hoặc ở trạng thái khí (F2, Cl2) hoặc ở trạng thái lỏng (Br2) dễ bay hơi, cũng có thể ở trạng thái rắn(I2) dễ thăng hoa.
- Tính tan: Flo phân hủy nước rất mạnh nên không tan trong nước.
Các halogen khác tan tương đối ít trong nước và tan nhiều trong dung môi hữu cơ.

2. Tính chất hóa học
- Cấu hình e lớp ngoài cùng tương tự nhau nên các halogen có nhiều điểm giống nhau về tính chất hóa học:
+ Có 7 e lớp ngoài cùng nên có xu hướng nhận thêm 1 e tạo thành ion âm X-.
+ Là phi kim điển hình, có tính oxi hóa mạnh.
- Tính oxi hóa của halogen:
Nhóm halogen với 7 điên tử ở lớp ngoài cùng và độ âm điện lớn, nguyên tử halogen X dễ dàng lấy 1 điện tử tạo ra X-có cấu hình khí trơ bền vững.
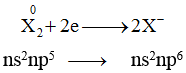
Do đó tính chất quan trọng nhất của nhóm halogen là tính oxi hóa, tính này giảm dần từ F2 (chất oxi hóa mạnh nhất) đến I2 (chất oxi hóa trung bình).
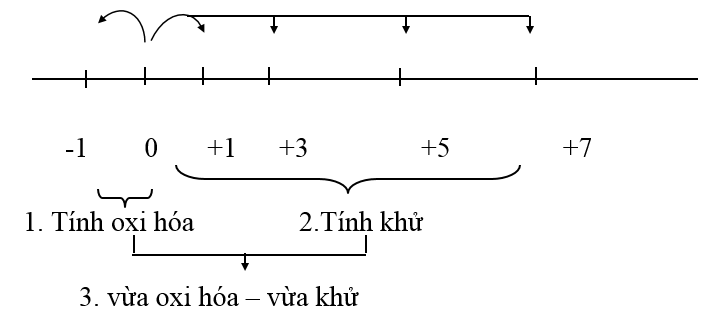
Các bậc oxi hóa đặc trưng của các halogen là: -1, 0, +1, +3, +5, +7 (trừ F luôn có số oxi hóa -1).
Ở dạng đơn chất, các halogen tồn tại dưới dạng phân tử X2. Có bậc oxi hóa trung gian là 0 là bậc oxi hóa trung gian. Nên nó vừa thể hiện tính oxi hóa vừa thể hiện tính khử.