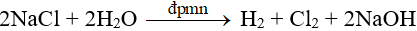Lý thuyết về clo và hợp chất của clo - Hoá học lớp 10
Lý thuyết về clo và hợp chất của clo
Tài liệu Lý thuyết về clo và hợp chất của clo Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về clo và hợp chất của clo từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Clo
- Là chất khí màu vàng lục, nặng hơn không khí, tan vừa phải trong nước.
- Là phi kim mạnh: tác dụng được hầu hết các kim loại.
2Na + Cl2 → 2NaCl
2Fe + 3Cl2 → 2FeCl3
- Là chất oxi hóa mạnh.
H2 + Cl2 → 2HCl
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2H2O + SO2 → 2HCl + H2SO4
Cl2 + 2FeCl2 → 2FeCl3
- Trong 1 số phản ứng clo cũng thể hiện tính khử.
Cl2 + 2NaOH → NaCl + NaClO + H2O
II. Hợp chất của clo
1. Hidroclorua
- Khí không màu, mùi xốc, nặng hơn không khí.
- Tan nhiều trong nước tạo thành dung dịch axit clohidric.
- Axit clohidric là axit mạnh:
Fe + 2HCl → FeCl2 + H2
MgO + 2HCl → MgCl2 + H2O
2Al(OH)3 + 6HCl → 2AlCl3 + 3H2O
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Ngoài ra axit HCl còn thể hiện tính khử:
K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O

2. Muối của axit clohidric
- Đa số muối clorua dễ tan trong nước: NaCl, MgCl2, BaCl2, ....
- Một số muối clorua không tan trong nước: AgCl, PbCl2, CuCl, Hg2Cl2 (PbCl2 tan khá nhiều trong nước nóng)
- Dùng dd AgNO3 để nhận biết ion clorua:
AgNO3 + NaCl → AgCl + NaNO3
3. Hợp chất có oxi của clo
* Axit có oxi của clo: HClO, HClO2, HClO3, HClO4.
Trong dãy trên tính axit tăng dần và khả năng oxi hóa giảm dần.
* Nước Gia-ven: là hỗn hợp NaCl và NaClO.
2NaOH + Cl2 → NaCl + NaClO + H2O
Là muối của axit rất yếu, nhưng có tính oxi hóa mạnh được dùng để tẩy trắng, sát trùng và tẩy uế.
NaClO + CO2 + H2O → NaHCO3 + HClO
* Clorua vôi: CaOCl2 là muối hỗn tạp.
Có tính oxi mạnh:
CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
Ngoài ra: 2CaOCl2 + CO2 + H2O → CaCO3 + CaCl2 + 2HClO
Clorua vôi cũng dùng để tẩy trắng, tẩy uế. So với nước Gia-ven, clorua vôi rẻ tiền hơn, dễ bảo quản và dễ chở hơn.
Ca(OH)2 + Cl2 → CaOCl2 + H2O
* Muối clorat: quan trọng nhất là KClO3
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
Khi đun nóng KClO3 bị phân hủy.
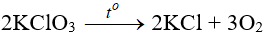
Được dùng chế tạo thuốc nổ, sản xuất pháo hoa, ngòi nổ; dùng trong công nghiệp diêm.

III. Điều chế điện phân
Oxi hóa ion Cl- trong hợp chất.
- Trong PTN: được điều chế từ HCl đặc, dùng các chất oxi hóa mạnh như KMnO4, MnO2.
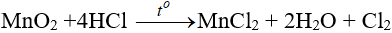
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
KClO3 + 6HCl → KCl + 3H2O + 3Cl2
- Trong công nghiệp: sản xuất bằng phương pháp điện phân.