Tóm tắt lý thuyết Hóa 10 chương 5 - Hoá học lớp 10
Tóm tắt lý thuyết Hóa 10 chương 5
Tài liệu Tóm tắt lý thuyết Hóa 10 chương 5 Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Tóm tắt lý thuyết Hóa 10 chương 5 từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Cấu tạo nguyên tử và tính chất của đơn chất halogen
1. Cấu hình electron nguyên tử
Cấu hình electron lớp ngoài cùng: ns2np5.
F: [He]2s22p5.
Cl: [Ne]3s23p5.
Br: [Ar]3d104s24p5.
I: [Kr]4d105s25p5.
2. Độ âm điện và số oxi hóa
F có độ âm điện lớn nhất và giảm dần đến I.
F chỉ có số oxi hóa -1.Các halogen còn lại ngoài số oxi hóa -1 còn có các số oxi hóa dương: +1, +3, +5, +7.
3. Tính chất
- Tính oxi hóa mạnh: oxi hóa được hầu hết kim loại, nhiều phi kim và nhiều hợp chất.
2Fe + 3Cl2 → 2FeCl3
H2 + Br2 → 2HBr
Cl2 + 2NaOH → NaCl + NaClO + H2O
- Tính oxi hóa giảm dần từ flo đến iot:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → NaBr + I2
- Do chỉ có số oxi hóa -1 nên flo chỉ có tính oxi hóa, các halogen khác thể hiện cả tính khử và tính oxi hóa:
F2 + H2 → 2HF
Cl2 + H2 → 2HCl
Cl2 + 2NaOH → NaCl + NaClO + H2O
Flo có độ âm điện lớn nhất nên là phi kim mạnh nhất. Oxi hóa được tất cả các kim loại kể cả Au, Pt.

II. Hợp chất của halogen
1. Hidro halogenua và axit halogenhidric
- Hidro halogenua là chất khí ở nhiệt độ thường, dễ tan trong nước tạo thành axit.
- HF là axit yếu, có đặc tính ăn mòn thủy tinh.
HCl, HBr, HI là các axit mạnh, tính axit tăng dần: HCl < HBr < HI.
- Với dung dịch AgNO3:
+ HF không tác dụng.
+ HCl + AgNO3 → AgCltủa trắng + HNO3
+ HBr + AgNO3 → AgBrtủa vàng nhạt + HNO3
+ HI + AgNO3 → AgItủa vàng + HNO3
- F- chỉ có thể bị oxi hóa bởi dòng điện, các X- còn lại đều có thể bị oxi hóa khi tác dụng với chất oxi hóa mạnh.
HBr + H2SO4 → Br2 + SO2 + 2H2O
2HI + 2FeCl3 → 2FeCl2 + I2 + 2HCl
2. Hợp chất có oxi của halogen
Trừ flo, các halogen còn lại đều có số oxi hóa dương trong các hợp chất có oxi.
Ví dụ: HClO, CaOCl2, KClO, KClO3, HBrO3, ...
III. Phương pháp điều chế halogen
1. F2: Điện phân hỗn hợp KF và HF.
2. Cl2: Trong PTN: Cho HCl đậm đặc tác dụng với các chất oxi hóa mạnh.
2KMnO4 + 16HCl → 2KCl + MnCl2 + 5Cl2 + 8H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
Trong công nghiệp: dùng phương pháp điện phân.
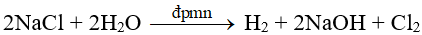
3. Br2: Dùng Cl2 oxi hóa ion Br-
Cl2 + 2NaBr → 2NaCl + Br2
4. I2: Tách NaI từ rong biển, sau đó oxi hóa I- thành I2
Cl2 + 2NaI → 2NaCl + I2

