Tóm tắt lý thuyết Hóa học 10 chương 6 - Hoá học lớp 10
Tóm tắt lý thuyết Hóa học 10 chương 6
Tài liệu Tóm tắt lý thuyết Hóa học 10 chương 6 Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Tóm tắt lý thuyết Hóa học 10 chương 6 từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

I. Vị trí, cấu tạo
Có 6 electron lớp ngoài cùng: ns2np4.
S có phân lớp 3d chưa có electron nên có thể có số oxi hóa +4, +6.
Tính chất đặc trưng là tính oxi hóa, S ngoài tính oxi hóa còn thể hiện tính khử.
II. Tính chất của Oxi, lưu huỳnh
1. Oxi
- Cấu hình electron: 1s22s22p4.
- Tính chất hóa học: Có tính oxi hóa mạnh.
Ở điều kiện nhiệt độ thích hợp, oxi hóa hầu hết kim loại, nhiều phi kim và nhiều hợp chất.
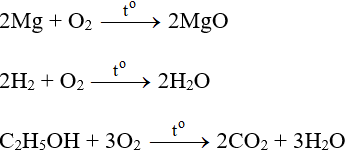
* Ozon là dạng thù hình của oxi, có tính oxi hóa mạnh hơn nhiều oxi.
O3 + 2KI + H2O → I2 + 2KOH + O2
2Ag + O3 → Ag2O + O2
2. Lưu huỳnh
- Cấu hình electron: 1s22s22p63s23p4.
- Tính chất hóa học: Là chất oxi hóa nhưng yếu hơn oxi, S thể hiện cả tính khử khi tác dụng với các chất có tính oxi hóa (S0 → S+4, S+6).
Fe + S → FeS
H2 + S → H2S
S + O2 → SO2

II. Các hợp chất của oxi, lưu huỳnh
1. Hợp chất của oxi
H2O2 vừa có tính oxi hóa vừa có tính khử.
H2O2 + 2KI → I2 + 2KOH
H2O2 + KNO2 → KNO3 + H2O
H2O2 + Ag2O → 2Ag + O2 + H2O
2. Hợp chất của lưu huỳnh
- H2S: là chất khử mạnh (S-2 → S0, S+4, S+6)
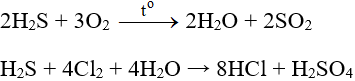
Là axit yếu 2 nấc:
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
- SO2: Vừa là chất khử (S+4 → S+6), vừa là chất oxi hóa (S+4 → S0, S-2).
2SO2 + Cl2 + 2H2O → 2HCl + H2SO4
SO2 + 2H2S → 2H2O + 3S
- SO2 là oxit axit:
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
- SO3 là oxit axit:
SO3 + 2NaOH → Na2SO4 + H2O
SO3 + H2O → H2SO4
H2SO4 loãng có đầy đủ tính chất hóa học của axit.
H2SO4 đặc có tính oxi hóa mạnh (S+6 → S+4, S0, S-2).
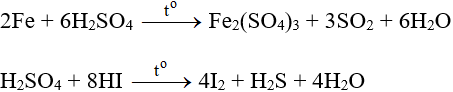
Ngoài ra H2SO4 đặc còn có tính háo nước.

