Lý thuyết Nhận biết Nhóm Halogen - Hoá học lớp 10
Lý thuyết Nhận biết Nhóm Halogen
Tài liệu Lý thuyết Nhận biết Nhóm Halogen Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Nhận biết Nhóm Halogen từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

Dùng Ag+(AgNO3) để nhận biết các gốc halogenua.
Ag+ + Cl- → AgCl ↓ (trắng) (2AgCl 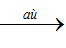
Ag+ + Br- → AgBr ↓ (vàng nhạt)
Ag+ + I- → AgI ↓ (vàng đậm)
I2 + hồ tinh bột → xanh lam
*NHẬN BIẾT MỘT SỐ HỢP CHẤT VÔ CƠ
1/ Nhận biết một số anion ( ion âm)
| CHẤT THỬ | THỬ THUỐC | THỬ DẤU HIỆU | PHƯƠNG TRÌNH PHẢN ỨNG |
| Cl- Br- I- PO43- | Dung dịch AgNO3 | - Kết tủa trắng - Kết tủa vàng nhạt - Kết tủa vàng - Kết tủa vàng | Ag++ X- → AgX↓ ( hoá đen ngoài ánh sáng do phản ứng 2AgX → 2Ag + X2) 3Ag+ + PO43- → Ag3PO4↓ |
| SO42- | BaCl2 | - Kết tủa trắng | Ba2++ SO42- → BaSO4↓ |
| SO32- HSO3- CO32- HCO3- S2- | Dung dịch HCl hoặc H2SO4 loãng | - ↑ Phai màu dd KMnO4 - ↑ Phai màu dd KMnO4 - ↑ Không mùi - ↑ Không mùi - ↑ Mùi trứng thối |
SO32-+ 2H+ → H2O + SO2↑ HSO3- + H+ → H2O + SO2↑ CO32-+ 2H+ → H2O + CO2↑ HCO3-+ H+ → H2O + CO2↑ S2-+ 2H+ → H2S↑ |
| NO3- | H2SO4 và vụn Cu | - ↑ Khí không màu hoá nâu trong không khí. | NO3- + H2SO4 → HNO3 + HSO4- 3Cu+8HNO3 → 3Cu(NO3)3 +2NO + 4H2O 2NO + O2 → 2NO2 |
| SiO32- | Axít mạnh | - kết tủa keo trắng | SiO32-+ 2H+ → H2SiO3↓ ( kết tủa) |

2/ Nhận biết một số chất khí .
| CHẤT KHÍ | KHÍ THUỐC | THỬ DẤU HIỆU | PHƯƠNG TRÌNH PHẢN ỨNG |
| Cl2 | - dd KI + hồ tinh bột | - hoá xanh đậm | Cl2 + 2I- → 2Cl- + I2 (I2 + hồ tinh bột → màu xanh đậm) |
| SO2 | - dd KMnO4 ( tím) - dd Br2 ( nâu đỏ ) |
- mất màu tím - mất màu nâu đỏ | 5SO2+ 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4 . SO2 + Br2 + 4H2O → H2SO4 + 2HBr |
| H2S | - dd CuCl2 - ngửi mùi | - kết tủa đen - mùi trứng thối |
- H2S + CuCl2 → CuS↓ + 2HCl Màu đen |
| O2 | - tàn que diêm | - bùng cháy | |
| O3 |
- dd KI + hồ tinh bột - kim loại Ag |
- hoá xanh đậm - hoá xám đen |
2KI + O3+ H2O → I2 + 2KOH + O2 (I2 + hồ tinh bột → màu xanh đậm) 2Ag + O3 → Ag2O + O2 |
| H2 | - đốt, làm lạnh | - có hơi nước Ngưng tụ | 2H2 + O2 → 2H2O |
| CO2 | - dd Ca(OH) 2 | - dd bị đục | COv + Ca(OH) 2 → CaCO3↓ + HvO |
| CO | - dd PdCl2 | - dd bị sẫm màu | CO + PdCl2 + H2O → CO2 + Pd + 2 HCl Màu đen |
| NH3 | - quì ẩm - HCl đặc | - hoá xanh - khói trắng | NH3 + HCl → NH4Cl |
| - không khí | - không khí | - hoá nâu | 2NO + O2 → 2 NO2↑ ( màu nâu) |
| NO2 | - H2O, quì ẩm | - dd có tính axit | NO2 + H2O → HNO3 + NO |

3/ Nhận biết một số chất khí .
| CHẤT KHÍ | THUỐC THỬ | DẤU HIỆU | PHƯƠNG TRÌNH PHẢN ỨNG |
| SO2 | - dd KMnO4 ( tím) - dd Br2 ( nâu đỏ ) | - mất màu tím - mất màu nâu đỏ | 5SO2+ 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4 . SO2 + Br2 + 4H2O → H2SO4 + 2HBr |
| H2S | - dd CuCl2 - ngửi mùi | - kết tủa đen - mùi trứng thối | - H2S + CuCl2 → CuS ↓+ 2HCl Màu đen |
| O2 | - tàn que diêm | - bùng cháy | |
| O3 | - dd KI + HTB - kim loại Ag | - hoá xanh đậm - hoá xám đen | 2KI + O3 + H2O → I2 + 2KOH + O2 (I 2 + hồ tinh bột → màu xanh đậm) 2Ag + O3 → Ag2O + O2 |

