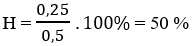100 câu trắc nghiệm Hidrocacbon không no có lời giải chi tiết (nâng cao) - Hoá học lớp 11
100 câu trắc nghiệm Hidrocacbon không no có lời giải chi tiết (nâng cao)
Với 100 câu trắc nghiệm Hidrocacbon không no có lời giải chi tiết (nâng cao) Hoá học lớp 11 tổng hợp 100 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hidrocacbon không no từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Bài 1: Dẫn 3,36 lít hỗn hợp X gồm 2 anken là đồng đẳng kế tiếp vào bình nước brom dư, thấy khối lượng bình tăng thêm 7,7 gam. Tìm CTPT của 2 anken ?
A. C3H6 và C4H8 B. C4H8 và C5H10
C. C5H10 và C6H12 D. C3H6 và C5H10
Lời giải:
Đáp án A
Hướng dẫn
Số mol hỗn hợp X là: nX = 3,36/22,4 = 0,15 mol
Phương trình phản ứng:
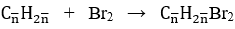
Khối lượng bình brom tăng là khối lượng của 2 anken: mX = 7,7 gam
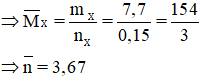
Vậy CTPT của 2 anken kế tiếp là: C3H6 và C4H8
Bài 2: Đốt cháy hoàn toàn hỗn hợp 2 olefin thu được (m + 4)g H2O và (m + 30)g CO2. Giá trị của m là :
A. 14 g B. 21 g C. 28 g D. 35 g.
Lời giải:
Đáp án A
Hướng dẫn
CnH2n + 3n/2O2 → nCO2 + nH2O
nH2O = nCO2 ⇒ 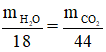
Bài 3: Oxi hoá etilen bằng dung dịch KMnO4 thu được sản phẩm là:
A. MnO2, C2H4(OH)2, KOH.
C. K2CO3, H2O, MnO2.
B. C2H5OH, MnO2, KOH.
D. C2H4(OH)2, K2CO3, MnO2.
Lời giải:
Đáp án A
Hướng dẫn
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2MnO2 ↓+ 2KOH
Bài 4: Cho 4,2g anken X phản ứng với 25,28g dung dịch KMnO4 25% thì phản ứng vừa đủ. Xác định công thức phân tử của X.
A. C2H4 B. C5H10
C. C3H6 D. C4H8
Lời giải:
Đáp án B
Hướng dẫn
Đặt CTTQ của X: CnH2n.
2CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2
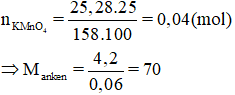
⇒ 14n = 70 ⇒ n = 5
Vậy CTPT của X là C5H10.
Bài 5: Hỗn hợp gồm hiđrocacbon X và oxi có tỉ lệ số mol tương ứng là 1:10. Đốt cháy hoàn toàn hỗn hợp trên thu được hỗn hợp khí Y. Cho Y qua dung dịch H2SO4 đặc, thu được hỗn hợp khí Z có tỉ khối đối với hiđro bằng 19. Công thức phân tử của X là :
A. C3H8. B. C3H6.
C. C4H8. D. C3H4.
Lời giải:
Đáp án C
Hướng dẫn
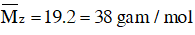
Áp dụng sơ đồ đường chéo ta có : 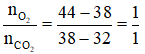
Phương trình phản ứng :
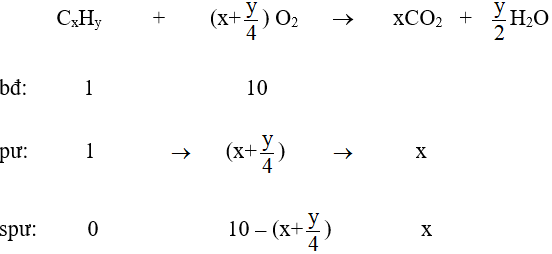
⇒ 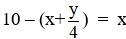
Bài 6: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu nâu đen cần V lít khí C2H4 (ở đktc). Giá trị tối thiểu của V là
A. 2,240. B. 2,688.
C. 4,480. D. 1,344.
Lời giải:
Đáp án D
Hướng dẫn
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2MnO2 ↓+ 2KOH
nKMnO4 = 0,2.0,2 = 0,04 mol; nC2H4 = 0,04.3/2 = 0,06 mol
⇒ VC2H4 = 0,06.22,4 = 1,344 lít
Bài 7: Đốt cháy hoàn toàn a gam hỗn hợp eten, propen, but-2-en cần dùng vừa đủ b lít oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là:
A. 92,4 lít. B. 94,2 lít.
C. 80,64 lít. D. 24,9 lít.
Lời giải:
Đáp án C
Hướng dẫn
CnH2n + 3n/2O2 → nCO2 + nH2O
nO2 = 3/2 n CO2 = 3/2 . 2,4 = 3,6 mol ⇒ VO2 = 3,6.22,4 = 80,64 lít
Bài 8: Hỗn hợp khí X gồm H2 và một anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với H2 bằng 9,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom; tỉ khối của Y so với H2 bằng 13. Tìm công thức cấu tạo của anken.
A. C4H8 B. CH3-CH=CH-CH3
C. CH2=CH- CH2-CH3 D. C5H10
Lời giải:
Đáp án B
Hướng dẫn
Gọi số mol hổn hợp X là 1 mol
Ta có 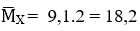
Mà 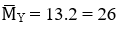
→ nH2 pư = 1 – 0,7 = 0,3 mol = nanken → nH2 bđ = 0,7 mol
Manken = 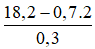
Anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất ⇒ CTCT của anken là: CH3-CH=CH-CH3.
Bài 9: Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Tính hiệu suất của phản ứng hiđro hoá?
A. 20%. B. 25%. C. 50%. D. 40%
Lời giải:
Đáp án C
Hướng dẫn
Ta có : 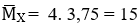
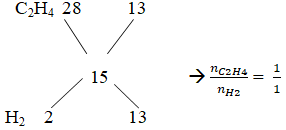
Vậy hiệu suất tính theo anken hoặc H2 củng được
Giả sử: nX = 1 mol → mX = 15. 1 = 15 g = mY
Mà 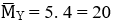
→ 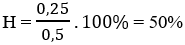
Bài 10: Để khử hoàn toàn 200ml dung dịch KMnO4 0,2M tạo thành chất rắn màu nâu đen cần V lít khí C2H4 (ở đktc). Giá trị tối thiểu của V là:
A. 1,344
B. 4,480
C. 2,240
D. 2,688
Lời giải:
Đáp án A
Hướng dẫn
Số mol KMnO4 = 0,2.0,2 = 0,04 mol
Phương trình phản ứng:
2KMnO4 + 3C2H4 + 4H2O → 2KOH + 2MnO2 + 3C2H4(OH)2
nKMnO4 = 0,04 ⇒ nC2H4 = 0,06
⇒ V = 0,06 . 22,4 = 1,344 (lít)
Bài 11: Anken A phản ứng hoàn toàn với dung dịch KMnO4 được chất hữu cơ B có MB = 1,81MA. CTPT của A là:
A. C2H4 B. C3H6
C. C4H8 D. C5H10
Lời giải:
Đáp án B
Hướng dẫn
CTPT của anken A: CnH2n; chất hữu cơ B: CnH2n+2O2
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓+ 2KOH
MB = 1,81.MA ⇔ 14n + 34 = 1,81.14n ⇒ n = 3
Bài 12: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol propen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với H2 là 16. Tính số mol H2 phản ứng?
A. 0,15 mol B. 0,2 mol
C. 0,25 mol D. 0,3 mol
Lời giải:
Đáp án C
Hướng dẫn
mX = 0,3.2 + 0,1.42 = 4,8 g ⇒ 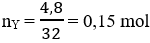
nH2 pư = 0,4 – 0,15 = 0,25 mol
Bài 13: Chia hỗn hợp 2 anken thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần một trong không khí thu được 6,3 gam H2O. Phần hai cộng H2 được hỗn hợp A. Nếu đốt cháy hoàn toàn phần hai thì thể tích CO2 (đktc) tạo ra là:
A. 3,36 lít B. 7,84 lít
C. 6,72 lít D. 8,96 lít
Lời giải:
Đáp án B
Hướng dẫn
CnH2n + 3n/2O2 → nCO2 + nH2O
CnH2n + H2 → CnH2n + 2
nCO2 = nH2O = 6,3/18 = 0,35 mol; VCO2 = 0,35 .22,4 = 7,84 lít
Bài 14: Dẫn 0,2 mol một olefin A qua dung dịch brom dư, khối lượng bình sau phản ứng tăng 5,6 gam.Vậy công thức phân tử của A là:
A. C2H4 B. C3H6
C. C4H8 D. C5H10
Lời giải:
Đáp án A
Hướng dẫn
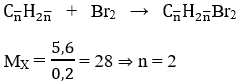
Bài 15: Hidro hóa hoàn toàn một olefin cần dùng hết 448ml H2 (đktc) và thu được một ankan phân nhánh. Khi cho cùng lượng olefin trên tác dụng với brom thì thu được 4,32 gam dẫn xuất dibrom. Biết các phản ứng xảy ra hoàn toàn. Vậy olefin có tên gọi là:
A. 2-metylpropen
B. 2-metylbut-2-en
C. but-2-en
D. 3-metylbut-1-en
Lời giải:
Đáp án A
Hướng dẫn
nolefin = nH2 = 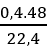
ndẫn xuất = nolefin = 0,02 mol
CnH2nBr2 = 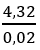
n = 4 và ankan phân nhánh nên chọn A
Bài 16: Hỗn hợp khí X gồm một ankan và một anken. Tỉ khối của X so với H2 bằng 11,25. Đốt cháy hoàn toàn 4,48 lít X, thu được 6,72 lít CO2 (các thể tích khí đo ở đktc). Công thức của ankan và anken lần lượt là:
A. CH4 và C2H4
B. C2H6 và C2H4
C. CH4 và C3H6
D. CH4 và C4H8.
Lời giải:
Đáp án C
Hướng dẫn
Ta có: nX = 0,2 mol; nCO2 = 0,3 mol; 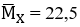
Ta thấy: 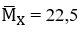
Gọi CTTQ anken là CnH2n : y mol
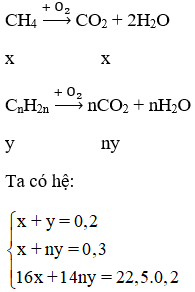
n = 3 ⇒ anken là C3H6
Bài 17: Hiện nay PVC được điều chế theo sơ đồ sau: C2H4 → CH2Cl–CH2Cl → C2H3Cl → PVC. Nếu hiệu suất toàn bộ quá trình đạt 80% thì lượng C2H4 cần dùng để sản xuất 5000kg PVC là:
A. 280kg. B. 1792kg.
C. 2800kg. D. 179,2kg.
Lời giải:
Đáp án C
Hướng dẫn
nPVC = 5000/62,5 = 80 kmol ⇒ mC2H4 = 80.100.28/80 = 2800kg
Bài 18: Hỗn hợp X gồm C3H8 và C3H6 có tỉ khối so với hiđro là 21,8. Đốt cháy hết 5,6 lít X (đktc) thì thu được bao nhiêu gam CO2 và bao nhiêu gam H2O?
A. 33g và 17,1g. B. 22g và 9,9g.
C. 13,2g và 7,2g. D. 33g và 21,6g.
Lời giải:
Đáp án A
Hướng dẫn
C3H6 + 9/2O2 → 3CO2 + 3H2O
C3H8 + 5O2 → 3CO2 + 4H2O
nX = 0,25 mol ⇒ nCO2 = 0,25.3 = 0,75 mol; mCO2 = 0,75.44 = 33 gam;
mX = mC + mH; ⇔ 21,8.2.0,25 = 0,75.12 + 2.nH2O
⇒ nH2O = 0,95mol; mH2O = 18.0,95 = 17,1 gam
Bài 19: Cho V lít một anken A ở đkc qua bình đựng nước brom dư, có 8 g Br2 đã phản ứng đồng thời khối lượng bình tăng 2,8g. Mặt khác khi cho A phản ứng với HBr chỉ thu được 1 sản phẩm . Giá trị của V và tên của A là:
A. 2,24 lít; propen
B. 2,24 lít; etilen
C. 1,12 lít; but-1-en
D. 1,12 lít; but-2-en
Lời giải:
Đáp án D
Hướng dẫn
CTPT A : CnH2n ; nA = nBr2 = 8/160 = 0,05 mol ⇒ V = 1,12l
MA = 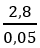
A phản ứng Br2 cho 1sản phẩm ⇒ A có cấu tạo đối xứng ⇒but-2-en
Bài 20: Cho 2 hidrocacbon A, B đều ở thể khí. A có công thức C2xHy; B có công thức CxH2x. Biết tỉ khối hơi của A so với không khí bằng 2 và tỉ khối hơi của B so với A là 0,482. Vậy tổng số đồng phân của A và B là:
A. 3
B. 4
C. 5
D. 6
Lời giải:
Đáp án A
Hướng dẫn
A: C2xHy ⇒ MA = 24x + y = 29,2 = 58 ⇒ x = 2; y = 10
Vậy A là C4H10
B: CxH2x ⇒ B là C2H4
A: có 2 đồng phân
B: có 1 đồng phân
⇒ Số đồng phân của A và B là 3
Bài 21: Đốt cháy hoàn toàn 2 lít hỗn hợp gồm axetilen và một hidrocacbon A, thu được 4 lít CO2 và 4 lít hơi nước (các thể tích khí đo ở cùng nhiệt độ và áp suất). Vậy A và % của nó trong hỗn hợp là
A. CH4 và 40%
B. C2H6 và 50%
C. C2H6 và 60%
D. C3H8 và 50%
Lời giải:
Đáp án B
Hướng dẫn
Các phương trình phản ứng:
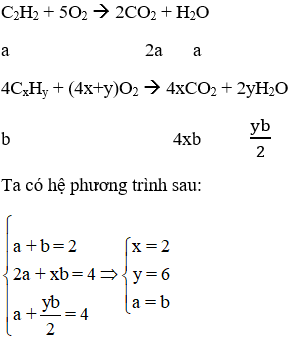
⇒ A là C2H6 và chiếm 50%
Bài 22: Thổi 0,25 mol khí etilen qua 125ml dung dịch KMnO4 1M trong môi trường trung tính (hiệu suất 100%) khối lượng etylenglicol thu được bằng
A. 11,625g. B. 23,25g. C. 15,5g. D. 31g.
Lời giải:
Đáp án A
Hướng dẫn
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓+ 2KOH
netilenglicol = 0,125.3/2 = 0,1875 mol ⇒ m = 0,1875. 62 = 11,625 gam
Bài 23: Đốt cháy hoàn toàn m gam ankin A bằng O2 vừa đủ thu được 22,4 lít CO2 (đktc). Mặt khác, dẫn m gam A qua dd AgNO3/NH3 dư thấy có 35 gam kết tủa màu vàng nhạt. CTPT của A là.
A. C7H12 B. C8H14 C. C5H8 D. C6H10
Lời giải:
Đáp án C
Hướng dẫn
CTPT ankin A: CnH2n-2 ; nA = 1/n; M↓A = 35n ⇒ n = 5, M = 175 ⇒ A là C5H8
Bài 24: Một hỗn hợp A gồm 2 hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam H2O. CTPT X, Y và khối lượng của X, Y là:
A. 12,6 gam C3H6 và 11,2 gam C4H8.
B. 8,6 gam C3H6 và 11,2 gam C4H8.
C. 5,6 gam C2H4 và 12,6 gam C3H6.
D. 2,8 gam C2H4 và 16,8 gam C3H6.
Lời giải:
Đáp án C
Hướng dẫn
nCO2 = 1,3 mol; nH2O = 1,3 mol ⇒ Hidrocacbon là anken; CTPT là: 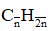
CnH2n + 3n/2O2 → nCO2 + nH2O
nX = 0,5 mol ⇒ n− = 1,3/0,5 = 2,6 ⇒ 2 anken là: C2H4, C3H6;
nC2H4 : nC3H6 = 2:3 ⇒ nC2H4 = 0,2 mol và nC3H6 = 0,3 mol
⇒ mC2H4 = 0,2.28 = 5,6 gam và mC3H6 = 0,3.42 = 12,6 gam
Bài 25: Một hỗn hợp X có thể tích 11,2 lít (đktc), X gồm 2 anken đồng đẳng kế tiếp nhau. Khi cho X qua nước Br2 dư thấy khối lượng bình Br2 tăng 15,4g. Xác định CTPT và số mol mỗi anken trong hỗn hợp X.
A. 0,2 mol C2H4 và 0,3 mol C3H6
B. 0,2 mol C3H6 và 0,2 mol C4H8
C. 0,4 mol C2H4 và 0,1 mol C3H6
D. 0,3 mol C2H4 và 0,2 mol C3H6
Lời giải:
Đáp án C
Hướng dẫn
CTPT: 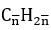
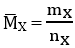
⇒ anken là: C2H4 và C3H6; nC2H4 : nC3H6 = 4:1
⇒ nC2H4 = 0,4 mol và nC3H6 = 0,1 mol
Bài 26: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,34 mol H2. Giá trị của a là
A.0,46 B. 0,22 C.0,34 D. 0,32
Lời giải:
Đáp án B
Hướng dẫn
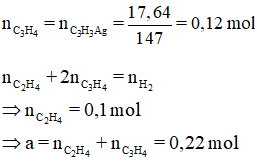
Bài 27: Dẫn propen vào dung dịch KMnO4 thu được sản phẩm hữu cơ là
A. CH3CH2CH2CH3 B. CH3CH(OH)CH3.
C. CH3CH=CHCH3 D.CH3CH(OH)CH2OH
Lời giải:
Đáp án D

Bài 28: Đốt cháy hoàn toàn 0,2 mol hỗn hợp X gồm một ankan và một anken, thu được 0,35 mol CO2 và 0,4 mol H2O. Thành phần phần trăm số mol của anken có trong X là
A.40% B. 50% C. 25% D. 75%
Lời giải:
Đáp án D
Hướng dẫn
CnH2n + 3n/2O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O
nankan = nH2O – nCO2 = 0,4 – 0,35 = 0,05 (mol)
nanken = 0,2 – 0,05 = 0,15 mol
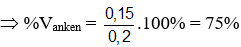
Bài 29: Đun nóng hỗn hợp khí X gồm 0,02 mol C2H2 và 0,03 mol H2 trong một bình kín (xúc tác Ni), thu được hỗn hợp khí Y. Cho Y lội từ từ vào bình đựng nước brom(dư), sau khi kết thúc các phản ứng, khối lượng bình tăng m gam và có 280ml hỗn hợp khí Z (đktc) thoát ra. Tỉ khối của Z so với H2 là 10,08. Giá trị của m là:
A. 0,328
B. 0,205
C. 0,585
D. 0,620
Lời giải:
Đáp án A
Hướng dẫn
Sơ đồ phản ứng :
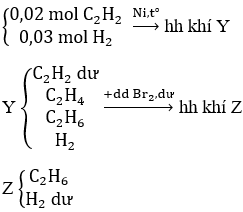
Ta có: nhh Z = 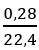
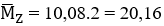
Áp dụng định luật bảo toàn khối lượng ta có:
mhh Y = mC2H2 + mH2 = 0,02.26 + 0,03.2 = 0,58 g
Dựa vào sơ đồ ta thấy: khối lượng bình brom tăng chính là khối lượnghi drocacbon không no được hấp thụ vào nên ta có:
∆ mdd Br2 tăng = 0,58 – 0,252 = 0,328g
Bài 30: Cho 3,36 lít khí (đktc) hỗn hợp gồm 1 ankan và 1 anken lội qua nước brom thấy có 8 gam brom tham gia phản ứng. Khối lượng của 6,72 lít hỗn hợp này nặng 13 gam. Vậy công thức phân tử của ankan và anken là:
A. CH4 và C4H8
B. C2H6 và C5H10
C. C3H8 và C3H6
D. C2H4 và C4H8
Lời giải:
Đáp án C
Hướng dẫn
Gọi CT ankan là CnH2n+2; anken là CmH2m
Từ dữ kiện bài toán cho, lập được biểu thức 2n + m = 9
Mặt khác, do 2 anken này ở thể khí nên n, m ≤ 4 ⇒ n = 3 và m = 3
Bài 31: Chất nào sau đây không làm đổi màu dung dịch KMnO4 ở nhiệt độ thường?
A. Axetilen B. Toluen
C. Propilen D. Striren
Lời giải:
Đáp án B
Bài 32: Đốt cháy hoàn toàn 0,1 mol hỗm hợp gồm CH4, C4H10 và C2H4 thu được 0,14 mol CO2 và 0,23mol H2O. Số mol của ankan và anken trong hỗn hợp lần lượt là
A. 0,09 và 0,01 B. 0,01 và 0,09.
C. 0,08 và 0,02 D. 0,07 và 0,04
Lời giải:
Đáp án A
Hướng dẫn
CnH2n + 3n/2O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O
nankan = 0,23 – 0,14 = 0,09 mol
⇒ nanken = 0,1 – 0,09 = 0,01 mol
Bài 33: Cho 10g hỗn hợp khí X gồm etilen và etan qua dung dịch Br2 25% có 160g dd Br2 phản ứng. % khối lượng của etilen trong hỗn hợp là:
A. 70% B. 30% C. 35,5% D. 64,5%
Lời giải:
Đáp án A
Hướng dẫn
nC2H4 = nBr2 = 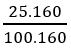
⇒ %mC2H4 = 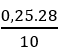
Bài 34: Cho 17,92 lít hỗn hợp X gồm 3 hiđrocacbon khí là ankan, anken và ankin lấy theo tỉ lệ mol 1:1:2 lội qua bình đựng dd AgNO3/NH3 lấy dư thu được 96 gam kết tủa và hỗn hợp khí Y còn lại. Đốt cháy hoàn toàn hỗn hợp Y thu được 13,44 lít CO2. Biết thể tích đo ở đktc. Khối lượng của X là
A. 19,2 gam. B. 1,92 gam.
C. 3,84 gam. D.38,4 gam.
Lời giải:
Đáp án A
Hướng dẫn
nX = 0,8 mol; nankan = nanken = 0,2 mol; nankin = 0,4 mol; M↓ankin = 96/0,4 = 240 ⇒ ankin là C2H2; nCO2 = 0,6 = 0,2n + 0,2m ⇒ n = 1 và m = 2 ⇒ ankan và ankin là: CH4 và C2H4
mX = 0,2.16 + 0,2.28 + 0,4.26 = 19,2 g
Bài 35: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu nâu đen cần V lít khí C2H4 (ở đktc). Giá trị tối thiểu của V là :
A. 2,240. B. 2,688. C. 4,480. D. 1,344.
Lời giải:
Đáp án D
Hướng dẫn
Áp dụng định luật bảo toàn electron :
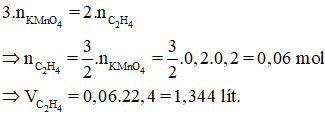
Bài 36: Đốt cháy hoàn toàn 2,24 lít đkc 1 hiđrocacbon X mạch hở, sau đó dẫn sản phẩm cháy lần lượt qua dung dịch H2SO4 và dung dịch Ca(OH)2 dư. Sau thí nghiệm thấy khối lượng bình đựng dung dịch axit tăng 5,4g, bình đựng dung dịch Ca(OH)2 có 30g kết tủa. Tìm CTPT của X.
A. C3H6 B. C2H4
C. C4H8 D. C5H10
Lời giải:
Đáp án A
Hướng dẫn
Số mol X là: nX = 2,24/22,4 = 0,1 mol
Khối lượng bình đựng dung dịch axit tăng là khối lượng của H2O:
mH2O = 5,4 gam ⇒ nH2O = 5,4/18 = 0,3 mol
Số mol CO2 là: nCO2 = nCaCO3 = 30/100 = 0,3 mol
Nhận thấy: nH2O = nCO2 ⇒ hidrocacbon X là anken
Phương trình đốt cháy:
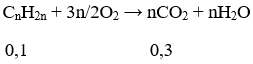
Ta có: 0,1.n = 0,3 ⇒ n = 3. Vậy CTPT của X là C3H6
Bài 37: Đốt cháy hoàn toàn 2,7 gam ankađien liên hợp X, thu được 4,48 lít CO2 (đktc). Công thức cấu tạo của X là
A. CH2 = C = CH2
B. CH2 = C = CH2– CH2.
C. CH2 = C(CH3) – CH = CH2
D. CH2 = CH – CH = CH2
Lời giải:
Đáp án D
Hướng dẫn
Đặt CTPT X là CnH2n-2 ⇒ 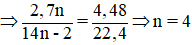
⇒ CTPT: C4H6
Bài 38: Một hỗn hợp gồm C2H2 và đồng đẳng A của axetilen có tỷ lệ mol 1:1. Chia hh thành 2 phần bằng nhau
+ Phần 1 tác dụng vừa đủ với 8,96 lít H2 đktc tạo hidrocacbon no.
+ Phần 2 tác dụng với 300ml dd AgNO31M/NH3 thu được 40,1g kết tủa. Tên gọi của A là:
A. pent-1-in B. Vinylaxetilen
C. but-1-in D. propin
Lời giải:
Đáp án C
Hướng dẫn
nC2H2 = nA = x; 2x + 2x = 4x = 0,4 mol ⇒ x = 0,1 mol;
m↓C2H2 = 0,1.240 = 24 gam ⇒ m↓A = 40,1 – 24 = 16,1 gam
⇒ M↓A = 16,1/0,1 = 161 ⇒ A là but-1-in
Bài 39: Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Hiệu suất của phản ứng hiđro hoá là :
A. 20%. B. 40%. C. 50%. D. 25%.
Lời giải:
Đáp án C
Hướng dẫn
Áp dụng sơ đồ đường chéo ta có :
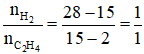
⇒ Có thể tính hiệu suất phản ứng theo H2 hoặc theo C2H4
Phương trình phản ứng :
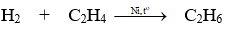
Áp dụng định luật bảo toàn khối lượng ta có :
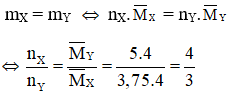
Chọn nX = 4 mol ⇒ nH2 = nC2H4 = 2mol; nH2(pư) = nX – nY = 1 mol
⇒ Hiệu suất phản ứng :
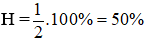
Bài 40: Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là:
A. 1,04 gam. B. 1,64 gam.
C. 1,20 gam. D. 1,32 gam
Lời giải:
Đáp án D
Hướng dẫn
mY = 0,06.26 + 0,04.2 = 1,64 g; mZ = 0,02.16 = 0,32 g;
m↑ = mY – mZ = 1,64 – 0,32 = 1,32 g
Bài 41: Đốt cháy hoàn toàn 2,24 lít khí X (đktc) gồm buta–1,3–đien và etan sau đó dẫn toàn bộ sản phẩm cháy hấp thụ vào dung dịch H2SO4 đặc thì khối lượng dung dịch axit tăng thêm bao nhiêu gam ?
A. 3,6 g. B. 5,4 g. C. 9,0 g. D. 10,8 g.
Lời giải:
Đáp án B
Hướng dẫn
nH2O = 3.nX = 3.0,1 = 0,3 mol ⇒ m↑ = mH2O = 0,3.18 = 5,4 gam
Bài 42: Đốt cháy hoàn toàn m gam ankanđien X, thu được 11,2 lít CO2 (đktc) và 5,4 gam H2O. Cho m gam X tác dụng với dung dịch Br2, số mol Br2 tối đa tham gia phản ứng là
A. 0,10mol B. 0,20 mol
C. 0,30mol D. 0,05mol
Lời giải:
Đáp án B
Hướng dẫn
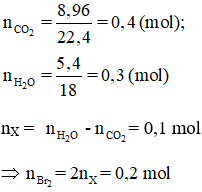
Bài 43: Một hỗn hợp khí X gồm 2 olefin là đồng đẳng kế tiếp nhau. Nếu cho 1,792 lít hỗn hợp X (ở 0℃, 2,5 at) qua bình chứa dung dịch brom thì thấy khối lượng của bình tăng lên 7 gam. Công thức phân tử của 2 olefin là:
A. C2H4 và C3H6
B. C3H6 và C4H8
C. C3H8 và C3H6
D. C4H8 và C5H10
Lời giải:
Đáp án A
Hướng dẫn
Số mol của hỗn hợp:
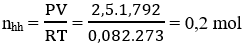
Khối lượng bình brom tăng = khối lượng hỗn hợp
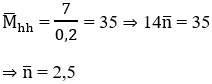
⇒ 2 anken là C2H4 và C3H6
Bài 44: 2,24 lít hỗn hợp X gồm buta–1,3–đien và penta–1–3-đien (đktc) có thể tác dụng hết tối đa bao nhiêu lít dung dịch brom 0,10 M ?
A. 2 lít. B. 1 lít.
C. 1,5 lít. D. 2,5 lít.
Lời giải:
Đáp án A
Hướng dẫn nBr2 = 2nX = 0,2 mol ⇒ VBr2 = 0,2/0,1 = 2 lít
Bài 45: Hỗn hợp khí X gồm H2 và một anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với hidro bằng 0,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom; tỉ khối của Y so với H2 bằng 13. Công thức cấu tạo của anken là:
A. CH3 – CH = CH – CH3
B. CH2 = CH – CH2 – CH3
C. CH2 = C(CH3)2
D. CH2 = CH2
Lời giải:
Đáp án A
Hướng dẫn
Giả sử có 1 mol hỗn hợp X gồm H2 và anken : CnH2n
Ta có:
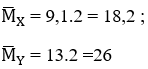
Áp dụng ĐLBTKL ta có: mhh X = mhh Y ⇔ 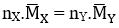
⇔ 1.18,2 = nY.26 ⇒ nY = 0,7 mol.
Phương trình phản ứng:
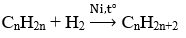
Ta có: nX = 1 mol; nY= 0,7 mol
⇒ Số mol H2 pứ = số mol CnH2n = 1 - 0,7 = 0,3 mol
⇒ số mol H2 ban đầu = 0,3 + 0,4 = 0,7 mol
Ta có: 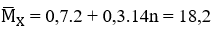
X + HBr cho 1 sản phẩm duy nhất ⇒ X là but-2-en
Bài 46: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol propen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với H2 là 16. Tính số mol H2 phản ứng?
A. 0,15 mol B. 0,2 mol
C. 0,25 mol D. 0,3 mol
Lời giải:
Đáp án C
Hướng dẫn
mX = 0,3.2 + 0,1.42 = 4,8 g ⇒ nY = 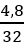
Bài 47: Hỗn hợp X gồm C2H2 và H2 có cùng số mol. Lấy một lượng hỗn hợp X cho qua chất xúc tác nung nóng, thu được hỗn hợp Y gồm C2H4, C2H6, C2H2 và H2. Sục Y vào dung dịch brom (dư) thì khối lượng bình brom tăng 10,8 gam và thoát ra 4,48 lít hỗn hợp khí (đktc) có tỉ khối so với H2 là 8. Thể tích O2(đktc) cần để đốt cháy hoàn toàn hỗn hợp Y là:
A. 33,6 lít. B. 22,4 lít.
C. 44,8 lít. D. 26,88 lít.
Lời giải:
Đáp án A
Hướng dẫn mX = 10,8 + 16.0,2 = 14 g
mX = mC2H2 + mH2 = 26x + 2x = 28x = 14 ⇒ x = 0,5 mol;
nO2 = 0,5nH2 + 2,5nC2H2 = 0,5 + 2,5.0,5 = 1,5 mol ⇒ V = 33,6 lít
Bài 48: Đốt cháy hoàn toàn 1 thể tích A gồm C2H6 và C2H2 thu được CO2 và H2O có tỉ lệ mol là 1:1. Phần trăm thể tích mỗi khí trong hỗn hợp đầu lần lượt là
A. 50%, 50% B. 30%, 70%
C. 25% ,75% D. 70% ,30%
Lời giải:
Đáp án A
Hướng dẫn
Giả sử nA = 1 mol ; nC2H6 = x và nC2H2 = y; nH2O = nCO2 = 2 mol; x + y = 1 và 3x + y = 2 ⇒ x = 0,5 và y = 0,5 ⇒ %V = % số mol

Bài 49: Hỗn hợp X gồm propin và ankin A có tỉ lệ mol 1:1. Lấy 0,3 mol X tác dụng với dd AgNO3/NH3 dư thu được 46,2 gam kết tủa. Vậy A là:
A. Axetilen B. But-2-in.
C. But-1-in D. Pent-1-in.
Lời giải:
Đáp án C
Hướng dẫn
npropin = nA = 0,15 mol; m↓ = 0,15.147 + m↓A ⇒ m↓A = 46,2 – 22,05 = 22,05 ⇒ M↓ = 22,05/0,15 = 161 ⇒ ankin A là: C4H6 (but-1-in)
Bài 50: Cho hỗn hợp X gồm anken và hiđro có tỉ khối so với heli bằng 3,33. Cho X đi qua bột niken nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y có tỉ khối so với heli là 4. CTPT của X là :
A. C2H4 B. C3H6.
C. C4H8 D. C5H10
Lời giải:
Đáp án D
Hướng dẫn
Vì 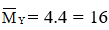
Áp dụng định luật bảo toàn khối lượng ta có :
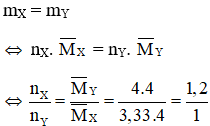
Chọn nX = 1,2 mol và nY =1 mol ⇒ nH2 (pư) = nCnH2n = nX – nY = 0,2 mol
⇒ Ban đầu trong X có 0,2 mol CnH2n và 1 mol H2
Ta có : 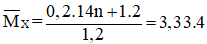
Bài 51: 1 mol hiđrocacbon X đốt cháy cho ra 5 mol CO2, 1mol X phản ứng với 2 mol AgNO3/NH3. Xác định CTCT của X.
A. CH2=CH-CH2-C≡C-H
B. HC≡C-CH2- C≡C-H
C. CH2=CH-CH=CH-CH3
D. CH2=C=CH-CH-CH2
Lời giải:
Đáp án B
Hướng dẫn
CTPT X là CxHy; x = 5 ⇒ có 5 nguyên tử C; X có 2 liên kết 3 ở đầu mạch.
Bài 52: Đốt cháy hoàn toàn 4,48 lít hỗn hợp C2H4 và C3H6 có tỉ khối hơi so với oxi là 1,09375, rồi cho toàn bộ sản phẩm vào 500ml dung dịch NaOH 1,8M thì thu được sản phẩm và nồng độ mol tương ứng là:
A. NaHCO3 0,2M và Na2CO3 0,8M
B. Na2CO3 0,6M và NaOH 0,1M dư.
C. NaHCO3 0,02M và Na2CO3 0,8M
D. Chỉ thu được Na2CO3 0,4M.
Lời giải:
Đáp án A
Hướng dẫn Dựa vào tỉ khối ta tính được khối lượng mỗi chất và số mol
nCO2 = 0,2.2,5 = 0,5 (mol) và nNaOH = 0,9 mol
Tỉ lệ: 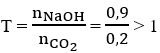
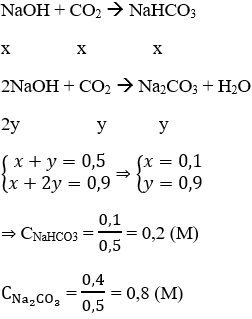
Bài 53: Hỗn hợp X gồm H2, C2H4 và C3H6 có tỉ khối so với H2 là 9,25. Cho 22,4 lít X (đktc) vào bình kín có sẵn một ít bột Ni. Đun nóng bình một thời gian, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 10. Tổng số mol H2 đã phản ứng là
A. 0,070 mol B. 0,015 mol
C. 0,075 mol D. 0,050 mol
Lời giải:
Đáp án C
Hướng dẫn mX = 18,5.1 = 18,5 g; nY = 18,5/20 = 0,925 mol ⇒ nH2 pư = 1 – 0,925 = 0,075 mol
Bài 54: Cho Hiđrocacbon X phản ứng với brom(trong dung dịch) theo tỷ lệ mol 1 : 1 thì được chất hữu cơ Y(chứ 74,08% brom về khối lượng). Khi X phản ứng với HBr thì thu được hai sản phẩm hữu cơ khác nhau. Tên gọi của X là
A. but-1-en B.etilen
C. but-2-en D. propilen
Lời giải:
Đáp án A
Hướng dẫn X + Br2 → Y (CxHyBr2)
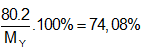
Do phản ứng với HCl tạo 2 sp khác nhau nên X là but-1-en
Bài 55: Cho 3,12 gam ankin X phản ứng với 0,1 mol H2 (xúc tác Pd/PbCO3, to), thu được hỗn hợp Y chỉ có hai hiđrocacbon. Công thức phân tử của X là
A. C2H2 B. C5H8 C. C4H6 D. C3H4.
Lời giải:
Đáp án A
Hướng dẫn
nankin > 0,1 mol; MX < 31,2 ⇒ X là C2H2
Bài 56: Dẫn 8,96 lít hỗn hợp khí X gồm metan và etilen vào dung dịch brom dư, thấy dung dịch nhạt màu và còn lại 2,24 lít khí thoát ra. (Thể tích các khí đều do(đktc)). Thành phần phần trăm thể tích của metan trong X là
A. 25,0% B. 50,0%
C. 60,0% D. 37,5%
Lời giải:
Đáp án A
Hướng dẫn
Chất khí thoát ra là CH4 ⇒ thể tích CH4 là 2,24 lít
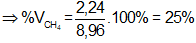
Bài 57: Đốt cháy hoàn toàn m gam hiđrocacbon ở thể khí, mạch hở, nhẹ hơn không khí thu được 7,04 gam CO2. Sục m gam hiđrocacbon này vào nước brom dư đến khi phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là:
A. 2 gam B. 4 gam.
C. 10 gam D. 2,08 gam
Lời giải:
Đáp án D
Hướng dẫn
Hidrocacbon là C2H2 (vì M < Mkk; nBr2 = 2nankin)
nBr2 = 0,16 mol; nCO2 = 0,16 mol; nankin = 0,08 mol; m = 0,08.26 = 2,08 gam.
Bài 58: Dẫn 11,2 lít hh khí X (gồm axetilen và propin) vào dd AgNO3/NH3 dư (các phản ứng xảy ra hoàn toàn), sau phản ứng thu được 92,1 gam kết tủa. % số mol của axetilen trong X là.
A.70% B. 30% C. 60% D. 40%
Lời giải:
Đáp án D
Hướng dẫn
Gọi số mol của axetilen và propin lần lượt là: x và y mol; x + y = 0,5 mol; 240x + 147y = 92,1 ⇒ x = 0,2 và y = 0,3 ; %naxetilen = 0,2.100%/0,5 = 40%
Bài 59: Cho H2 và 1 olefin có thể tích bằng nhau qua niken đun nóng ta được hỗn hợp A. Biết tỉ khối hơi của A đối với H2 là 23,2. Hiệu suất phản ứng hiđro hoá là 75%. Công thức phân tử olefin là :
A. C2H4 B. C3H6.
C. C4H8 D. C5H10.
Lời giải:
Đáp án C
Hướng dẫn dẫn
Theo giả thiết ta chọn : nH2 = nCnH2n = 1 mol
Phương trình phản ứng :
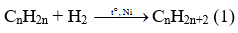
Theo (1) ta thấy, sau phản ứng số mol khí giảm một lượng đúng bằng số mol H2 phản ứng. Hiệu suất phản ứng là 75% nên số mol H2 phản ứng là 0,75 mol. Như vậy sau phản ứng tổng số mol khí là 1+1 – 0,75 = 1,25 mol.
Áp dụng định luật bảo toàn khối lượng ta có : khối lượng của H2 và CnH2n ban đầu bằng khối lượng của hỗn hợp A.
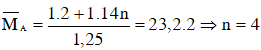
Vậy công thức phân tử olefin là C4H8.
Bài 60: Sau khi tách hidro, hỗn hợp etan và propan tạo thành hỗn hợp etilen và propilen. Khối lượng trung bình của hỗn hợp etilen và propilen nhỏ hơn khối lượng trung bình của hỗn hợp ban đầu là 6,55%. Vậy % etan và propan trong hỗn hợp ban đầu là:
A. 96,18% và 3,82%
B. 98,3% và 1,7%
C. 80% và 20%
D. 95,5% và 4,5%
Lời giải:
Đáp án A
Hướng dẫn
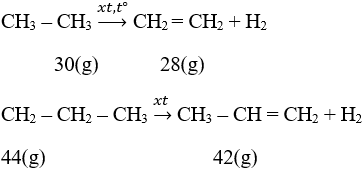
Giả sử ban đầu có 1 mol hỗn hợp; số mol C2H6 là x và C3H8 là 1 – x
M1 = 30x + 44(1 – x)
M2 = 28x + 42(1 – x)
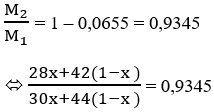
⇒ X = 0,9618
⇒ % C2H6 = 96,18%; % C3H8 = 3,82%
Bài 61: Hỗn hợp X có tỉ khối so với H2 là 21 gồm propan, propen và propin. Khi đốt cháy hoàn toàn 0,1 mol X, tổng khối lượng của CO2 và H2O thu được là
A. 18,60 gam. B. 18,96 gam.
C. 20,40 gam. D. 16,80 gam.
Lời giải:
Đáp án A
Hướng dẫn nCO2 = 3nX = 3.0,1 = 0,3 mol; mX = 0,1.21.2 = 4,2 gam
⇒ nH2O = (4,2 – 0,3.12)/2 = 0,3 mol;
m = mCO2 + mH2O = 0,3.44 + 0,3.18 = 18,6 gam
Bài 62: Hỗn hợp khí X gồm hiđro và một anken. Nung nóng 24,64 lít hỗn hợp X (đktc), có Ni làm xúc tác. Sau phản ứng thu được 25,3 gam hỗn hợp khí Y.Tỷ khối của X so với H2 là:
A. 10,5 gam B. 11,5 gam
C. 12 gam D. 12,5 gam
Lời giải:
Đáp án B
Hướng dẫn
nX = 26,64/22,4 = 1,1 mol; MX.nX = mX = mY ⇒ MX = 25,3/1,1 = 23; dX/H2 = 23/2 = 11,5
Bài 63: Dẫn 6,72 lít một ankin X qua dung dịch AgNO3/NH3 dư thấy thu được 44,1g kết tủa. CTPT của X là:
A. C2H2 B. C3H4.
C. C5H8 D. C4H6.
Lời giải:
Đáp án B
Hướng dẫn nX = 0,3 mol ⇒ Mkết tủa = 44,1/0,3 = 147 ⇒ ankin là C3H4.
Bài 64: Dẫn 3,36 lít hỗn hợp X gồm metan và axetilen vào lượng dư dung dịch AgNO3 trong NH3, thu được m gam kết tủa và có 1,12 lít khí thoát ra. (Thể tích các khí đo (đktc)). Giá trị của m là
A.12,0 B. 24,0 C.13,2 D. 36,0
Lời giải:
Đáp án B
Hướng dẫn
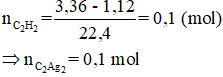
⇒ m = 0,1.240 = 24 (gam)
Bài 65: Cho hỗn hợp X gồm etilen và H2 có tỉ khối so với H2 bằng 4,25. Dẫn X qua bột Ni nung nóng (hiệu suất phản ứng hidro hóa anken bằng 75%), được hỗn hợp Y. Vậy tỉ khối của hỗn hợp Y so với H2 bằng:
A. 5,44
B. 5,23
C. 5.67
D. 6.76
Lời giải:
Đáp án B
Đáp án Gọi a, b là số mol C2H4 và H2 trước phản ứng.
Ta có: 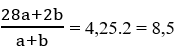
⇔ 28a + 2b = 8,5a + 8,5b ⇔ 19,5a = 6,5b ⇒ a = b/3 hay b = 3a

Bài 66: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,34 mol H2. Giá trị của a là
A.0,46 B. 0,22 C.0,34 D. 0,32
Lời giải:
Đáp án B
Hướng dẫn
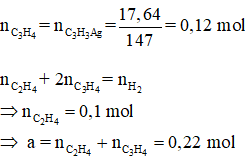
Bài 67: Cho 3,12 gam ankin X phản ứng với 0,1 mol H2 (xúc tác Pd/PdCO3, t°), thu được hỗn hợp Y chỉ có hai hidrocacbon. Công thức phân tử của X là
A. C2H2
B. C5H8
C. C4H6
D. C3H4
Lời giải:
Đáp án A
Hướng dẫn
Gọi CTTQ ankin X: CnH2n-2 (n ≥ 2)
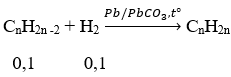
Sau phản ứng thu được 2 hidrocacbon ⇒ ankin X dư
⇒ nX > 0,1 ⇒ MX < 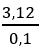
Bài 68: Cho 13,8 gam chất hữu cơ X có công thức phân tử C7H8 tác dùng với một lượng dư dung dịch AgNO3 trong NH3, thu được 45,9 gam kết tủa. X có bao nhiêu đồng phân cấu tạo thỏa mãn chất trên?
A. 5 B. 4 C. 6 D. 2
Lời giải:
Đáp án B
Hướng dẫn
C7H8 + nAgNO3 + nNH3 → C7H8-nAgn + nNH4NO3
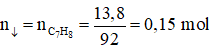
⇒ X có 2 liên kết ba đầu mạch, có 4 cấu tạo:
HC≡C–CH2–CH2–CH2–C≡CH; HC≡C–CH(CH3)–CH2–C≡CH;
HC≡C–CH(C2H5)–C≡CH; HC≡C–C(CH3)2–C≡CH
Bài 69: Hỗn hợp khí A chứa eilen và H2. Tỉ khối của A đối với hiđro là 7,5. Dẫn A đi qua chất xuc tác Ni nung nóng thu được hh khí B có tỉ khối đối với hiđro là 9,0. Hiệu suất phản ứng cộng hiđro của etilen là:
A. 33,3% B. 66,7% C. 25% D. 50%
Lời giải:
Đáp án A
Hướng dẫn
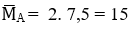
Giả sử nA = 1 mol → mB = mA = 15. 1 = 15 g ; nC2H4 : nH2 = 1:1
Mà 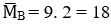
→ 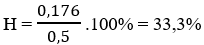
Bài 70: Dẫn ankin X vào lượng dư dung dịch Br2, khối lượng bình đựng dung dịch Br2 tăng 2 gam và có 0,1 mol Br2 đã tham gia phản ứng. Đốt cháy hoàn toàn cũng lượng X trên, hấp thụ sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được m gam kết tủa. Giá trị của m là
A. 15 B. 25 C. 30 D. 20
Lời giải:
Đáp án A
Hướng dẫn
nBr2 = 2nX ⇒ nX = 0,05 mol ⇒ 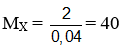
nCaCO3 = nCO2 = 0,05.3 = 0,15 (mol)
→ m↓ = 0,15.100 = 15 gam
Bài 71: Đốt cháy hoàn toàn hỗn m gam hỗn hợp Z gồm hai ankin kế tiếp nhau trong dãy đồng đẳng X và Y (MX < MY), thu được 7,84 lít lít CO2 (đktc) và 4,5 gam H2O. Dẫn m gam Z vào lượng dư dung dịch AgNO3 trong NH3, thu được 15,4 gam kết tủa. Ankin Y là
A. propin B. but-1-in
C. but-2-in D. pent-1-in
Lời giải:
Đáp án B
Hướng dẫn
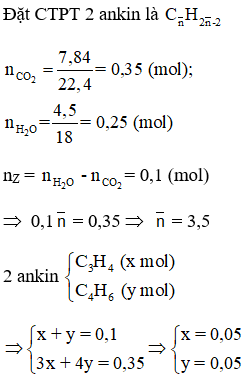
mC3H3Ag = 0,05.147 = 7,35g < 15,4g
⇒ C4H6 tạo kết tủa với AgNO3 trong NH3 ⇒ but-1-in.
Bài 72: Hỗn hợp X gồm anken M và ankin N có cùng số nguyên tử cacbon trong phân tử. Hỗn hợp X có khối lượng 12,4 gam và thể tích 7,72 lít (đktc). Số mol, công thức phân từ của M và N lần lượt là
A. 0,1 mol C3H6 và 0,2 mol C3H4
B. 0,2 mol C2H4 và 0,1 mol C2H2
C. 0,1 mol C2H4 và 0,2 mol C2H2
D. 0,2 mol C3H6 và 0,1 mol C3H4
Lời giải:
Đáp án D
Hướng dẫn
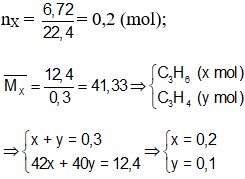

Bài 73: Đun nóng 20,16 lít hỗn hợp khí X gồm C2H4 và H2 dùng Ni xúc tác thì thu được 13,44 lít hỗn hợp khí Y. Cho Y lội thật chậm qua bình đựng dung dịch Br2 dư thì thấy khối lượng bình tăng 2,8 gam. Hiệu suất phản ứng hidro hóa anken:
A. 40% B. 60% C. 65% D. 75%
Lời giải:
Đáp án D
Hướng dẫn
nX = 20,16/22,4 = 0,9 mol; nY = 13,44/22,4 = 0,6 mol; nH2 pư = 0,9 – 0,6 = 0,3 mol; nanken dư = 2,8/28 = 0,1 mol; nanken bđ = 0,1 + 0,3 = 0,4 mol ⇒ nH2 bđ = 0,5 mol ⇒ 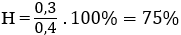
Bài 74: Đốt cháy hoàn toàn 1 lít gồm khí C2H2 và Hiđrocacbon X. Sinh ra 2 lít khí CO2 và 2 lít hơi H2O.(các khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức của X là
A. C2H6 B. C2H4
C. CH4 D. C3H8
Lời giải:
Đáp án A
Hướng dẫn
Đặt CTPT chung của hỗn hợp là:
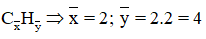
⇒ Hỗn hợp gồm: C2H2 và C2H6
Bài 75: Dẫn V lít (đktc) axetilen qua dung dịch AgNO3/NH3 dư thấy thu được 60 gam kết tủa. Giá trị V là:
A. 5,6 lit B. 11,2 lit
C. 2,8 lit D. 10,11 lit
Lời giải:
Đáp án A
Hướng dẫn n↓ = 60/240 = 0,25 mol ⇒ naxetilen = 0,25.22,4 = 5,6 lít
Bài 76: Cho H2 và 1 olefin có thể tích bằng nhau qua Niken đun nóng ta được hỗn hợp A. Biết tỉ khối hơi của A đối với H2 là 23,2. Hiệu suất phản ứng hiđro hoá là 75%. Công thức phân tử olefin là
A. C2H4. B. C3H6.
C. C4H8. D. C5H10.
Lời giải:
Đáp án C
Hướng dẫn Giả sử nanken = nH2 = 1 mol; nA = 2- 0,75 = 1,25 mol;
Mđ = 23,2.2.1,25/2 = 14,5; 14.n + 2 = 2.14,5 ⇒ n = 4
Bài 77: Khi cho but-1,3-dien phản ứng với HCl theo tỉ lệ mol 1:1 thì số sản phẩm thu được là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án C
Hướng dẫn
Cộng 1: 2 cho 2 sản phẩm.
Cộng 1: 4 cho 1 sản phẩm.
Bài 78: Dẫn 3,36 lít hỗn hợp X gồm 2 anken là đồng đẳng kế tiếp vào bình nước brom dư, thấy khối lượng bình tăng thêm 7,7 gam. Tìm CTPT của 2 anken ?
A. C3H6 và C4H8 B. C4H8 và C5H10
C. C5H10 và C6H12 D. C3H6 và C5H10
Lời giải:
Đáp án A
Hướng dẫn Số mol hỗn hợp X là: nX = 3,36/22,4 = 0,15 mol
Phương trình phản ứng:
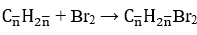
Khối lượng bình brom tăng là khối lượng của 2 anken: mX = 7,7 gam
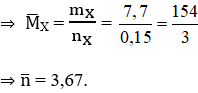
Vậy CTPT của 2 anken kế tiếp là: C3H6 và C4H8
Bài 79: Dẫn 10,8 gam but-1-in qua dd AgNO3/NH3 dư, sau phản ứng thu x gam kết tủa. Giá trị của x là
A. 26,8g B. 16,1g C. 53,6g D. 32,2g
Lời giải:
Đáp án D
Hướng dẫn nankin = 10,8/54 = 0,2 mol; n↓ = 0,2 mol ⇒ x = 0,2.161 = 32,2 g
Bài 80: 2,24 lít hỗn hợp X gồm buta–1,3–đien và penta–1–3-đien (đktc) có thể tác dụng hết tối đa bao nhiêu lít dung dịch brom 0,10 M ?
A. 2l B. 3l
C. 2,5l D. 4l
Lời giải:
Đáp án A
Hướng dẫn nBr2 = 2nX = 0,2 mol ⇒ VBr2 = 0,2/0,1 = 2 lít
Bài 81: Cho 8960 ml (đktc) anken X qua dung dịch brom dư. Sau phản ứng thấy khối lượng bình brom tăng 22,4 gam. Biết X có đồng phân hình học. CTCT của X là :
A. CH2=CHCH2CH3 B. CH3CH=CHCH3.
C. CH3CH=CHCH2CH3 D. (CH3)2C=CH2.
Lời giải:
Đáp án C
Hướng dẫn
Phương trình phản ứng :
CnH2n + Br2 → CnH2nBr2 (1)
Theo giả thiết ta có :
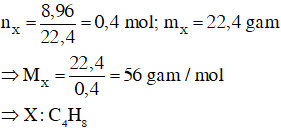
Vì X có đồng phân hình học nên X là : CH3CH=CHCH3.
Bài 82: Cho sơ đồ phản ứng sau:
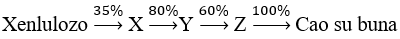
Để điều chế được 2 tấn cao su buna thì khối lượng xenlulozo cần lấy là:
A. 35,71 tấn
B. 39,66 tấn
C. 20,56 tấn
D. 45,67 tấn
Lời giải:
Đáp án A
Hướng dẫn
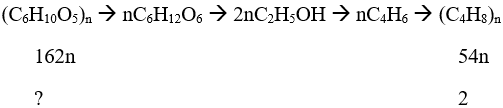
Khối lượng xenlulozo = 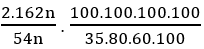
Bài 83: Cho 3,36 lít Hiđrocacbon X (đktc) phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 36 gam kết tủa. Công thức phân tử của X là
A. C4H4 B. C2H2
C. C4H6 D. C3H4
Lời giải:
Đáp án B
Hướng dẫn CxHy + nAgNO3 + nNH3 → CxHy-nAgn + nNH4NO3
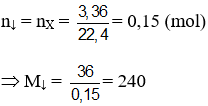
MX = M↓ - 107n ⇒ n = 2; MX = 26 (C2H2)
Bài 84: X, Y, Z là 3 hiđrocacbon kế tiếp trong dãy đồng đẳng, trong đó MZ = 2MX. Đốt cháy hoàn toàn 0,1 mol Y rồi hấp thụ toàn bộ sản phẩm cháy vào 2 lít dung dịch Ba(OH)2 0,1M được một lượng kết tủa là :
A. 19,7 gam. B. 39,4 gam.
C. 59,1 gam. D. 9,85 gam.
Lời giải:
Đáp án A
Hướng dẫn Gọi khối lượng mol của X, Y, Z lần lượt là : M; M + 14; M + 28.
Theo giả thiết ta có :
MZ = 2MX ⇒ M + 28 = 2M ⇒ M = 28.
Vậy X là C2H4, Y là C3H6, Z là C4H8.
Phương trình phản ứng :
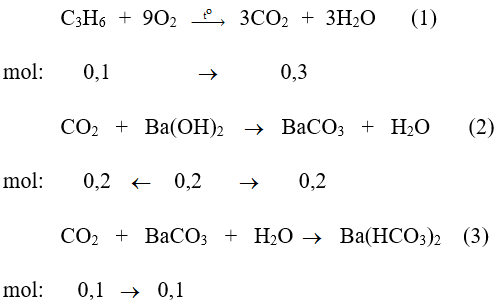
Theo các phản ứng và giả thiết ta thấy số mol BaCO3 thu được là 0,1 mol.
Vậy khối lượng kết tủa thu được là 19,7 gam.
Bài 85: Hidrocacbon X có công thức phân tử là C5H8 có thể cộng hợp với hidro tạo ra ankan mạch nhánh và A có thể tác dụng với AgNO3/NH3 tạo ra kết tủa màu vàng. Vậy tên của X là:
A. 2-metylbut-1in
B. 3-metylbut-1-in
C. pent-1-in
D. 2-metylbut-2-in
Lời giải:
Đáp án B
Hướng dẫn
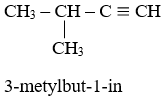
Bài 86: Đốt cháy hoàn toàn a gam hỗn hợp eten, propen, but-2-en cần dùng vừa đủ b lít oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là:
A. 92,4 lít. B. 94,2 lít.
C. 80,64 lít. D. 24,9 lít.
Lời giải:
Đáp án C
Hướng dẫn
CnH2n + 3n/2O2 → nCO2 + nH2O
nO2 =3/2 nCO2 = 3/2 . 2,4 = 3,6 mol ⇒ VO2 = 3,6.22,4 = 80,64 lít
Bài 87: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu đen cần V lít khí C2H4 (đktc). Giá trị tối thiểu của V là
A. 2,240 B. 2,688
C. 4,480 D. 1,344
Lời giải:
Đáp án D
Hướng dẫn
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH
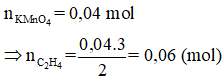
Bài 88: Đốt cháy hoàn toàn 0,1 mol hỗm hợp gồm CH4, C4H10 và C2H4 thu được 0,14 mol CO2 và 0,23mol H2O. Số mol của ankan và anken trong hỗn hợp lần lượt là
A. 0,09 và 0,01 B. 0,01 và 0,09
C. 0,08 và 0,02 D. 0,07 và 0,04
Lời giải:
Đáp án A
Hướng dẫn
CnH2n + 3n/2O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O
nankan = 0,23 – 0,14 = 0,09 mol
⇒ nanken = 0,1 – 0,09 = 0,01 mol
Bài 89: Cho sơ đồ phản ứng sau:
CH4 → A → B → C → Cao su buna
Vậy A, B và C là:
A. etin, butin-1 và buta-1,3-dien
B. etin, vinyl axetilen và buta-1,3-dien
C. n-butan, vinyl axetilen và buta-1,3-dien
D. eten, vinyl axetilen và buta-1,3-dien.
Lời giải:
Đáp án B
Hướng dẫn
Các phương trình phản ứng:
2CH4 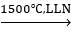
CH2 = CH – C ≡ CH + H2 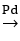
nCH2 = CH – CH = CH2 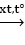
Bài 90: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu nâu đen cần V lít khí C2H4 (ở đktc). Giá trị tối thiểu của V là :
A. 2,240. B. 2,688.
C. 4,480. D. 1,344.
Lời giải:
Đáp án D
Hướng dẫn
Áp dụng định luật bảo toàn electron :
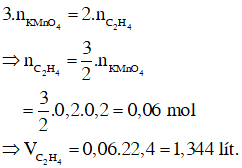

Bài 91: Cho V lít một anken A ở đkc qua bình đựng nước brom dư, có 8 g Br2 đã phản ứng đồng thời khối lượng bình tăng 2,8g. Mặt khác khi cho A phản ứng với HBr chỉ thu được 1 sản phẩm . Giá trị của V và tên của A là:
A. 2,24 lít; propen
B. 2,24 lít; etilen
C. 1,12 lít; but-1-en
D. 1,12 lít; but-2-en
Lời giải:
Đáp án D
Hướng dẫn
CTPT A : CnH2n ; nA = nBr2 = 8/160 = 0,05 mol ⇒ V = 1,12l
MA = 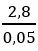
A phản ứng Br2 cho 1sản phẩm ⇒ A có cấu tạo đối xứng ⇒but-2-en
Bài 92: Đốt cháy hoàn toàn 8,96 lít (đktc) hỗn hợp hai anken là đồng đẳng liên tiếp thu được m gam H2O và (m + 39) gam CO2. Hai anken đó là :
A. C2H4 và C3H6. B. C4H8 và C5H10.
C. C3H6 và C4H8. D. C6H12 và C5H10.
Lời giải:
Đáp án C
Hướng dẫn
Đặt CTTB của hai anken (olefin) là 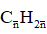
Số mol của hỗn hợp hai anken = 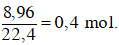
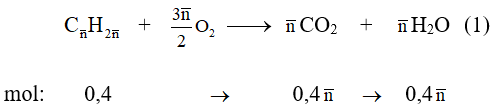
Theo giả thiết và (1) ta có :
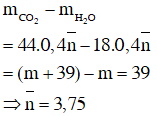
Vì hai anken là đồng đẳng kế tiếp và có số nguyên tử cacbon trung bình là 3,75 nên suy ra công thức phân tử của hai anken là C3H6 và C4H8.
Bài 93: Cho but-1-in phản ứng cộng với H2 (theo tỉ lệ mol 1:1 và xúc tác Pd/PbCO3) thu được sản phẩm hữu cơ có tên là:
A. Butan B. But-2-en
C. But-1-en D. A và C đều đúng.
Lời giải:
Đáp án C
Bài 94: Khi điều chế axetilen bằng phương pháp nhiệt phân nhanh metan thu được hỗn hợp A gồm axetilen, hidro và một phần metan chưa phản ứng. Tỉ khối của hỗn hợp A so với hidro bằng 5. Vậy hiệu suất chuyển hóa metan thành axetilen là:
A. 50%
B. 60%
C. 70%
D. 80%
Lời giải:
Đáp án B
Hướng dẫn Phương trình phản ứng:
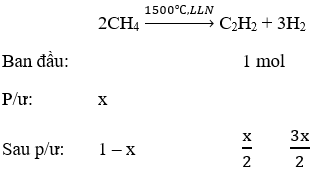
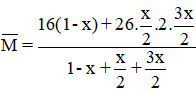
⇒ x = 0,6
⇒ Vậy hiệu suất chuyển hóa là 60%
Bài 95: Anken A phản ứng hoàn toàn với dung dịch KMnO4 được chất hữu cơ B có MB = 1,81MA. CTPT của A là:
A. C2H4 B. C3H6
C. C4H8 D. C5H10
Lời giải:
Đáp án B
Hướng dẫn
CTPT của anken A: CnH2n; chất hữu cơ B: CnH2n+2O2
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓+ 2KOH
MB = 1,81 MA ⇔ 14n + 34 = 1,81.14n ⇒ n = 3
Bài 96: Cho các chất hữu cơ :
CH2=CH–CH2–CH3 (M)
CH≡C–CH2–CH3 (N)
CH2=C=CH–CH3 (P)
CH2=CH–CH=CH2 (Q)
CH2=C(CH3)–CH3 (R)
Những chất cho cùng 1 sản phẩm cộng hiđro là
A. M, N, P, Q B. M, N, R
C. M, N, R D. Q, R
Lời giải:
Đáp án A
Bài 97: Đốt cháy hoàn toàn 2,24 lít đkc 1 hiđrocacbon X mạch hở, sau đó dẫn sản phẩm cháy lần lượt qua dung dịch H2SO4 và dung dịch Ca(OH)2 dư. Sau thí nghiệm thấy khối lượng bình đựng dung dịch axit tăng 5,4g, bình đựng dung dịch Ca(OH)2 có 30g kết tủa. Tìm CTPT của X.
A. C2H4 B. C3H6
C. C4H8 D. C5H10
Lời giải:
Đáp án C
Hướng dẫn Số mol X là: nX = 2,24/22,4 = 0,1 mol
Khối lượng bình đựng dung dịch axit tăng là khối lượng của H2O:
mH2O = 5,4 gam ⇒ nH2O = 5,4/18 = 0,3 mol
Số mol CO2 là: nCO2 = nCaCO3 = 30/100 = 0,3 mol
Nhận thấy: nH2O = nCO2 ⇒ hidrocacbon X là anken
Phương trình đốt cháy:
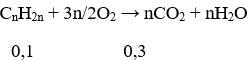
Ta có: 0,1.n = 0,3 ⇒ n = 3. Vậy CTPT của X là C3H6
Bài 98: Để tinh chế khí C2H2 có lẫn tạp chất CH4, SO2, C2H4 và CO2 thì người ta dùng những dãy hóa chất nào dưới đây:
A. KOH, HCl
B. Br2, HCl
C. AgNO3/ HCl
D. KMnO4
Lời giải:
Đáp án C
Hướng dẫn
C2H2 + [Ag(NH3)2]OH → CAg≡CAg + H2O + 2NH3
CAg≡CAg + HCl → C2H2 + AgCl
Bài 99: Cho m gam propin tác dụng với H2 dư (Ni, tº) thu được (m + 8) gam sản phẩm hữu cơ Y. Giá trị của m là:
A. 80 gam B. 40 gam
C. 160 gam D. 120 gam
Lời giải:
Đáp án A
Hướng dẫn
npropin = nH2/2 = 8/4 = 2 mol; m = 2.40 = 80 g
Bài 100: Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Tính hiệu suất của phản ứng hiđro hoá?
A. 20% B. 25%.
C. 50% D. 40%
Lời giải:
Đáp án C
Hướng dẫn
Ta có : 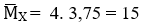
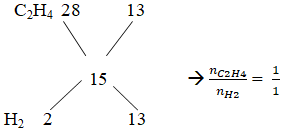
Vậy hiệu suất tính theo anken hoặc H2 cũng được
Giả sử: nX = 1 mol → mX = 15. 1 = 15 g = mY
Mà 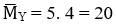
→