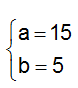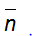3 dạng bài tập về Hidrocacbon no trong đề thi Đại học có giải chi tiết - Hoá học lớp 11
3 dạng bài tập về Hidrocacbon no trong đề thi Đại học có giải chi tiết
Với 3 dạng bài tập về Hidrocacbon no trong đề thi Đại học có giải chi tiết Hoá học lớp 11 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hidrocacbon no từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Hiđrocacbon no gồm: Ankan (CnH2n+2; n≥1) và xicloankan (CnH2n; n ≥3)
Dạng 1: Phản ứng thế halogen (Halogen hóa)
Phương pháp:
Sử dụng phương trình:
CnH2n+2 + aX2 to→ CnH2n+2-aXa + aHX
Tùy thuộc vào dữ kiện đề bài cho sản phẩm là monohalogen, đihalogen,... để biết giá trị của a.
Dựa vào số mol, khối lượng hoặc phân tử khối để có thể tìm ra giá trị của n
Ví dụ minh họa
Ví dụ 1 : Khi brom hóa một ankan chỉ thu được một dẫn xuất monobrom duy nhất có tỉ khối hơi đối với hiđro là 75,5. Tên của ankan đó là (cho H = 1, C = 12, Br = 80)
A. 3,3-đimetylhecxan. B. 2,2-đimetylpropan.
C. isopentan. D. 2,2,3-trimetylpentan
Hướng dẫn giải:
Sản phẩm là monobrom ⇒ Công thức: CnH2n+1Br
dmonobrom/H2 = 75,5 ⇒ Mmonobrom = 151
⇒ 14n + 81 = 151 ⇒ n = 5. Brom hóa C5H12 chỉ thu được một dẫn xuất
⇒ Công thức cấu tạo của C5H12 là: 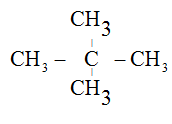
⇒ Đáp án B
Ví dụ 2 : Khi cho ankan X (trong phân tử có phần trăm khối lượng cacbon bằng 83,72%) tác dụng với clo theo tỉ lệ số mol 1:1 (trong điều kiện chiếu sáng) chỉ thu được 2 dẫn xuất monoclo đồng phân của nhau. Tên của X là :
A. 3-metylpentan. B. 2,3-đimetylbutan.
C. 2-metylpropan. D. butan.
Hướng dẫn giải:
Đặt CTPT của ankan X là CnH2n+2. Theo giả thiết ta có :
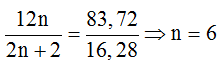
⇒ CTPT của ankan X là C6H14.
Vì X phản ứng với Cl2 theo tỉ lệ mol 1:1 chỉ thu được hai sản phẩm thế monoclo nên X có tên là 2,3-đimetylbutan ⇒ Đáp án B
Ví dụ 3 : Khi clo hóa metan thu được một sản phẩm thế chứa 89,12% clo về khối lượng. Công thức của sản phẩm là :
A. CH3Cl. B. CH2Cl2. C. CHCl3. D. CCl4
Hướng dẫn giải:
Phản ứng của CH4 với clo :
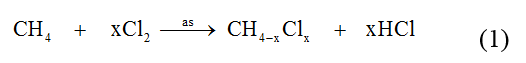
Theo giả thiết ta có : 35,5x/(16-x) = 89,12/10,88 ⇒ x = 3
Vậy công thức của sản phẩm thế là : CHCl3 ⇒ Đáp án C
Dạng 2: Phản ứng tách ( Đề hiđrohóa; craking)
Phương pháp:
+ Sử dụng bảo toàn khối lượng: mtrước = msau
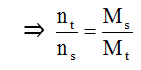
+ Khi crackinh ankan C3H8, C4H10: nkhí tăng = nankan phản ứng
+ Đối với các ankan có từ 5C trở lên do các ankan sinh ra lại có thể tiếp tục tham gia phản ứng crackinh nên số mol hỗn hợp sản phẩm luôn 2 lần số mol ankan phản ứng.
+ Đối với phản ứng đề hiđro từ ankan thì : nH2 tạo thành = nkhí tăng
Ví dụ minh họa
Ví dụ 1 : Crackinh 1 ankan A thu được hỗn hợp sản phẩm B gồm 5 hiđrocacbon có khối lượng mol trung bình là 36,25 gam/mol, hiệu suất phản ứng là 60%. Công thức phân tử của A là :
A. C4H10. B. C5H12. C. C3H8. D. C2H6.
Hướng dẫn giải:
Gọi nankan = 1 mol ⇒nankan pư = 0,6 mol = n khí tăng
nB = 1 + 0,6 = 1,6 mol
Áp dụng định luật bảo toàn khối lượng ta có :
mA = mB
⇒ A là C4H10 ⇒ Đáp án A

Ví dụ 2 : Craking 40 lít n-butan thu được 56 lít hỗn hợp A gồm H2, CH4, C2H4, C2H6, C3H6, C4H8 và một phần n-butan chưa bị craking (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất). Giả sử chỉ có các phản ứng tạo ra các sản phẩm trên. Hiệu suất phản ứng tạo ra hỗn hợp A là :
A. 40%. B. 20%. C. 80%. D. 20%.
Hướng dẫn giải:
Vkhí tăng = Vankan phản ứng = 16 lít
H% = Vpư/Vbđ .100% = 16/40.100% = 40%
⇒ Đáp án A
Ví dụ 3 : Crackinh hoàn toàn 6,6 gam propan được hỗn hợp X gồm hai hiđrocacbon. Dẫn toàn bộ X qua bình đựng 400 ml dung dịch brom a mol/l thấy khí thoát ra khỏi bình có tỉ khối so metan là 1,1875. Giá trị a là:
A. 0,5M. B. 0,25M. C. 0,175M. D. 0,1M.
Hướng dẫn giải:
Các phản ứng xảy ra :
C3H8 → CH4 + C2H4 (1)
C2H4 + Br2 → C2H4Br2 (2)
Theo (1) và giả thiết ta có : nC3H8 = nC2H4 = nCH4 = 6,6/44 = 0,15 mol
Sau khi qua bình đựng brom khí thoát ra khỏi bình có: Mkhí= 1,875.16 = 19
⇒ ngoài CH4 còn có C2H4 dư.
Áp dụng sơ đồ đường chéo cho hỗn hợp CH4 và C2H4 dư ta có :
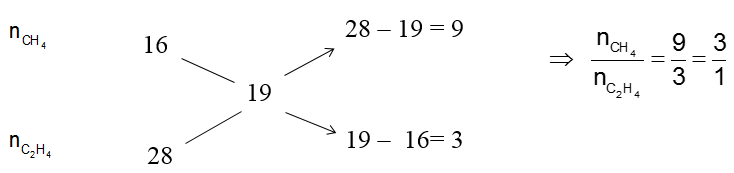
⇒ nC2H4 dư = 0,05 mol, nC2H4 pư với Br2 = nBr2 pư = 0,1 mol.
CM Br2 = 0,1/0,4 = 0,25M ⇒ Đáp án B
Ví dụ 4 : Crackinh 4,4 gam propan được hỗn hợp X (gồm 3 hiđrocacbon). Dẫn X qua nước brom dư thấy khí thoát ra có tỉ khối so với H2 là 10,8. Hiệu suất crackinh là :
A. 90%. B. 80%. C. 75%. D. 60%.
Hướng dẫn giải:
Các phản ứng xảy ra :
C3H8 → CH4 + C2H4 (1)
C2H4 + Br2 → C2H4Br2 (2)
Theo (1) ta đặt : nC3H8 pư = nCH4 = nC2H4 = a mol; nC3H8 dư = b mol
Sau khi qua bình đựng brom dư, khí thoát ra khỏi bình ngoài CH4 còn có C3H8 dư, khối lượng mol trung bình của hỗn hợp này là 21,6.
Áp dụng sơ đồ đường chéo cho hỗn hợp CH4 và C3H8 dư ta có :
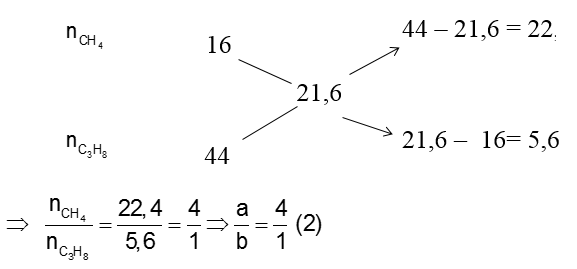
Vậy hiệu suất phản ứng crackinh là : H = a/(a+b).100% = 80%
⇒ Đáp án B

Ví dụ 5 : Craking n-butan thu được 35 mol hỗn hợp A gồm H2, CH4, C2H4, C2H6, C3H6, C4H8 và một phần butan chưa bị crakinh. Giả sử chỉ có các phản ứng tạo ra các sản phẩm trên. Cho A qua bình nước brom dư thấy còn lại 20 mol khí. Nếu đốt cháy hoàn toàn A thì thu được x mol CO2.
a. Hiệu suất phản ứng tạo hỗn hợp A là :
A. 57,14%. B. 75,00%. C. 42,86%. D. 25,00%.
b. Giá trị của x là :
A. 140. B. 70. C. 80. D. 40
Hướng dẫn giải:
a. Tính hiệu suất phản ứng
Phương trình phản ứng :
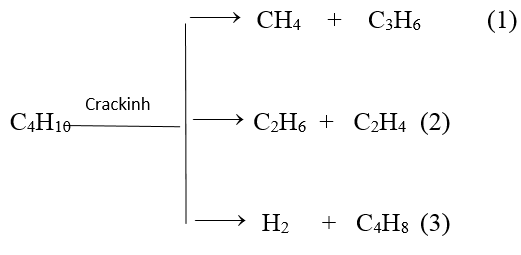
Theo các phản ứng và giả thiết ta đặt :
nC4H10 p/u = n(CH4, C2H6, H2) = n(C3H6, C2H4, C4H8) = a mol
nC4H10 dư = b mol => nA = 2a + b = 35 (*)
Khi cho hỗn hợp A qua bình dựng brom dư thì chỉ có C3H6, C2H4, C4H8 phản ứng và bị giữ lại trong bình chứa brom. Khí thoát ra khỏi bình chứa brom là H2, CH4, C2H6, C4H10 dư nên suy ra :
a + b = 20 (**)
Từ (*) và (**) ta có :
Vậy hiệu suất phản ứng crackinh là : H = 15/(15+5).100% = 75%
⇒ Đáp án B
b. Đốt cháy A cũng chính là đốt cháy n – butan
nCO2 = 4nbutan = 4 (a + b) = 4.20 = 80 mol
⇒ Đáp án C
Dạng 3: Phản ứng đốt cháy
Phương pháp :
+ Đốt cháy một ankan hay hỗn hợp các ankan : CnH2n+2
nCO2 < nH2O
nH2O – nCO2 = nankan
+ Đốt cháy một xicloankan hay hỗn hợp các xicloankan: CnH2n
nCO2 < nH2O
Chú ý:
+ Khi gặp bài tập liên quan đến hỗn hợp các ankan thì nên sử dụng phương pháp trung bình quy về một ankan 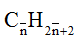
+ Khi đốt cháy hỗn hợp gồm ankan và các chất có công thức phân tử là CnH2n (có thể là anken hoặc xicloankan) ⇒ nankan = nH2O – nCO2
+ Khi đốt cháy hoàn toàn hỗn hợp gồm ankan (CmH2m+2) và các chất có công thức phân tử là CnH2n-2 mà thu được số mol H2O bằng số mol CO2 ⇒% V của CmH2m+2 bằng % Vcủa CnH2n-2

Ví dụ minh họa
Ví dụ 1 : Hỗn hợp khí A gồm etan và propan. Đốt cháy hỗn hợp A thu được khí CO2 và hơi H2O theo tỉ lệ thể tích 11:15.
a. Thành phần % theo thể tích của etan và propan lần lượt là :
A. 18,52% ; 81,48%. B. 45% ; 55%.
C. 28,13% ; 71,87%. D. 25% ; 75%.
b. Thành phần % theo khối lượng etan và propan lần lượt là :
A. 18,52% ; 81,48%. B. 45% ; 55%.
C. 28,13% ; 71,87%. D. 25% ; 75%.
Hướng dẫn giải:
a. Đặt CTPT trung bình của etan và propan là :
Phản ứng cháy :
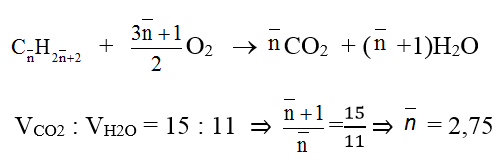
Áp dụng sơ đồ đường chéo cho số nguyên tử cacbon trung bình của hai chất ta có:
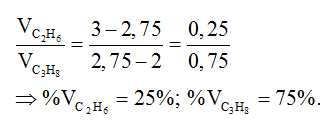
⇒ Đáp án D
b. Thành phần phần trăm về khối lượng của các chất là :
%C2H6 = 0,25.30/(0,25.30+0,75.44).100% = 18,52%
⇒ %C3H8 = 81,48%.
⇒ Đáp án A
Ví dụ 2 : Đốt cháy hoàn toàn 6,72 lít hỗn hợp A (đktc) gồm CH4, C2H6, C3H8, C2H4 và C3H6, thu được 11,2 lít khí CO2 (đktc) và 12,6 gam H2O. Tổng thể tích của C2H4 và C3H6 (đktc) trong hỗn hợp A là :
A. 5,60. B. 3,36. C. 4,48. D. 2,24.
Hướng dẫn giải:
Trong hỗn hợp A, thay các chất CH4, C2H6, C3H8 bằng một chất CnH2n+2 (x mol); thay các chất C2H4, C3H6 bằng một chất CmH2m (y mol). Suy ra x + y = 0,3 (*).
Các phương trình phản ứng :
CnH2n+2 + (3n+1)/2 O2 to→ nCO2 + ( n +1)H2O
x → (3n+1)/2.x xn x(n+1) (mol)
CmH2m + 3m/2O2 to→ mCO2 + mH2O
y → 3m/2.y ym ym (mol)
⇒ x = nH2O - nCO2 = 0,7 – 0,5 = 0,2 mol
VC2H4 + C3H6 = 0,1.22,4 = 2,24 lít. ⇒ Đáp án D
Ví dụ 3 : Đốt cháy hoàn toàn hỗn hợp A gồm CH4, C2H6, C3H8, C2H2, C3H4, C4H6 thu được a mol CO2 và 18a gam H2O. Tổng phần trăm về thể tích của các ankan trong A là :
A. 30%. B. 40%. C. 50%. D. 60%.
Hướng dẫn giải:
Trong hỗn hợp A, thay các chất C2H2, C3H4, C4H6 → CnH2n-2 (x mol) ; thay các chất CH4, C2H6, C3H8 → CmH2m+2 (y mol).
Phương trình phản ứng :
CnH2n+2 + (3n+1)/2 O2 to→ nCO2 + ( n +1)H2O
x → (3n-1)/2.x xn x(n+1) (mol)
CmH2m-2 + (3m-1)/2O2 to→ mCO2 + (m-1)H2O
y → (3m-1)/2.y ym y(m-1) (mol)
Ta có: nCO2 =nH2O = a mol
⇒ nx + ny = (n-1)x + (m +1)y ⇒ x =y
⇒ %VCnH2n+2 = % VCnH2n-2 = 50%
⇒ Đáp án C