Các dạng bài tập Nhóm Nitơ, Photpho chọn lọc, có đáp án chi tiết - Hoá học lớp 11
Các dạng bài tập Nhóm Nitơ, Photpho chọn lọc, có đáp án chi tiết
Với Các dạng bài tập Nhóm Nitơ, Photpho chọn lọc, có đáp án chi tiết Hoá học lớp 11 tổng hợp các dạng bài tập, trên 200 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nhóm Nitơ, Photpho từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Tổng hợp Lý thuyết chương Nhóm Nitơ, Photpho
- Lý thuyết Khái quát Nhóm Nitơ Xem chi tiết
- Lý thuyết Tính chất của Nitơ Xem chi tiết
- Lý thuyết Tính chất của Amoniac và muối amoni Xem chi tiết
- Lý thuyết Tính chất của Axit nitric và muối nitrat Xem chi tiết
- Lý thuyết Tính chất của Photpho Xem chi tiết
- Lý thuyết Tính chất của Axit Photphoric và muối Photphat Xem chi tiết
- Lý thuyết Phân bón hóa học Xem chi tiết
- Lý thuyết Tính chất của Nitơ và hợp chất của chúng Xem chi tiết
- Lý thuyết Tính chất của Photpho và hợp chất của chúng Xem chi tiết
Phương pháp giải các dạng bài tập chương Nhóm Nitơ, Photpho
- 8 dạng bài tập về Nito, Photpho trong đề thi Đại học có giải chi tiết
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrat
- Dạng 2: Phương pháp nhận biết các chất trong Nhóm Nitơ
- Dạng 3: Viết và cân bằng phương trình hóa học Nhóm Nitơ
- Dạng 4: Các dạng bài tập về Amoni
- Dạng 5: Các dạng bài tập về axit nitric
- Dạng 6: Nhiệt phân muối nitrat
- Dạng 7: Bài tập về axit phophoric
- Dạng 8: Bài tập về phân bón
- Bài tập về Muối Amoniac và Muối Amoni cực hay, có lời giải chi tiết
- Bài tập về Axit Photphoric và Muối Photphat cực hay, có lời giải chi tiết
- Bài tập về Axit Nitric (HNO3) và muối Nitrat cực hay, có lời giải chi tiết
- Bài tập về Nitơ (N2) cực hay, có lời giải chi tiết
- Bài tập về Phân bón hóa học cực hay, có lời giải chi tiết
- Bài tập về Photpho (P) cực hay, có lời giải chi tiết
Bài tập trắc nghiệm
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải chi tiết (cơ bản)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải chi tiết (nâng cao)
Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrat
Bài 1: Có thể thu được nitơ từ phản ứng nào sau đây ?
A. Đun nóng dung dịch bão hòa natri nitrit với amoni Clorua.
B. Nhiệt phân muối bạc nitrat.
C. Cho bột Cu vào dung dịch HNO3 đặc nóng.
D. Cho muối amoni nitrat vào dung dịch kiềm.
Lời giải:
Đáp án: A
Bài 2: Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do
A. trong phân tử N2 có liên kết ba rất bền.
B. trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết.
C. nguyên tử nitơ có độ âm điện kém hơn oxi.
D. nguyên tử nitơ có bán kính nhỏ.
Lời giải:
Đáp án: A
Bài 3: Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là chất oxi hóa ?
A. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. 4NH3 + 5O2 → 4NO + 6H2O
D. 2NH3 + 2 Na → 2NaNH2 + H2
Lời giải:
Đáp án: D
Bài 4: Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là :
A. HCl, O2, Cl2, FeCl5.
B. H2SO4, Ba(OH)2, FeO, NaOH
C. HCl, HNO3, AlCl3, CaO
D. KOH, HNO3, CuO, CuCl2
Lời giải:
Đáp án: A
Bài 5: Trong phòng thí nghiệm người ta điều chế HNO3 từ
A. NH3 và O2
B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc.
D. NaNO2 và HCl đặc.
Lời giải:
Đáp án: C
Bài 6: Cho các phản ứng sau :
Ca3(PO4)2 + 3H2SO4 đặc → 3CaSO4 + 2H3PO4 (1)
Ca3(PO4)2 + 2H2SO4 đặc → 2CaSO4 + Ca(H2PO4)2 (2)
Ca3(PO4)2 + 4H2SO4 đặc → 3 Ca(H2PO4)2 (3)
Ca3(OH)2 + 2H2SO4 đặc → Ca(H2PO4)2 + 2H2O (4)
Những phản ứng xảy ra trong quá trình điều chế supephotphat kép từ Ca(H2PO4)2 là:
A. (2), (3).
B. (1), (3).
C. (2), (4).
D. (1), (4).
Lời giải:
Đáp án: B
Bài 7: Phát biểu nào sau đây không đúng ?
A. Supephotphat kép cố độ dinh dưỡng thấp hơn supephotphat đơn.
B. Nitơ và photpho là hai nguyên tố không thể thiếu cho sự sống.
C. Tất cả các muối nitrat đều bị nhiệt phân hủy.
D. Tất cả các muối đihiđrophotphat đều dễ tan trong nước.
Lời giải:
Đáp án: A
Bài 8: Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa ?
A. ZnS + HNO3(đặc nóng)
B. Fe2O3 + HNO3(đặc nóng)
C. FeSO4 + HNO3(loãng)
D. Cu + HNO3(đặc nóng)
Lời giải:
Đáp án: B
Bài 9: Khi nhiệt phân, nhóm các muối nitrat cho sản phẩm kim loại, khí NO2, O2 là
A. Cu(NO3)2 , Pb(NO3)2.
B. Ca(NO3)2 , Hg(NO3)2, AgNO3.
Lời giải:
Đáp án: D
Bài 10: Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm
A. FeO, NO2, O2.
B. Fe2O3, NO2.
C. Fe, NO2, O2.
D. Fe2O3, NO2 , O2.
Lời giải:
Đáp án: D
Bài 11: Nhận định nào sau đây là sai ?
A. HNO3 phản ứng với tất cả bazơ.
B. HNO3 (loãng, đặc, nóng) phản ứng với hầu hết kim loại trừ Au, Pt.
C. Tất cả các muối amoni khi nhiệt phân đều tạo khí amoniac.
D. Hỗn hợp muối nitrat và hợp chất hữu cơ nóng chảy có thể bốc cháy.
Lời giải:
Đáp án: C
Bài 12: Thành phần chính của quặng apatit là
A. CaP2O7
B. Ca(PO3)2
C. 3Ca(PO4)2.CaF2
D. Ca3(PO4)2
Lời giải:
Đáp án: C
Bài 13: Phát biểu nào sau đây là sai ?
A. Cấu hình electron nguyên tử của photpho là 1s22s22p63s23p6.
B. Photpho chỉ tồn tại ở 2 dạng thù hình photpho đỏ và photpho trắng.
C. Photpho trắng hoạt động mạnh hơn photpho đỏ
D. Ở nhiệt độ thường photpho hoạt động mạnh hơn nitơ.
Lời giải:
Đáp án: B
Bài 14: Phản ứng nào sau đây được sử dụng để điều chế H3PO4 trong phòng thí nghiệm ?
A. P + HNO3 đặc, nóng
B. Ca3(PO4)2 + H2SO4 đặc
C. P2O5 + H2O
D. HPO3 + H2O
Lời giải:
Đáp án: A
Bài 15: Trong công nghiệp, photpho được điều chế từ phản ứng nung hỗn hợp các chất nào sau đây ?
A. Quặng photphorit, đá xà vân và than cốc
B. Quặng photphorit, cát và than cốc
C. Diêm tiêu, than gỗ và lưu huỳnh
D. Cát trắng, đá vôi và sođa
Lời giải:
Đáp án: B
Các dạng bài tập về Amoni
A. Phương pháp giải & Ví dụ minh họa
1. Khả năng tạo phức
Lý thuyết và Phương pháp giải
- Nắm chắc kiến thức về phản ứng khử - tạo phức của NH3:
- Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2 ).
Ví dụ : 2NH3 + 3CuO −tº→ 3Cu + N2 +3H2O
- Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn), tạo thành các dung dịch phức chất :
Với Cu(OH)2: Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Ví dụ minh họa
Bài 1: Cho lượng khí NH3 đi từ từ qua ống sứ chứa 3,2g CuO nung nóng đến khi phản ứng xảy ra hoàn toàn ; thu được rắn A và 1 hỗn hợp khí B. Chất rắn A phản ứng vừa đủ với 20 ml HCl 1M.
a. Viết ptpu.
b. Tính thể tích khí N2 (đktc) tạo thành sau phản ứng.
Hướng dẫn:
a. 2NH3 + 3CuO −tº→ 3Cu + N2↑ + 3H2O
Chất rắn A: Cu và CuO dư
CuO + 2HCl → CuCl2 + H2O
b. nCuO = nHCl/2 = 0,02/2 = 0,01 mol
số mol CuO tham gia phản ứng khử là: 3,2/80 – 0,01= 0,03 mol
⇒ VN2 = 0,01. 22,4 = 2,24 lít
Bài 2: Thổi từ từ NH3 đến dư vào 400 gam dung dịch CuCl2 6,75%
a. Khi lượng kết tủa thu được cực đại thì thể tích NH3 (đktc) đã dùng là bao nhiêu?
b. Khi kết tủa tan hết thì thể tích NH3 (đktc) đã dùng là bao nhiêu?
Hướng dẫn:
nCuCl2 = 400.6,75/100.135= 0,2 mol
Phương trình phản ứng:
CuCl2 + 2NH3 + 2H2O → Cu(OH)2↓ + 2NH4Cl (1)
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (2)
a. Khi lượng kết tủa cực đại thì chỉ xảy ra phản ứng (1)
⇒ nNH3 = 0,2.2 = 0,4 mol ⇒ VNH3 = 0,4. 22,4 = 8,96 lít
b. Khi kết tủa tan hết xảy ra cả phản ứng (1) và phản ứng (2)
nNH3 = 0,2.2 + 0,2.4 = 1,2 mol ⇒ VNH3 = 1,2. 22,4 = 26,88 lít
Bài 3: Thổi từ từ NH3 đến dư vào 300 gam dung dịch AgNO3 8,5%. Khi kết tủa tan hết thì thể tích NH3 (đktc) đã dùng là:
A. 4,48 lit B. 3,36 lit C. 10,08 lit D. 6,72 lit
Bài 4: Hiện tượng nào xảy ra khi dẫn khí NH3 đi qua ống đựng bột CuO nung nóng
A. Bột CuO từ màu đen sang màu trắng.
B. Bột CuO từ màu đen sang màu đỏ, có hơi nước ngưng tụ.
C. Bột CuO từ màu đen sang màu xanh, có hơi nước ngưng tụ.
D. Bột CuO không thay đổi màu.
Hướng dẫn:
Đáp án B
Bài 5: Cho 200 gam dd FeCl3 16,25% vào dung dịch NH3 8,5% (vừa đủ) thu được dung dịch X và m gam kết tủa. Giá trị của m là:
Hướng dẫn:
nFeCl3 = 200.16,25/(100.162,5) = 0,2 mol ⇒ nFe(OH)3 = 0,2 mol ⇒ m = 0,2.107 = 21,4 gam
2. BT về muối moni
Lý thuyết và Phương pháp giải
Nắm chắc kiến thức về tính chất hóa học của muối amoni:
- Tác dụng với dung dịch kiềm: NH4+ + OH- → NH3↑ + H2O
- Phản ứng nhiệt phân:
+ Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3
+ Muối amoni chứa gốc cuả axit có tính oxi hóa khi bị nhiêt phân cho ra N2, N2O .
- Áp dụng các công thức tính mol, nồng độ để giải quyết bài toán.
Ví dụ minh họa
Bài 1: Cho 23,9g hh X gồm NH4Cl và (NH4)2SO4 tác dụng hết với xút, đun nóng thu được 8,96 lít khí (đkc)
a. Tính % khối lượng mỗi chất trong dd X.
b. Cho 4,78g hh X tác dụng với BaCl2 có dư. Tính khối lượng kết tủa thu được
Hướng dẫn:
a. Phương trình phản ứng:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
(NH4)2SO4 + 2NaOH → 2NH3↑ + Na2SO4 + H2O
Ta có : 53,5x + 132y = 23,9 (1); x + 2y = 0,4 (2)
Từ 1, 2 ta có; x = 0,2 và y = 0,1.
%mNH4Cl = 0,2.53,5/23,9 = 44,77% ⇒ %m(NH4)2SO4 = 55,23 %
b. Trong 4,78 gam hỗn hợp X ⇒ n(NH4)2SO4 = 0,02 mol
⇒ nBaSO4 = 0,02.233 = 4,46 gam
Bài 2: Hỗn hợp A gồm 2 muối NH4Cl và NH4NO3 được chia thành 2 phần bằng nhau:
Phần 1: Tác dụng hết với AgNO3 thu được 14,35 gam kết tủa.
Phần 2: Đun nóng với NaOH 0,5M tạo thành 6,72 lít khí (đktc)
a. Tính khối lượng hh A.
b. Tính thể tích NaOH cần dùng.
Hướng dẫn:
Phương trình phản ứng:
NH4Cl + AgNO3 → NH4NO3 + AgCl↓
NH4Cl + NaOH → NH3↑ + NaCl + H2O
NH4NO3 + NaOH → NH3↑ + NaNO3 + H2O
nNH4Cl = nAgCl = 14,35/143,5 = 0,1 mol
nNH4NO3 = 0,3-0,1 = 0,2 mol
a. Khối lượng hỗn hợp A:
mA = 2.(0,1.53,5 + 0,2.80) = 21,35 gam
b. Thể tích NaOH cần dung ở phần 2 là:
V = 0,3/0,5 = 0,6 lít
Bài 3: Cho dd Ba(OH)2 đến dư vào 100ml dd X có chứa các ion: NH4+, SO42-, NO3- thì có 23,3 g một kết tủa được tạo thành và đun nóng thì có 6,72 lit (đktc) một chất khí bay ra. Nồng độ mol/l của (NH4)2SO4 và NH4NO3 trong dd X là:
Hướng dẫn:
nSO42- = nBaSO4 = 23.3/233 =0,1 mol; nNH4+ = nNH3 = 6,72/22,4 = 0,3 mol
nNO3- = 0,3-2.0,1 = 0,1 mol ⇒ CM((NH4)2SO4) = 0,1/0,1 = 1M; CM(NH4NO3) = 0,1/0,1 = 1M
Bài 4: Cho dd NH4NO3 tác dụng vừa đủ với dd hiđroxit của kim loại R (tº), thu được 4,48 lit khí (đktc) và dung dịch X. Cô cạn dd X thu được 26,1 gam muối khan. Kim loại R là:
Hướng dẫn:
Gọi hóa trị của R là n. nNH4NO3 = 0,2 mol ⇒ nR(OH)n = 0,2/n mol
M = mNO3- + mR = 0,2.62 + 0,2.R/n = 26,1 ⇒ R =137 và n = 2 ⇒ R là Ba
B. Bài tập trắc nghiệm
Bài 1: Khi cho NH3 vào bình clo, lửa bùng cháy kèm theo "khói" trắng bay ra. "khói" trắng đó là:
A. NH4Cl B. HCl C. N2 D. Cl2
Lời giải:
Đáp án: A
Bài 2: Cho từ từ đến dư NH3 vào dd FeCl3, ZnCl2, AlCl3, CuCl2. Lấy kết tủa đem nung đến khối lượng không đổi được chất rắn X. Cho CO dư đi qua X nung nóng thì chất rắn thu được chứa:
A. ZnO, Cu, Fe. B. ZnO, Cu, Al2O3, Fe
C. Al2O3, ZnO, Fe D. Al2O3, Fe.
Lời giải:
Đáp án: D
Bài 3: Nhỏ từ từ dd NH3 cho đến dư vào ống nghiệm đựng dd CuSO4. Hiện tượng quan sát được là:
A. Dd màu xanh thẫm tạo thành
B. Có kết tủa màu xanh lam tạo thành
C. Có kết tủa màu xanh lam tạo thành và có khí màu nâu đỏ thoát ra.
D. Lúc đầu có kết tủa màu xanh lam, sau đó kết tủa tan dần tạo thành dd màu xanh thẫm.
Lời giải:
Đáp án: D
Bài 4: Có những nhận định sau về muối amoni:
(1) Tất cả muối amoni đều tan trong nước;
(2) Các muối amoni đều là chất điện li mạnh, phân li hoàn toàn tạo ra ion NH4+ có môi trường bazơ;
(3) Muối amoni đều phản ứng với dd kiềm giải phóng khí amoniac;
(4) Muối amoni kém bền đối với nhiệt.
Nhóm gồm các nhận định đúng :
A. 1, 2, 3 B. 1, 2, 4 C. 1, 3, 4 D. 2, 3, 4
Lời giải:
Đáp án: C
Bài 5: Dẫn 2,24 lit NH3 (đktc) qua ống đựng 16 gam CuO (tº), phản ứng hoàn toàn thu được chất rắn X. Thể tích dd HCl 2M đủ để tác dụng hết với X là:
A. 0,15 lit B. 0,05 lit C. 0,1 lit D. 0,2 lit
Lời giải:
Đáp án: B
nCuO dư = 0,2-0,15 = 0,05 mol ⇒ nHCl = 0,05.2 = 0,1 mol ⇒ VHCl = 0,1/2 = 0,05 lít.
Bài 6: Cho 100 ml dung dịch X chứa Al(NO3)3 0,2M, Cu(NO3)2 0,1M và AgNO3 0,2M tác dụng với dung dịch NH3 dư thu được m gam kết tủa. Giá trị của m là
A. 4,06. B. 1,56. C. 5,04. D. 2,54
Lời giải:
Đáp án: B
mkết tủa = mAl(OH)3 = 0,02. 78 = 1,56 gam
Bài 7: Cho dd (NH4)2SO4 20% vừa đủ vào cốc đựng 800 gam dd Ba(OH)2 8,55% (tº). Phản ứng hoàn toàn, trong cốc có m gam chất lỏng (bỏ qua sự bay hơi của nước). Giá trị của m là:
A. 1050,4 gam B. 693,2 gam C. 970,8 gam D. 957,2 gam
Lời giải:
Đáp án: A
n(NH4)2SO4 = nBa(OH)2 = 800.8,55/100.171 = 0,4 mol; nNH3 = 0,4.2 = 0,8 mol
⇒ mdd = mdd((NH4)2SO4) + mdd(Ba(OH)2) – mNH3 = 132.0,4.100/20 + 800 – 17.0,8 = 1050,4 g
Bài 8: Cho 42,8 gam NH4Cl vào cốc sứ nặng 500 gam, nung cốc đến khối lượng không đổi thấy khối lượng cốc = m gam. Giá trị của m là:
A. 542,8 gam B. 529,2 gam C. 513,6 gam D. Kết quả khác
Lời giải:
Đáp án: B
nNH4Cl = 42,8/53,5 = 0,8 mol ⇒ m = 42,8 + 500 – 0,8.17 = 529,2 gam
Bài 9: Nhiệt phân hoàn toàn 28,8 gam (NH4)2CO3 ở nhiệt độ cao thu được V lit khí (đktc). Giá trị của V là:
A. 13,44 lít B. 6,72 lít C. 20,16 lít D.8,96 lít
Lời giải:
Đáp án: A
n(NH4)2CO3 = 28,8/96 = 0,3 mol ⇒ nNH3 = 0,3.2 = 0,6 mol ⇒ V = 0,6.22,4 = 13,44 lít.
Các dạng bài tập về axit nitric
1. Kim loại tác dụng axit nitric
Lý thuyết và Phương pháp giải
Kim loại tác dụng với dung dịch axit HNO3 giải phóng hỗn hợp nhiều sản phẩm.
Bước 1: Nếu tạo ra hỗn hợp khí, thiết lập biểu thức tính M trung bình của hh từ đó rút ra tỉ lệ số mol (hay tỉ lệ thể tích) giữa các khí sản phẩm.
Bước 2: Viết phương trình cho nhận electron của các chất oxi hóa khử.
Bước 3: Sử dụng bảo toàn electron tìm số mol các chất chưa biết.
Bước 4: Tính toán theo yêu cầu bài toán.
Ví dụ minh họa
Bài 1: Cho m (g) hỗn hợp Fe và Cu tác dụng hết với 100 ml dung dịch HNO3 2,4 M có nung nóng thu được dung dịch A và một khí màu nâu đỏ. Cô cạn dung dịch A thu được 10,48 g hỗn hợp 2 muối khan.
a. Tính m (g)?
b. Cho 2 muối trong dung dịch A tác dụng với 200 ml dung dịch NaOH. Tính nồng độ mol/l của dung dịch NaOH dùng cho phản ứng?
Hướng dẫn:
nHNO3 = 0,1.2,4 = 0,24 mol;
2H+ + NO3- + e → NO2 + H2O
a. nNO3- tạo muối = 0,12 mol
mmuối = m + mNO3- = m + 0,12.62 ⇒ m = 10,48 – 7,44 = 3,04 gam
b. Ta có nN+ = nNO3- tạo muối = 0,12 mol ⇒ CM(NaOH) = 0,12/0,2 = 0,6 M
Bài 2: Hoà tan hoàn toàn m gam Al trong dung dịch HNO3 thì thu được 8,96 lít (đktc) hỗn hợp khí A (gồm NO và N2O) có tỉ khối dA/H2 = 16,75. Tính m?
Hướng dẫn:
Nhh khí = 8,96 /22,4 = 0,4 mol
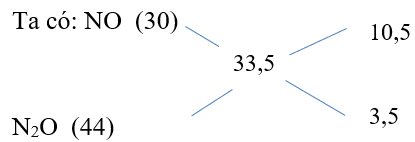
nNO/nN2O = 3/1 ⇒ nNO = 0,3 mol và nN2O = 0,1mol
Các phương trình phản ứng:
Al -3e → Al+3 ; N+5 + 3e → N+2; 2N+5 + 8e → N2+1
nAl = (0,1.8 + 0,3.3)/3 = 17/30 mol
Vậy mAl = 27.17/30 = 15,3 gam
Bài 3: Hòa tan 38,4 gam Cu vào dd HNO3 loãng dư, thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V:
Hướng dẫn:
Sử dụng bảo toàn e: nNO = 38,4/64 . 2/3 = 0,4 mol ⇒ V = 0,4.22,4 = 8,96 lít
Bài 4: Hòa tan hỗn hợp gồm 0,1 mol Al và 0,2 mol Zn bằng 500 ml dd HNO3 vừa đủ, thu được dd A và không thấy khí thoát ra. Cô cạn dd A thu m gam muối.Giá trị của m:
Hướng dẫn:
Sản phẩm khử là NH4NO3 ⇒ nNH4NO3 = (0,1.3 + 0,2.2)/8 = 0,7/8 mol
m = mAl(NO3)3 + mZn(NO3)2 + mNH4NO3 = 0,1.213 + 0,2.189 + (0,7/8).80 = 66,1 gam
Bài 5: Hòa tan hoàn toàn hh X gồm 8,1 gam Al và 29,25 gam Zn bằng dd HNO3 12,6% (vừa đủ) thu được V lit N2O (đktc, khí duy nhất) và dd Y chứa 154,95 gam muối tan. Giá trị của V là:
Hướng dẫn:
mAl(NO3)3 = 8,1.213/27 = 63,9 gam; mZn(NO3)3 = 29,25.189/65 = 85,05 gam
my = mAl(NO3)3 + mZn(NO3)3 + mNH4NO3 ⇒ mNH4NO3 = 6 gam ⇒ nNH4NO3 = 0,075 mol
nN2O = (0,3.3+0,45.2-0,075.8)/8 =0,15 mol ⇒ V = 0,15.22,4 = 3,36 lít
2. Oxit, bazo tác dụng axit nitric
Lý thuyết và Phương pháp giải
- Sử dụng phương pháp quy đổi hỗn hợp các oxit kim loại về nguyên tố đơn giản.
- Sử dụng kết hợp với bảo toàn electron và bảo toan nguyên tố để giải toán
+ Đối với oxit sắt: nếu trong một hỗn hợp nFeO = nFe2O3 thì coi hỗn hợp FeO, Fe2O3 là Fe3O4
+ Nếu một bài toán có nhiều quá trình oxi hóa khử chúng ta chỉ cần để ý đến số oxi hóa của nguyên tố đó trước và sau phản ứng, sau đó dùng định luật bảo toàn e áp dụng chung cho cả bài toán.
Ví dụ minh họa
Bài 1: Nung m gam bột sắt trong oxi, thu được 46,4 gam hỗn hợp chất rắn X. Hoà tan hết hỗn hợp X trong dung dịch HNO3 dư, thoát ra 8,96 lít (đktc) NO (sản phẩm khử duy nhất) và dd Y chứa m1 gam muối nitrat.
a. Tính giá trị của m, m1 ?
b. Số mol của HNO3 đã phản ứng là bao nhiêu?
Hướng dẫn:
Fe + O2 → X + HNO3 → Fe3+ + NO
Trong quá trình phản ứng xảy ra sự trao đổi e của Fe, N, O
a. Bảo toàn e ta có: m/56.3=(46,4-m)/32.4 + 0,4.3 ⇒ m = 39,2 gam
Khối lượng muối thu được: m = mFe(NO3)3 = 0,7.242 = 169,4 gam
b. Số mol HNO3 phản ứng: n = nNO3- tạo muối + nNO = 0,7.3 + 0,4 = 2,5 mol
Bài 2: Nung 2,23 gam hh X gồm (Fe, Cu, Ag) trong oxi một thời gian thu được 2,71 gam hh Y. Hoà tan Y bằng dung dịch HNO3 dư, thu được 0,672 lít khí NO (sp khử duy nhất, ở đktc) và dung dịch A. Cô cạn dung dịch A thu được m gam muối. Tính khối lượng muối tạo thành và mol HNO3 phản ứng?
Hướng dẫn:
Số mol NO3- tạo muối là: nNO3- tạo muối = 3.nNO = 0,03.3 = 0,09 mol
Khối lượng muối tạo thành: m = mX + mNO3- tạo muối = 2,23 + 0,09.62 = 7,81 gam
Số mol oxi tham gia phản ứng: nO2 = (2,71-2,23)/32 = 0,015 mol ⇒ nO = 0,03 mol
Số mol HNO3 đã phản ứng là: n = 4.nNO + 2.nO = 0,18 mol
Bài 3: Nung m bột Cu trong oxi, sau 1 thời gian thu được 29,6 gam hỗn hợp chất rắn X gồm (Cu, CuO, Cu2O). Hòa tan hỗn hợp X trong HNO3 đặc, nóng vừa đủ thu được 6,72 lít khí NO2 (đktc, sản phẩm khử duy nhất) và dd Y. Giá trị của m là:
Hướng dẫn:
Bảo toàn e ta có: m/64.2=(29,6-m)/32.4 + 0,3.1 ⇒ m = 25,6 gam
Bài 4: Cho 30 gam hỗn hợp X gồm: Fe; FeO; Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư được 5,6 lít khí NO (đktc, sp khử duy nhất) và dung dịch Y. Số mol của HNO3 đã phản ứng là:
Hướng dẫn:
Quy đổi 30 gam hỗn hợp X thành Fe và O ⇒ 56x + 16y = 30 (1); 3x – 2y = 0,25.3 (2); Từ 1, 2 ⇒ x = 0,45 và y = 0,3; nHNO3 = 4.nNO + 2nO = 4.0,25 + 2.0,3 = 1,6 mol
Bài 5: Nung 19,89 gam hh X gồm (Al, Zn, Mg) trong oxi một thời gian thu được 23,09 gam hh Y. Hoà tan Y bằng dung dịch HNO3 dư, thu được 1,12 lít khí N2 (sản phẩm khử duy nhất, ở đktc) và dd Z. Cô cạn dd Z thu m gam muối. Giá trị của m là:
Hướng dẫn:
nNO3- tạo muối = 0,05. 10 = 0,5 mol; m = mX + mNO3- = 19,89 + 0,5.62 = 50,89 gam.
3. Nhiệt phân muối nitrat
Lý thuyết và Phương pháp giải
Các muối nitrat đều dễ bị nhiệt phân.
- Nếu muối nitrat của kim loại đứng trước Mg → muối nitrit và O2
- Nếu muối của kim loại trung bình (từ Mg đến Cu) → oxit kim loại + NO2 + O2
- Nếu muối nitrat của kim loại sau Cu → kim loại + NO2 + O2
*Một số phản ứng đặc biệt:
2Fe(NO3)3 → Fe2O3 + 6NO2 + 3/2O2
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
Các lưu ý khi giải bài tập về phản ứng nhiệt phân muối nitrat:
- Khối lượng chất rắn giảm bằng khối lượng khí đã sinh ra.
- Khí sinh ra sau phản ứng thường được dẫn qua nước. Khi đó có phương trình phản ứng:
4NO2 + O2 + 2H2O → 4HNO3
Ví dụ minh họa
Bài 1: Nung nóng 66,2 gam Pb(NO3)2 thu được 55,4 gam chất rắn.
a. Tính hiệu suất của phản ứng phân hủy.
b. Tính thể tích các khí thoát ra (đkc) và tỷ khối của hỗn hợp khí so với không khí.
Hướng dẫn:
Phương trình phản ứng
Pb(NO3)2 → PbO + 2NO2 + 1/2 O2
x 2x 1/2x mol
mNO2 + mO2 = 46.2x + 32.0,5x = 66,2 – 55,4 ⇒ x = 0,1 mol
a. Khối lượng của Pb(NO3)2 phản ứng là: mPb(NO3)2 = 0,1.331 = 33,1 gam
Hiệu suất phản ứng thủy phân là: H = 33,1/66,2.100% = 50%
b. Thể tích khí thoát ra: V = (0,1.2 + 0,1/2).22,4 = 5,6 lít
Mtb = (0,2.46 + 0,05.32)/0,25 = 43,2 gam ⇒ dhh/kk = 43,2/29 = 1,49
Bài 2: Khi nhiệt phân hoàn toàn muối nitrat của kim loại hóa trị 1 thu được 32,4 gam kim loại và 10,08 lít khí (đktc). Xác định công thức và tính khối lượng muối ban đầu.
Hướng dẫn:
Gọi kim loại cần tìm là M ⇒ muối nitrat là: MNO3
MNO3 → M + NO2 + 1/2 O2
x x x x/2
x + x/2 = 1,5x = 10,08/22,4 = 0,45 ⇒ x = 0,3
M = 32,4/0,3 = 108 ⇒ M là Ag
mcr = 67,3 – (0,8.46 + 0,2.32) = 24,1 gam
Bài 3: Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
Hướng dẫn:
nNO2 = 0,03 ⇒ nHNO3 = 0,03 mol ⇒ CM = 0,1 M ⇒ pH = 1
Bài 4: Phân huỷ hoàn toàn 18,8g muối nitrat của một kim loại hoá trị II, thu được 8g oxit của kim loại đó. Vậy kim loại chưa biết là:
Hướng dẫn:
nNO2 = 0,2 ⇒ nM(NO3)2 = 0,1 mol ⇒ MM(NO3)2 = 18,8/0,1 = 188 ⇒ M = 64 là Cu
Bài 5: Đem nung một khối lượng Cu(NO3)2 sau một thời gian dừng lại, làm nguội, rồi cân thấy khối lượng giảm 0,54g. Vậy khối lượng muối Cu(NO3) đã bị nhiệt phân là:
Hướng dẫn:
nNO2 = 0,01 mol ⇒ nCu(NO3)2 = 0,005 mol ⇒ mCu(NO3)2 = 0,94 gam
Bài 6: Nhiệt phân hoàn toàn 4,7 gam muối nitrat của kim loại M thu được 2 gam chất rắn. Công thức của muối là.
Hướng dẫn:
Công thức muối nitrat là M(NO3)n; nNO2 = 0,05 mol ⇒ nM(NO3)n = 0,05/n
⇒ MM(NO3)n = 94n ⇒ M = 32n ⇒ M = 64. CT là Cu(NO3)2.

