Bài tập về Axit Photphoric và Muối Photphat cực hay, có lời giải chi tiết - Hoá học lớp 11
Bài tập về Axit Photphoric và Muối Photphat cực hay, có lời giải chi tiết
Với Bài tập về Axit Photphoric và Muối Photphat cực hay, có lời giải chi tiết Hoá học lớp 11 tổng hợp 25 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Axit Photphoric và Muối Photphat từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Câu 1 . Số oxi hóa của P trong hợp chất H3PO4 là
A. +2.
B. +3.
C. +4.
D. +5.
Lời giải:
Đáp án D
Gọi số oxi hóa của P trong H3PO4 là x
→ (+1).3 + x + (-2).4 = 0 → x = +5.
Câu 2 . Nhận xét nào sau đây là sai?
A. Axit photphoric là chất tinh thể trong suốt, rất háo nước.
B. Axit photphoric tan trong nước theo bất kỳ tỉ lệ nào.
C. Axit photphoric thường dùng là dung dịch đặc, sánh, có nồng độ 85%.
D. Dung dịch axit photphoric 85% có màu nâu đỏ.
Lời giải:
Đáp án D
Dung dịch axit photphoric 85% không màu.
Câu 3 . Trong các nhận xét về axit photphoric sau đây, nhận xét nào là sai?
A. Axit photphoric là axit ba nấc.
B. Trong dung dịch nước, H3PO4 phân li theo từng nấc.
C. Axit photphoric có tính oxi hóa rất mạnh tương tự HNO3.
D. Axit photphoric có độ mạnh trung bình.
Lời giải:
Đáp án C
Khác với axit HNO3, axit H3PO4 không có tính oxi hóa.
Câu 4 . Cho phương trình: H3PO4 ⇌ 3H+ + PO43-. Khi thêm HCl vào thì
A. cân bằng trên sẽ chuyển dịch theo chiều thuận.
B. cân bằng trên sẽ chuyển dịch theo chiều nghịch.
C. cân bằng trên không bị chuyển dịch.
D. nồng độ PO43- tăng lên.
Lời giải:
Đáp án B
Khi thêm HCl tức là thêm H+ vào cân bằng thì cân bằng sẽ chuyển dịch theo chiều làm giảm số mol H+ hay cân bằng chuyển dịch theo chiều nghịch.
Câu 5 . Thuốc thử dùng để nhận biết ion PO43- trong dung dịch muối photphat là
A. quỳ tím.
B. Dung dịch NaOH.
C. Dung dịch AgNO3.
D. Dung dịch NaCl.
Lời giải:
Đáp án C
PO43- + 3Ag+ → Ag3PO4 (↓ vàng)
Câu 6 . Nhỏ vài giọt dung dịch AgNO3 vào dung dịch K3PO4. Hiện tượng thu được là
A. xuất hiện kết tủa màu trắng.
B. xuất hiện kết tủa màu vàng.
C. không hiện tượng.
D. xuất hiện kết tủa màu xanh.
Lời giải:
Đáp án B
3AgNO3 + K3PO4 → 3KNO3 + Ag3PO4 (↓ vàng)

Câu 7 . Trong công nghiệp, để điều chế H3PO4 không cần độ tinh khiết cao, người ta cho H2SO4 đặc tác dụng với
A. Ca3(PO4)2.
B. Na3PO4.
C. K3PO4.
D. Ca(H2PO4)2.
Lời giải:
Đáp án A
Trong công nghiệp để thu H3PO4 không cần độ tinh khiết cao người ta cho H2SO4 đặc tác dụng với quặng apatit hoặc quặng photphorit. Thành phần chính của hai khoáng vật này đều chứa Ca3(PO4)2.
Câu 9 . Trong công nghiệp, để điều chế H3PO4 có độ tinh khiết và nồng độ cao người ta thường
A. cho H2SO4 đặc tác dụng với quặng photphorit hoặc quặng apatit.
B. cho P tác dụng với HNO3 đặc.
C. đốt cháy P thu P2O5 rồi cho P2O5 tác dụng với H2O.
D. nung hỗn hợp Ca3(PO4)2, SiO2, C.
Lời giải:
Đáp án C
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
Câu 10 . Tính chất nào sau đây không thuộc axit photphoric?
A. Axit photphoric là tinh thể, trong suốt, khó nóng chảy.
B. Axit photphoric tan trong nước theo bất kì tỉ lệ nào.
C. Axit photphoric là axit trung bình, phân li theo 3 nấc.
D. Không thể nhận biết H3PO4 bằng dung dịch AgNO3.
Lời giải:
Đáp án A
A sai vì Axit photphoric là tinh thể, trong suốt, nóng chảy ở 42,5°C.
Câu 11 . Trong các muối sau, muối nào tan trong nước?
A. Ca3(PO4)2.
B. CaHPO4.
C. Ca(H2PO4)2.
D. AlPO4.
Lời giải:
Đáp án C
Câu 12 . Dung dịch axit photphoric có chứa các ion nào sau đây? (không kể H+ và OH- của nước)
A. H+, PO43-.
B. H+, H2PO4-, PO43-.
C. H+, HPO42-, PO43- .
D. H+, H2PO4-, HPO42-, PO43-.
Lời giải:
Đáp án C
H3PO4 phân li theo 3 nấc như sau:
Nấc 1: H3PO4 ⇌ H+ + H2PO4-
Nấc 2: H2PO4- ⇌ H+ + HPO42-
Nấc 3: HPO42- ⇌ H+ + PO43-
Do vậy không kể H+ và OH- của nước dung dịch axit photphoric có chứa các ion H+, H2PO4-, HPO42-, PO43-.
Câu 13 . Hòa tan 142 gam P2O5 vào 500 gam dung dịch H3PO4 24,5%. Nồng độ % của H3PO4 trong dung dịch thu được là
A. 49,61%.
B. 56,32%.
C. 48,86%.
D. 68,75%.
Lời giải:
Đáp án A
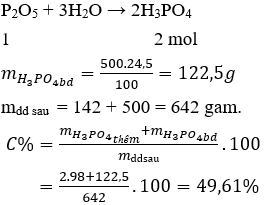
Câu 14 . Cho 14,2 gam P2O5 vào 200 gam dung dịch NaOH 8% thu được dung dịch X. Muối thu được và nồng độ % tương ứng là
A. NaH2PO4 11,2%.
B. Na3PO4 và 7,66%.
C. Na2HPO4 và 13,26%.
D. Na2HPO4 và NaH2PO4 đều 7,66%.
Lời giải:
Đáp án C
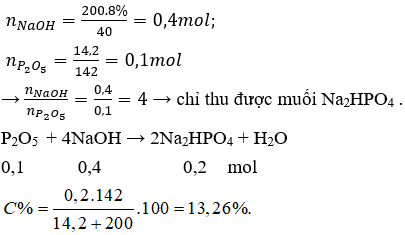
Câu 15 . Cho 150 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M. Sau phản ứng, trong dung dịch chứa các muối
A. KH2PO4 và K2HPO4.
B. KH2PO4 và K3PO4.
C. K2HPO4 và K3PO4.
D. KH2PO4, K2HPO4 và K3PO4.
Lời giải:
Đáp án A
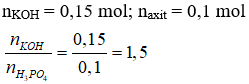
→ tạo hai muối KH2PO4 và K2HPO4.
Câu 16 . Cho 44 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn, đem cô cạn dung dịch. Khối lượng từng muối khan thu được là
A. 50 gam Na3PO4.
B. 49,2 gam NaH2PO4 và 14,2 gam Na3PO4.
C. 15 gam NaH2PO4.
D. 14,2 gam Na2HPO4 và 49,2 gam Na3PO4.
Lời giải:
Đáp án D
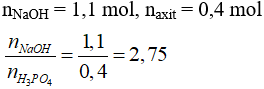
→ tạo hai muối Na2HPO4 (x mol) và Na3PO4 (y mol).
Bảo toàn Na có: 2x + 3y = 1,1
Bảo toàn P có: x + y = 0,4
→ x = 0,1 và y = 0,3.
Vậy muối Na2HPO4 có khối lượng = 0,1.142 = 14,2 gam.
muối Na3PO4 có khối lượng = 0,3.164 = 49,2 gam.

Câu 17 . Cho 14,2 gam P2O5 vào 100 ml dung dịch chứa NaOH 1M và KOH 2M, thu được dung dịch X. Các anion có mặt trong dung dịch X là
A. PO43- và OH-.
B. H2PO4- và HPO42-.
C. HPO42- và PO43-.
D. H2PO4- và PO43-.
Lời giải:
Đáp án B
nOH- = 0,1.1 + 0,1.2 = 0,3 mol; nP2O5 = 0,1 mol
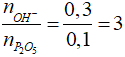
Câu 18 . Cho 3,92 gam H3PO4 vào dung dịch chứa 4,4 gam NaOH. Số mol muối tạo thành là
A. 0,01 và 0,03.
B. 0,02 và 0,03.
C. 0,01 và 0,02.
D. đáp án khác.
Lời giải:
Đáp án A
nNaOH = 0,11 mol, naxit = 0,04 mol
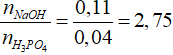
Bảo toàn Na có: 2x + 3y = 0,11
Bảo toàn P có: x + y = 0,04
→ x = 0,01 và y = 0,03.
Câu 19 . Phản ứng nào sau đây được sử dụng để điều chế H3PO4 trong phòng thí nghiệm?
A. P + HNO3 đặc, nóng.
B. Ca3(PO4)2 + H2SO4 đặc.
C. P2O5 + H2O.
D. HPO3 + H2O.
Lời giải:
Đáp án A
Trong phòng thí nghiệm H3PO4 được điều chế bằng cách dùng HNO3 đặc oxi hóa P theo PTHH sau:
P + 5HNO3 đặc → H3PO4 + 5NO2 + H2O.

Câu 20 . Khi đun nóng từ từ H3PO4 bị mất nước theo sơ đồ
H3PO4 → X → Y → Z. Các chất X, Y, Z lần lượt là
A. H2PO4, HPO3, H4P2O7.
B. HPO3, H4P2O7, P2O5.
C. H4P2O7, P2O5, HPO3.
D. H4P2O7, HPO3, P2O5.
Lời giải:
Đáp án D.
Câu 21 . Cho dung dịch chứa a mol H2SO4 vào dung dịch chứa 2,5a mol Na3PO4 thu được dung dịch X. Các chất tan có trong dung dịch X là
A. Na3PO4, Na2HPO4 và Na2SO4.
B. H3PO4, H2SO4 và Na2SO4.
C. Na2HPO4, H3PO4 và Na2SO4.
D. Na2HPO4 và Na2SO4.
Lời giải:
Đáp án A
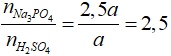
PTHH: 2Na3PO4 + H2SO4 → Na2SO4 + 2Na2HPO4.
→ Chất tan trong X gồm Na3PO4 dư, Na2HPO4, Na2SO4.
Câu 22 . Lấy 124 gam P đem điều chế H3PO4 với hiệu suất phản ứng đạt 100%. Thể tích dung dịch H3PO4 35% (D = 1,25 gam/ml) có thể thu được là
A. 1220ml.
B. 936ml.
C. 1000ml.
D. 896ml.
Lời giải:
Đáp án D
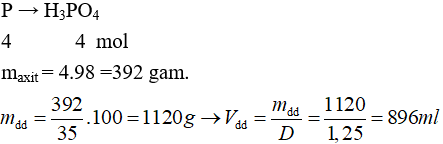
Câu 23 . Thủy phân hoàn toàn 5,42 gam PX3 trong nước thu được dung dịch A. Trung hòa dung dịch A cần dùng 100 ml dung dịch NaOH 1M. Biết rằng H3PO3 là một axit 2 nấc. Công thức của PX3 là
A. PBr3.
B. PI3.
C. PF3.
D. PCl3.
Lời giải:
Đáp án A
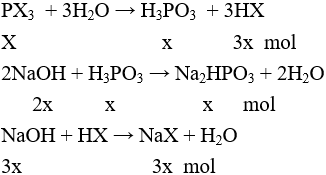
nNaOH = 5x = 0,1 ⇒ x = 0,02 mol
PX3 = 5,42 : 0,02 = 271 ⇒ X = 80 ⇒ Br ⇒ PBr3

Câu 24 . Hòa tan hoàn toàn 3,1 gam P trong 100 gam dung dịch HNO3 63% (đặc nóng) thu được dung dịch X và V lít (đktc) khí NO2 duy nhất. Giá trị của V là
A. 11,2.
B. 5,6.
C. 10,08.
D. 8,96.
Lời giải:
Đáp án A
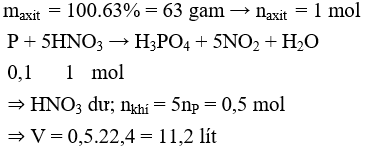
Câu 25 . Cho 4 dung dịch sau: Na3PO4, Na2HPO4, NaH2PO4 và H3PO4 có cùng nồng độ mol, có các giá trị pH lần lượt là : pH1, pH2, pH3 và pH4. Sự sắp xếp nào sau đây đúng với sự tăng dần pH?
A. pH1 < pH2 < pH3 < pH4.
B. pH4 < pH3 < pH2 < pH1.
C. pH3 < pH4 < pH1 < pH2.
D. pH2 < pH1 < pH4 < pH3.
Lời giải:
Đáp án B
Tính axit càng mạnh pH càng nhỏ, trong 4 chất H3PO4 có tính axit mạnh nhất → pH4 nhỏ nhất.

