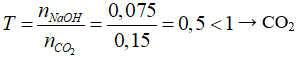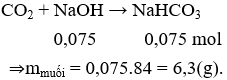Bài tập về Axit Cacbonic và Muối cacbonat cực hay, có lời giải chi tiết - Hoá học lớp 11
Bài tập về Axit Cacbonic và Muối cacbonat cực hay, có lời giải chi tiết
Với Bài tập về Axit Cacbonic và Muối cacbonat cực hay, có lời giải chi tiết Hoá học lớp 11 tổng hợp 25 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Axit Cacbonic và Muối cacbonat từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Câu 1 . Nhận xét nào sau đây không đúng về axit cacbonic?
A. Là axit kém bền, chỉ tồn tại trong dung dịch loãng.
B. Dễ bị phân hủy thành CO2 và H2O.
C. Là axit hai nấc.
D. Là chất điện li mạnh.
Lời giải:
Đáp án D
Axit cacbonic là chất điện li yếu. Trong dung dịch phân li hai nấc:
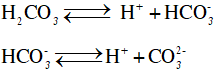
Câu 2 . Nhận xét nào sau đây không đúng về muối cacbonat?
A. Là muối của axit cacbonic.
B. Muối cacbonat của các kim loại kiềm đều tan.
C. Đa số muối hiđrocacbonat đều tan.
D. Muối cacbonat đều bền với nhiệt.
Lời giải:
Đáp án D
Chỉ có muối cacbonat trung hòa của kim loại kiềm bền với nhiệt.
Câu 3 . Chất nào sau đây được dùng làm thuốc chữa đau dạ dày do thừa axit?
A. CaCO3.
B. Na2CO3.
C. NaHCO3.
D. NH4HCO3.
Lời giải:
Đáp án C
NaHCO3 được dùng làm thuốc chữa đau dạ dày do thừa axit.
Câu 4 . Phản ứng nào sau đây là đúng?
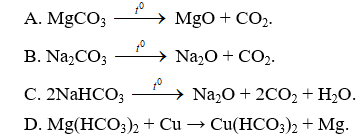
Lời giải:
Đáp án A
B sai vì muối cacbonat của kim loại kiềm không bị nhiệt phân hủy.
C sai vì 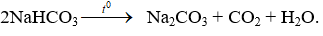
D sai vì Cu đứng sau Mg trong dãy hoạt động hóa học của kim loại nên không đẩy được Mg ra khỏi muối.
Câu 5 . Chất nào sau đây vừa tác dụng được với NaOH, vừa tác dụng được với HCl?
A. Na2CO3.
B. NH4Cl.
C. NaHCO3.
D. Mg.
Lời giải:
Đáp án C
NaHCO3 + NaOH → Na2CO3 + H2O
NaHCO3 + HCl → NaCl + CO2↑+ H2O
Câu 6 . Thể tích khí ở đktc thoát ra khi cho 10,6g Na2CO3 phản ứng hoàn toàn với lượng dư HCl là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Lời giải:
Đáp án B
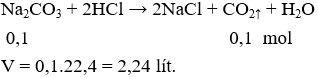
Câu 7 . Nhỏ từ từ một vài giọt Na2CO3 vào ống nghiệm có chứa 1ml Ba(OH)2 thu được kết tủa có màu
A. trắng.
B. đen.
C. vàng.
D. nâu đỏ.
Lời giải:
Đáp án A
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3(↓)
BaCO3(↓) trắng

Câu 8 . Cho 0,56g KOH hòa tan vào nước được dung dịch X. Lượng dung dịch X trên phản ứng vừa đủ với dung dịch NaHCO3. Khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 1,58 gam.
B. 1,22 gam.
C. 0,78 gam.
D. 1,26 gam.
Lời giải:
Đáp án B
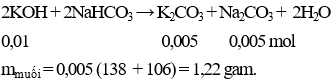
Câu 9 . Cho 0,84 gam NaHCO3 phản ứng với một lượng nước vôi trong dư. Khối lượng kết tủa thu được là
A. 1,58 gam.
B. 0,5 gam.
C. 0,78 gam.
D. 1,00 gam.
Lời giải:
Đáp án B
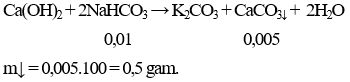
Câu 10 . Nhóm nào sau đây gồm các muối không bị nhiệt phân ?
A. CaCO3, Na2CO3, KHCO3.
B. Na2CO3, K2CO3, Li2CO3.
C. Ca(HCO3)2, Mg(HCO3)2, KHCO3.
D. K2CO3, KHCO3, Li2CO3.
Lời giải:
Đáp án B
Muối cacbonat trung hòa của kim loại kiềm (Li, Na, K …) không bị nhiệt phân.
Câu 11 . Có hỗn hợp A gồm 3 muối NH4HCO3, NaHCO3 và Ca(HCO3)2. Khi nung 48,8 gam hỗn hợp đó đến khối lượng không đổi thu được 16,2 chất rắn X. Cho X tác dụng với dung dịch axit HCl thu được 2,24 lít (đktc) khí. Khối lượng của NH4HCO3, NaHCO3 và Ca(HCO3)2 lần lượt là
A. 8,69g, 16,2g và 10,64g.
B. 10,64g, 16,2g và 8,69g.
C. 6,89g, 10,64g và 31,27g.
D. 8,69g, 10,64g và 16,2g.
Lời giải:
Đáp án A
Gọi số mol của NH4HCO3, NaHCO3 và Ca(HCO3)2 lần lượt là x, y, z mol
Ta có : 79x + 84y + 162z = 48,8 (1)
PTHH:
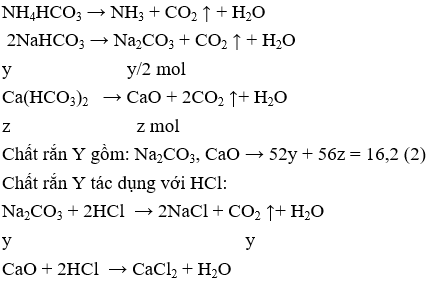
Ta có : y = 0,1 mol (3)
Từ (1),( 2), (3) ta có : x = 0,11; y = 0,1 và z = 0,19
→ mNH4HCO3 = 0,11.79 = 8,69 gam;
mNaHCO3 = 0,1.162 = 16,2 gam;
mCaO = 0,19.56 = 10,64 gam

Câu 12 . Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
A. 0,112.
B. 1,12.
C. 2,24.
D. 0,224.
Lời giải:
Đáp án A
nHCl = 0,2.1 = 0,2 mol; nNa2CO3 = 1,5.0,1 = 0,15 mol; nKHCO3 = 1.0,1 = 0,1 mol
Phương trình hóa học:
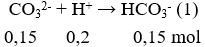
Sau phản ứng (1) nHCl = 0,2 – 0,15 = 0,05 mol; nHCO3- = 0,1 + 0,15 = 0,25 mol.
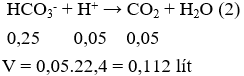
Câu 13 . Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,02.
B. 0,03.
C. 0,015.
D. 0,01.
Lời giải:
Đáp án D
nHCl = 0,03.1 = 0,03 mol; nNa2CO3 = 0,2.0,1 = 0,02 mol; nNaHCO3 = 0,2.0,1 = 0,02 mol
Phản ứng xảy ra theo thứ tự sau:
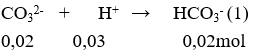
Sau phản ứng (1) nHCl = 0,03 – 0,02 = 0,01 mol; nHCO3- = 0,02 + 0,02 = 0,04 mol.
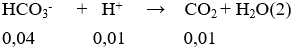
Vậy số mol CO2 là 0,01 mol.
Câu 14 . Cho dung dịch Ca(HCO3)2 lần lượt vào các dung dịch: CaCl2; Ca(NO3)2; NaOH; Na2CO3. Số trường hợp có kết tủa là
A. 4.
B. 3.
C. 2.
D. 1.
Lời giải:
Đáp án C
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
Ca(HCO3)2 + Na2CO3 → BaCO3↓ + 2NaHCO3
Câu 15 . Cho 15g hỗn hợp 3 muối gồm Na2CO3, K2CO3, MgCO3 tác dụng hết với dd H2SO4 dư thu được 2,8 lít CO2 (đktc) và dd X. Khối lượng muối trong dd X là
A. 21,00gam.
B. 19,50 gam.
C.17,25gam.
D. 24,00gam.
Lời giải:
Đáp án B
nkhí = 2,8 : 22,4 = 0,125 mol ; đặt muối ban đầu có dạng MnCO3
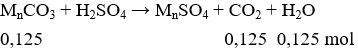
Áp dụng tăng giảm khối lượng ta có:
Cứ 1 mol muối MnCO3 tạo thành 1 mol MnSO4 khối lượng tăng 96 – 60 = 36g.
→ Cứ 0,125 mol muối MnCO3 tạo thành 0,125 mol MnSO4 khối lượng tăng 36.0,125 = 4,5 gam.
→ mx = 15 + 4,5 = 19,5 gam.
Câu 16 . Một loại đá vôi chứa 80% CaCO3 còn lại là tạp chất trơ. Nung m gam đá này một thời gian thu được 0,78m gam chất rắn. Hiệu suất phân hủy CaCO3 là
A. 72,5%.
B. 50%.
C. 62,5%.
D. 97,5%.
Lời giải:
Đáp án C
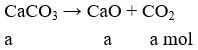
Khối lượng CaCO3 trong đá vôi: 80%.m = 0,8m.
Áp dụng định luật bảo toàn khối lượng có:
mcr trước = mcr sau + mCO2
→ m = 0,78m + 44a → a = 0,005m
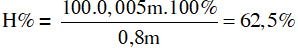
Câu 17 . Dãy gồm các chất vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH là
A. NaHCO3, MgO, Ca(HCO3)2.
B. NaHCO3, ZnO, Mg(OH)2.
C. KHCO3, Ca(HCO3)2, Al2O3.
D. Mg(OH)2, Al2O3, Ca(HCO3)2.
Lời giải:
Đáp án C
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
2KHCO3 + 2NaOH → Na2CO3 + K2CO3 +2H2O
KHCO3 + HCl → KCl + CO2↑ + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O

Câu 18 . Cho sơ đồ phản ứng: NaCl → (X) → NaHCO3 → (Y) → NaNO3. X và Y có thể là các chất nào sau đây?
A. NaOH và NaClO.
B. Na2CO3 và NaClO.
C. NaClO3 và Na2CO3.
D. NaOH và Na2CO3.
Lời giải:
Đáp án D
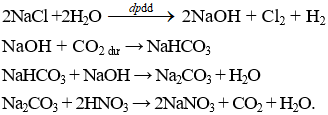
Câu 19 . Cho m gam NaOH vào 2 lít dung dịch NaHCO3 nồng độ a mol/l, thu được 2 lít dung dịch X. Lấy 1 lít dung dịch X tác dụng với dung dịch BaCl2 (dư) thu được 11,82 gam kết tủa. Mặt khác, cho 1 lít dung dịch X vào dung dịch CaCl2 (dư) rồi đun nóng, sau khi kết thúc các phản ứng thu được 7,0 gam kết tủa. Giá trị của a, m tương ứng là
A. 0,08 và 4,8.
B. 0,04 và 4,8.
C. 0,14 và 2,4.
D. 0,07 và 3,2.
Lời giải:
Đáp án A.
+) Trường hợp 1: 1 lít dung dịch X tác dụng với BaCl2
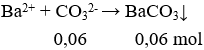
+) Trường hợp 2: 1 lít dung dịch X tác dụng với CaCl2
n↓ = 0,07 > n (CO32-) → trong dung dịch X còn HCO3-
2HCO3- → CO32- + CO2 + H2O
Số mol HCO3- dư trong 1 lít dung dịch = 2 (0,07 – 0,06) = 0,02 mol.
Số mol NaOH phản ứng với 1 lít dung dịch NaHCO3 = số mol CO32- = 0,06 mol
→ m = 2.0,06.40 = 4,8 gam.
Số mol HCO3- trong 1 lít dung dịch = 0,06 + 0,02 = 0,08 mol
→ a = 0,08 : 1 = 0,08 M.
Câu 20 . Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được V lít khí (ở đktc) và dung dịch X. Khi cho dư nước vôi trong vào dung dịch X thấy có xuất hiện kết tủa. Biểu thức liên hệ giữa V với a, b là
A. V = 22,4(a - b).
B. V = 11,2(a - b).
C. V = 11,2(a + b).
D. V = 22,4(a + b).
Lời giải:
Đáp án A
Khi cho dư nước vôi trong vào dung dịch X thấy có xuất hiện kết tủa (CaCO3)
X có chứa NaHCO3.
Từ đó ta có các phản ứng:
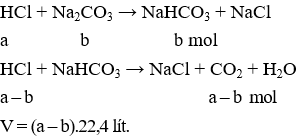
Câu 21 . Cho 9,125 gam muối hiđrocacbonat của kim loại hóa trị II, phản ứng hết với dung dịch H2SO4 (dư), thu được dung dịch chứa 7,5 gam muối sunfat trung hoà. Công thức của muối hiđrocacbonat là
A. NaHCO3.
B. Ca(HCO3)2.
C. Ba(HCO3)2.
D. Mg(HCO3)2.
Lời giải:
Đáp án D
Đặt công thức muối hiđrocacbonat là R(HCO3)2
R(HCO3)2 + H2SO4 → RSO4 + 2CO2+ 2H2O
Theo PT ta thấy:
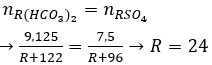
→ R là Mg→ Muối Mg(HCO3)2.

Câu 22 . Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 19,7.
B. 39,4.
C. 17,1.
D. 15,5.
Lời giải:
Đáp án A
Số mol Ba(OH)2 = 0,2 mol.
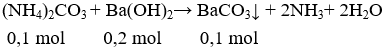
mBaCO3 = 0,1.197 = 19,7 gam
Câu 23 . Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư), thu được 11,82 gam kết tủa. Giá trị của x là
A. 1,6.
B. 1,2.
C. 1,0.
D. 1,4.
Lời giải:
Đáp án D
nCO2 = 0,1 mol; nK2CO3 = 0,02 mol; nKOH = 0,1x mol; nBaCO3 = 0,06 mol.
Ta thấy: nCO2 + nK2CO3 = 0,1 + 0,02 > nBaCO3 = 0,06 mol → Xảy ra 2 PT:
CO2 + OH- → HCO3- (1)
CO2 + 2OH- → CO32- + H2O (2)
Bảo toàn nguyên tố C: nCO2 + nK2CO3 = nHCO3- + nBaCO3
→ nHCO3- = 0,1 + 0,02 – 0,06 = 0,06 mol
→ ∑nOH- (1) +(2) = nHCO3- + 2 (nBaCO3 - nK2CO3) = 0,06 + 2. (0,06 – 0,02) = 0,14 mol
→ CM = n : V = 0,14 : 0,1 = 1,4 M
Câu 24 . Nhiệt phân hoàn toàn 40 gam một loại quặng đôlômit có lẫn tạp chất trơ sinh ra 8,96 lít khí CO2 (ở đktc). Thành phần phần trăm về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là
A. 40%.
B. 50%.
C. 84%.
D. 92%.
Lời giải:
Đáp án D
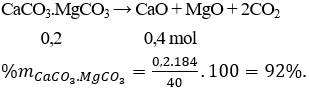
Câu 25 . Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị II, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M, khối lượng muối khan thu được sau phản ứng là
A. 5,8 gam.
B. 6,5 gam.
C. 4,2 gam.
D. 6,3 gam.
Lời giải:
Đáp án D
Gọi công thức chung của hai muối cacbonat kim loại hóa trị II là RCO3
RCO3 → RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có:
mCO2 = mRCO3 - mRO = 13,4 - 6,8 = 6,6 (g)
⇒ nCO2 = 0,15 mol
Ta có: nNaOH = 0,075 mol