Tổng hợp Lý thuyết chương Hidrocacbon thơm - Hoá học lớp 11
Tổng hợp Lý thuyết chương Hidrocacbon thơm
Tài liệu Tổng hợp Lý thuyết chương Hidrocacbon thơm Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về chương Hidrocacbon thơm từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

- Lý thuyết Tính chất của Benzen và đồng đẳng Xem chi tiết
- Lý thuyết Tính chất của Stiren, Naphtalen Xem chi tiết
- Lý thuyết Nguồn hidrocacbon thiên nhiên Xem chi tiết
- Lý thuyết so sánh tính chất của hiđrocacbon thơm với hiđrocacbon no và không no Xem chi tiết
Lý thuyết Tính chất của Benzen và đồng đẳng
I. Cấu tạo, đồng đẳng, đồng phân và danh pháp
1. Đồng đẳng, cấu tạo
- Công thức chung: CnH2n-6 (n ≥ 6).
- Tên gọi chung là aren.
- Công thức đơn giản nhất là benzen (C6H6).
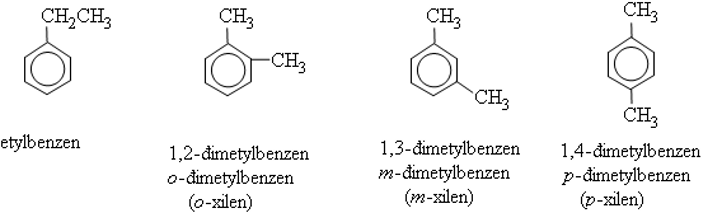
- Các ankyl benzen thương gặp là toluen C6H5CH3, xilen C6H4(CH3)2, cumen C6H5CH(CH3)2, …
- Công thức cấu tạo: Phân tử benzen gồm 6 nguyên tử H và 6 nguyên tử C nằm trong cùng một mặt phẳng trong đó 6 nguyên tử C tạo thành hình lục giác đều, mỗi nguyên tử C lại liên kết với một nguyên tử H nữa. Độ dài các liên kết C-C bằng nhau, độ dài các liên kết C-H cũng như nhau.
- Vì vậy công thức cấu tạo của benzen được biểu diễn dưới các dạng sau:
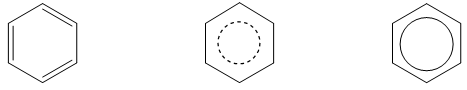
* Gốc hiđrocacbon thơm:
+ Khi tách 1H khỏi phân tử benzen, được 1 gốc phenyl (C6H5-)
+ Khi tách 1H khỏi nguyên tử cacbon trên nhân benzen của 1 phân tử hiđrocacbon thơm, ta được gốc aryl.
+ Nếu tách 2H thì được gốc phenylen và arylen.
2. Đồng phân, danh pháp
a. Đồng phân
Vì các liên kết C-C trong nhân benzen đồng nhất nên benzen chỉ có 3 đồng phân vị trí:
+ Nếu 2 nhóm thế ở 2 C lân cận ta có đồng phân ortho (viết tắt o-) hoặc đánh số 1,2.
+ Nếu 2 nhóm thế cách nhau 1 nguyên tử cacbon (1 đỉnh tam giác) gọi là đồng phân meta (viết tắt m-) hoặc 1,3.
+ Nếu 2 nhóm thế ở 2 nguyên tử cacbon đối đỉnh gọi là đồng phân para (viết tắt p-) hoặc 1,4.
Ví dụ: Các đồng phân của diclobenzen (C6H4Cl2).
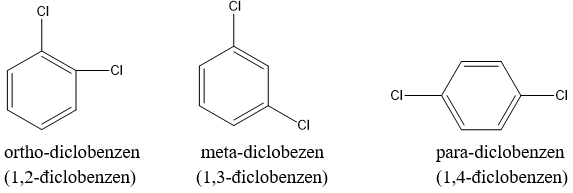
b. Danh pháp
- Khi coi vòng benzen là mạch chính thì các nhóm ankyl đính với nó là mạch nhánh (còn gọi là nhóm thế).
- Ankylbenzen có đồng phân mạch cacbon. Để gọi tên chúng, phải chỉ rõ vị trí các nguyên tử C của vòng bằng các chữ số hoặc các chữ cái o, m, p (đọc là ortho, meta, para). Cụ thể như sau:
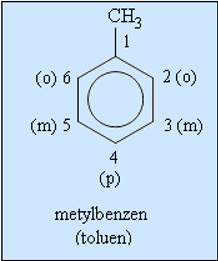
Ví dụ:
II. Tính chất vật lý
- Bezen là chất lỏng, không màu, có mùi thơm đặc trưng nhẹ hơn nước và không tan trong nước nhưng tan nhiều trong dung môi hữu cơ như rượu, ete, xeton.
III. Tính chất hóa học
1. Phản ứng thế
C6H6 + Br2 → C6H5Br + HBr (Fe, tº)
C6H6 + HNO3 → C6H5NO2 + H2O (H2SO4 đặc, tº)
- Do ảnh hưởng của nhân thơm đối với mạch nhánh, nên khi chiếu sáng toluene tham ra phản ứng thế nguyên tử hidro ở nhóm CH3.
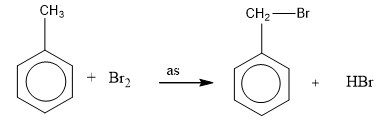
- Toluen tham gia phản ứng brom ở vòng dễ dàng hơn và tạo thành hỗn hợp hai đồng phân khi có xúc tác bột sắt:
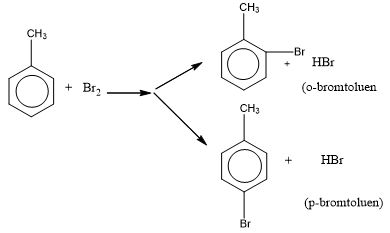
- Quy tắc thế vào vòng benzen:
+ Nếu vòng benzen đã có sẵn nhóm thế loại I (-OH, ankyl, -NH2, …) thì phản ứng thế xảy ra dễ hơn so với benzen và ưu tiên thế vào vị trí o- và p-.
+ Nếu vòng benzen đã có sẵn nhóm thế loại II (-COOH, -CHO, -CH=CH2) thì phản ứng thế xảy ra khó hơn so với benzen và ưu tiên thế vào vị trí m-.
2. Phản ứng cộng
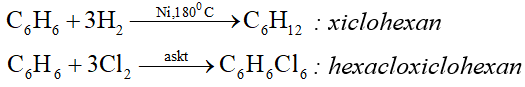
3. Phản ứng oxi hóa
- Benzen không làm mất màu dung dịch KMnO4.
- Các ankyl benzen khi đun nóng với KMnO4 thì chỉ có nhóm ankyl bị oxi hóa.
C6H5-CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O
- Oxi hóa hoàn toàn:
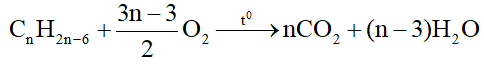
4. Phản ứng với H2SO4 đặc:
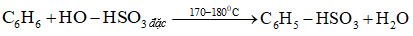
5. Phản ứng với dẫn xuất halogen:
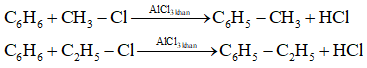
6. Phản ứng với nitro hóa
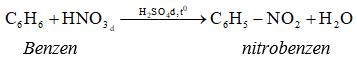
IV. Ứng dụng và điều chế
1. Ứng dụng
- Tổng hợp các monome trong sản xuất polime làm chất dẻo, cao su, tơ sợi (chẳng hạn polistiren, cao su buna-stiren, tơ capron).
- Từ benzen người ta điều chế ra nitrobenzen, anilin, phenol dùng để tổng hợp phẩm nhuộm, dược phẩm, thuốc trừ dịch hại, ...
- Toluen được dùng để sản xuất thuốc nổ TNT (trinitrotoluen).
- Benzen, toluen và các xilen còn được dùng nhiều làm dung môi.
2. Điều chế
- Benzen được điều chế từ axetilen:
3C2H2 → C6H6 (C, 600ºC)
- Tách H2 từ xiclohexan:
C6H12 → C6H6 + 3H2 (tº, xt)
- Etylbenzen được điều chế từ benzen và etilen:
C6H6 + CH2=CH2 → C6H5CH2CH3 (tº, xt)
Lý thuyết Tính chất của Stiren, Naphtalen
I. Stiren
1. Cấu tạo
- Công thức phân tử C8H8.
- Công thức cấu tạo: C6H5-CH=CH2.
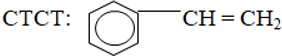
2. Tính chất vật lý
- Stiren là chất lỏng không màu, nhẹ hơn nước và không tan trong nước.
3. Tính chất hóa học
Phân tử stiren được cấu tạo từ 2 phần: vòng benzen và nhánh vinyl (nhóm thế loại II) → tính chất hóa học của stiren được biểu hiện cả ở vòng benzen và nhánh.
a. Phản ứng cộng
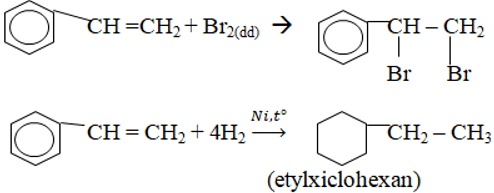
b. Phản ứng trùng hợp và đồng trùng hợp
- Phản ứng trùng hợp
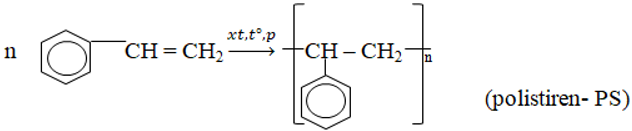
- Phản ứng đồng trùng hợp
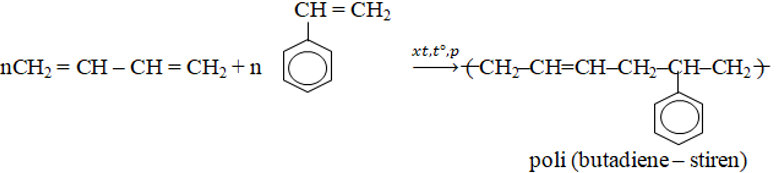
c. Phản ứng oxi hóa không hoàn toàn
- Stiren làm mất màu dung dịch thuốc tím ở nhiệt độ thường:
3C6H5CH=CH2 + 2KMnO4 + 4H2O → 3C6H5-CHOH-CH2OH + 2KOH + 2MnO2
- Stiren làm mất màu dung dịch thuốc tím ở nhiệt độ cao:
3C6H5-CH=CH2 + 10KMnO4 → 3C6H5COOK + 3K2CO3 + KOH + 10MnO2 + 4H2O
4. Nhận biết
- Làm mất màu dung dịch Brom.
- Làm mất màu dung dịch thuốc tím ở nhiệt độ thường.
5. Ứng dụng
- Để sản xuất polime.
- Polistiren là chất dẻo trong suốt, để chế tạo các dụng cụ văn phòng, đồ gia đình.
- Poli butađien-stiren dùng để sản xuất cao su buna – S.
II. Naphtalen
1. Cấu tạo
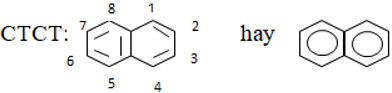
2. Tính chất vật lý
- Là chất rắn màu trắng, tnc: 80oC , ts: 218oC. Thăng hoa ngay ở nhiệt độ thường.
- Có mùi đặc trưng (mùi băng phiến).
- Không tan trong nước, tan trong dung môi hữu cơ.
3. Tính chất hóa học
a. Phản ứng thế
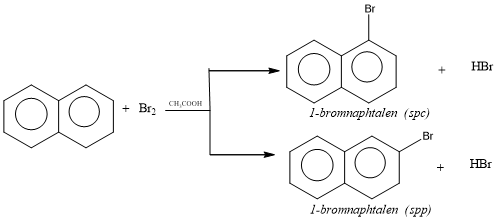
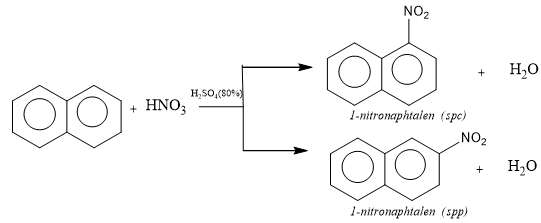
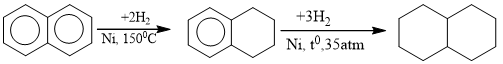
b. Phản ứng cộng hidro (hidro hóa)
c. Phản ứng oxi hóa
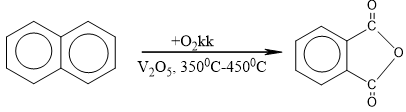
4. Ứng dụng
- Naphtalen là nguyên liệu cho sản xuất phẩm nhuộm, dược phẩm, ...
- Naphtalen còn dùng làm chất chống gián (băng phiến).

