Các dạng bài tập Sự điện li chọn lọc, có đáp án chi tiết - Hoá học lớp 11
Các dạng bài tập Sự điện li chọn lọc, có đáp án chi tiết
Với Các dạng bài tập Sự điện li chọn lọc, có đáp án chi tiết Hoá học lớp 11 tổng hợp các dạng bài tập, trên 300 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Sự điện li từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Tổng hợp Lý thuyết chương Sự điện li
- Lý thuyết Sự điện li Xem chi tiết
- Lý thuyết Axit, bazo, muối Xem chi tiết
- Lý thuyết Sự điện li của nước. pH. Chất chỉ thị axit-bazơ Xem chi tiết
- Lý thuyết Phản ứng trao đổi ion trong dung dịch chất điện li Xem chi tiết
- Lý thuyết về Axit, bazơ và muối Xem chi tiết
- Lý thuyết Phân loại các chất điện li Xem chi tiết
Phương pháp giải các dạng bài tập chương Sự điện li
- Dạng 1: Bài tập lý thuyết về sự điện li, chất điện li, viết phương trình điện li Xem chi tiết
- Dạng 2: Phương pháp bảo toàn điện tích trong giải bài tập sự điện li Xem chi tiết
- Dạng 3: Phương pháp tính pH Xem chi tiết
- Dạng 4: Các dạng bài tập về sự điện li Xem chi tiết
- Dạng 5: Dạng bài tập Phản ứng trao đổi ion trong dung dịch Xem chi tiết
- Dạng 6: Phản ứng thủy phân muối Xem chi tiết
Bài tập trắc nghiệm
- 100 câu trắc nghiệm Sự điện li có lời giải chi tiết (cơ bản) Xem chi tiết
- 100 câu trắc nghiệm Sự điện li có lời giải chi tiết (nâng cao) Xem chi tiết
Bài tập lý thuyết về sự điện li, chất điện li, viết phương trình điện li
A. Ví dụ minh họa
Bài 1: Cho các chất sau: NaCl; HF; CuSO4; NaOH; Mg(NO3)2; H3PO4; (NH4)3PO4; H2CO3; ancol etylic; CH3COOH; AgNO3; Glucozơ; glyxerol; Al(OH)3; Fe(OH)2; HNO3.
Xác định chất điện ly mạnh, chất điện ly yếu, chất không điện ly? Viết phương trình điện ly của các chất (nếu có).
Hướng dẫn:
- Chất điện ly mạnh: NaCl; CuSO4; NaOH; Mg(NO3)2; (NH4)3PO4; AgNO3; HNO3.
Phương trình điện ly:
NaCl → Na+ + Cl- CuSO4 → Cu2+ + SO42-
NaOH → Na+ + OH- Mg(NO3)2 → Mg2+ + 2NO3-
(NH4)3PO4 → 3NH4+ + PO43- AgNO3 → Ag+ + NO3-
HNO3 → H+ + NO3-
- Chất điện ly yếu: HF; H3PO4; H2CO3; CH3COOH; Al(OH)3; Fe(OH)2.
Phương trình điện ly:
HF ⇔ H+ + F- CH3COOH ⇔ CH3COO- + H+
H3PO4 ⇔ H+ + H2PO4- Al(OH)3 ⇔ Al3+ + 3OH-
H2PO4- ⇔ H+ + HPO42- H2CO3 ⇔ H+ + HCO3-
HPO42- ⇔ H+ + PO43- HCO3- ⇔ H+ + CO32-
Fe(OH)2 ⇔ Fe2+ + OH-
- Chất không điện ly: Glucozơ; glyxerol; ancol etylic.
Bài 2: Pha loãng dần dần một dung dịch axit sunfuric, người ta thấy độ dẫn điện của dung dịch lúc đầu tăng dần sau đó lại giảm dần. Hãy giải thích hiện tượng.
Hướng dẫn:
Axit sunfuric phân li như sau :
H2SO4 → H+ + HSO4- : điện li hoàn toàn.
HSO4- ⇔ H+ + SO42- : K = 10-2
Lúc đầu khi pha loãng dung dịch, độ điện li tăng lên làm tăng nồng độ ion. Do đó độ dẫn điện tăng. Trong dung dịch rất loãng, sự điện li coi như hoàn toàn, lúc đó nếu tiếp tục pha loãng thì nồng độ ion giảm làm cho độ dẫn điện giảm.
Bài 3: Theo thuyết axit-bazơ của Bronsted, các chất sau giữ vai trò là axit – bazơ - lưỡng tính - trung tính: HSO4-, H2PO4-, PO43-, NH3, S2-, Na+ , Al3+, Cl- , CO32- , NH4+, HS-
Hướng dẫn:
-Axit: NH4+, HSO4-, Al3+
NH4+ + H2O ⇔ NH3 + H3O-
HSO4- + H2O ⇔ SO42- + H3O-
Al3+ + H2O ⇔ [Al(OH)]2+ + H+
-Bazơ: PO43-, NH3, S2-, CO32-
PO43- + H2O ⇔ HPO4- + OH-
NH3 + H2O ⇔ NH4+ + OH-
S2- + H2O ⇔ HS- + OH-
CO32- + H2O ⇔ HCO3- + OH-
-Lưỡng tính: H2PO4-, HS-
H2PO4- + H2O ⇔ H3PO4 + OH-
H2PO4- + H2O ⇔ HPO42- + H3O+
HS- + H2O ⇔ H2S + OH-
HS- + H2O ⇔ S2- + H3O+
-Trung tính: Na+, Cl-
Bài 4: Từ quan điểm axit-bazơ của Bronsted, hãy cho biết tính axit, bazơ, trung tính hay lưỡng tính của các dung dịch sau: NaCl, Na2S, NaHCO3, Cu(NO3)2. NH4Cl, CH3COOK, Ba(NO3)2, Na2CO3.
Hướng dẫn:
- Dung dịch có tính axit: Cu(NO3)2, NH4Cl.
Cu(NO3)2 → Cu2+ + 2NO3-
Cu2+ + H2O ⇔ [Cu(OH)]+ + H+
NH4Cl → NH4+ + Cl-
NH4+ + H2O ⇔ NH3 + H3O+
- Dung dịch có tính bazơ: Na2S, CH3COOK.
Na2S → 2Na+ + S2-
S2- + H2O ⇔ HS- + OH-
CH3COOK → CH3COO- + K+
CH3COO- + H2O ⇔ CH3COOH + OH-
- Dung dịch có tính lưỡng tính: NaHCO3.
NaHCO3 → Na+ + HCO3-
HCO3- + H2O ⇔ H2CO3 + OH-
HCO3- + H2O ⇔ CO32- + H3O+
- Dung dịch trung tính: NaCl, Ba(NO3)2
NaCl → Na+ + Cl-
Ba(NO3)2 → Ba2+ + 2NO3-
Bài 5: Phương trình điện li nào sau đây không đúng ?
A. HCl → H+ + Cl- B. CH3COOH ⇔ CH3COO- + H+
C. H3PO4 → 3H+ + PO43- D. Na3PO4 → 3Na+ + PO43-
Hướng dẫn:
Đáp án C
Bài 6: Phương trình điện li nào sau đây viết đúng ?
A. H2SO4 ⇔ H+ + HSO4- B. H2SO3 ⇔ 2H+ + HCO3-
C. H2SO3 → 2H+ + SO32- D. Na2S ⇔ 2Na+ + S2-
Hướng dẫn:
Đáp án B
Bài 7: Các chất dẫn điện là
A. KCl nóng chảy, dung dịch NaOH, dung dịch HNO3.
B. Dung dịch glucozơ, dung dịch ancol etylic, glixerol.
C. KCl rắn khan, NaOH rắn khan, kim cương.
D. Khí HCl, khí NO, khí O3.
Hướng dẫn:
Đáp án A
Bài 8: Dãy các chất đều là chất điện li mạnh là
A. KOH, NaCl, H2CO3. B. Na2S, Mg(OH)2 , HCl.
C. HClO, NaNO3, Ca(OH)3. D. HCl, Fe(NO3)3, Ba(OH)2.
Hướng dẫn:
Đáp án D
B. Bài tập trắc nghiệm
Bài 1: Dãy nào sau đây chỉ chứa các chất điện li mạnh:
A. NaNO3, HClO3, NaHSO4, Na2S, NH4Cl.
B. NaNO3, Ba(HCO3)2, HF, AgCl, NH4Cl.
C. NaNO3, HClO3, H2S, Mg3(PO4)2, NH4Cl.
D. NaNO3, HClO3, Na2S, NH4Cl, NH3.
Lời giải:
Đáp án: A
Bài 2: Dãy nào sau đây chỉ chứa chất điện ly yếu
A. H2S, HCl, Cu(OH)2, NaOH
B. CH3COOH, H2S, Fe(OH)3, Cu(OH)2
C. CH3COOH, Fe(OH)3, HF, HNO3
D. H2S, HNO3, Cu(OH)2, KOH.
Lời giải:
Đáp án: C
Bài 3: Phương trình điện ly nào dưới đây viết đúng?
A. HF ⇔ H + F-
C. Al(OH)3 → Al3+ + 3OH-
B. H3PO4 → 3H+ + PO43-
D. HCl ⇔ H+ + NO3-
Lời giải:
Đáp án: A
Bài 4: Trong dd NaHSO4 có các loại phân tử và ion nào dưới đây (bỏ qua sự điện li của nước):
A. NaHSO4; H+; HSO4-; SO42-; Na+; H2O
B. HSO4-; Na+; H2O
C. H+; SO42-; Na+; H2O
D. H+; HSO4-; SO42-; Na+; H2O
Lời giải:
Đáp án: A
Bài 5: Hấp thụ CO2 vào nước thu được dd có các loại phân tử và ion nào dưới đây (bỏ qua sự điện li của nước):
A. H2CO3; H+; HCO3-; CO32-; H2O
B. H2CO3; H+; HCO3-; CO32-; H2O; CO2
C. H+; HCO3-; CO32-; H2O
D. H+; CO32-; H2O
Lời giải:
Đáp án: B
Bài 6: Theo Ahrenius thì kết luận nào sau đây đúng?
A. Bazơ là chất nhận proton
B. Axit là chất khi tan trong nước phân ly cho ra cation H+
C. Axit là chất nhường proton.
D. Bazơ là hợp chất trong thành phần phân tử có một hay nhiều nhóm OH–.
Lời giải:
Đáp án: B
Bài 7: Theo thuyết Areniut, chất nào sau đây là axit?
A. NH3 B. KOH C. C2H5OH D. CH3COOH
Lời giải:
Đáp án: D
Bài 8: Theo thuyết Areniut thì chất nào sau đây là bazơ ?
A. HCl B. HNO3 C.CH3COOH D. KOH
Lời giải:
Đáp án: D
Bài 9: Theo thuyết Bronstet, H2O được coi là axit khi nó:
A. Cho một electron B. Nhận một electron
C. Cho một proton D. Nhận một proton.
Lời giải:
Đáp án: C
Bài 10: Theo thuyết Bronstet, H2O được coi là bazơ khi nó:
A. Cho một electron B. Nhận một electron
C. Cho một proton D. Nhận một proton.
Lời giải:
Đáp án: D
Bài 11: Theo thuyết Bronstet, chất nào sau đây chỉ là axit?
A. HCl B. HS– C. HCO3– D. NH3.
Lời giải:
Đáp án: A
Bài 12: Dãy chất và ion nào sau đây có tính chất trung tính?
A. Cl–, Na+, NH4+, H2O B. ZnO, Al2O3, H2O
C. Cl–, Na+ D. NH4+, Cl–, H2O
Lời giải:
Đáp án: B
Bài 13: Cho 2 phương trình:
S2- + H2O → HS- + OH- ; + H2O → NH3 + H 3O+
Theo thuyết axit-bazơ của Bronsted thì:
A. S2- là axit, là bazơ B. S2- là bazơ, là axit.
C. S2- và đều là axit D. S2- và đều là bazơ.
Lời giải:
Đáp án: C
Bài 14: Theo Bronsted, các chất NaHCO3, NaHS, Al(OH)3, Zn(OH)2 đều là:
A. Axit B. Bazơ C. Chất trung tính D. Chất lưỡng tính
Lời giải:
Đáp án: D
Bài 15: Trong các phản ứng dưới đây, ở phản ứng nào nước đóng vai trò là một bazơ (theo Bronsted).
A. HCl + H2O → H3O+ + Cl-
B. Ca(HCO3)2 → CaCO3 + H2O + CO2 .
C. NH3 + H2O ⇔ NH4+ + OH-.
D. CuSO4 + 5H2O → CuSO4.5H2O.
Lời giải:
Đáp án: A
Bài 16: Axít nào sau đây là axit một nấc?
A. H2SO4 B. H2CO3 C. CH3COOH D. H3PO4
Lời giải:
Đáp án: A
Bài 17: Dãy chất nào sau đây chỉ gồm các hiđrôxit lưỡng tính ?
A. Al(OH)3, Zn(OH)3, Fe(OH)2
B. Zn(OH)2, Sn(OH)2, Pb(OH)2
C. Al(OH)3, Fe(OH)2,Cu(OH)2
D. Mg(OH), Pb(OH)2, Cu(OH)2
Lời giải:
Đáp án: B
Bài 18: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch ?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaAlO2 và KOH
D. NaCl và AgNO3
Lời giải:
Đáp án: C
Bài 19: Phản ứng hóa học nào sau đâycó phương trình ion thu gọn là H+ + OH- → H2O ?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4
D. H2SO4 +Ba(OH)2 → 2 H2O + BaSO4
Lời giải:
Đáp án: A
Bài 20: Cho 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion trong các ion sau : Ba2+ , Al3+ , Na+, Ag+ ,CO , NO , Cl- , SO42-. Các dung dịch đó là :
A. BaCl2, Al2(SO4)3, Na2CO3, AgNO3.
B. Ba(NO3)2, Al2(SO4)3, Na2CO3, AgCl.
C. BaCl2, Al2(CO3)3, Na2CO3, AgNO3.
D. Ba(NO3)2, Al2(SO4)3, NaCl, Ag2CO3.
Lời giải:
Đáp án: A
Các dạng bài tập về sự điện li
A. Phương pháp giải & Ví dụ minh họa
a. Tính độ điện li
Lý thuyết và Phương pháp giải
+ Viết phương trình điện li của các chất.
+ Biểu diễn số mol các chất trong phương trình theo từng thời điểm (ban đầu, phản ứng,cân bằng) tùy theo yêu cầu và dữ kiện bài toán.
+ Xác định nồng độ chất (số phân tử) ban đầu, nồng độ chất (số phân tử) ở trạng thái cân bằng, suy ra nồng độ chất (số phân tử) đã phản ứng (phân li).
+ Độ điện li
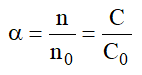
Ví dụ minh họa
Bài 1: Trong 1 lít dung dịch CH3COOH 0,02M có chứa 1,2407.1022 phân tử chưa phân li và ion. Tính độ điện li α của CH3COOH tại nồng độ trên, biết n0=6,022.1023.
Hướng dẫn:
nCH3COOH = 0,02 mol . Số phân tử ban đầu là:
n0 = 1. 0,02.6,022.1023 = 1,2044.1022 phân tử
| CH3COOH : H+ | + CH3COO- (1) | ||
| Ban đầu | n0 | ||
| Phản ứng | n | n | n |
| Cân bằng | (n0-n) | n | n |
Ở trạng thái cân bằng có tổng số phân tử chưa phân li và các ion là:
Ở (n0 – n) + n + n=1,2047.1022
Vậy α = n/n0 = 0, 029 hay α = 2,9%
Bài 2: Tính độ điện li của axit HCOOH 0,007M trong dung dịch có [H+]=0,001M
Hướng dẫn:
HCOOH + H2O → HCOO- + H3O+
Ban đầu: 0,007 0
Phản ứng: 0,007. a 0,007. a
Cân bằng: 0,007(1-a) 0,007. a
Theo phương trình ta có: [H+] = 0,007. a (M) ⇒ 0,007. a= 0,001
Vậy α = n/n0 = 0,1428 hay α = 14,28%.
b. Xác định nồng độ ion
Lý thuyết và Phương pháp giải
+ Viết phương trình điện li của các chất.
+ Căn cứ vào dữ kiện và yêu cầu của đầu bài, biểu diễn số mol các chất trong phương trình theo từng thời điểm (ban đầu, phản ứng,cân bằng) hoặc áp dụng C=C0.
Ví dụ minh họa
Bài 1: Trộn 100 ml dung dịch NaCl 0,10M với 100ml dung dịch Na2SO4 0,10M. Xác định nồng độ các ion có mặt trong dung dịch.
Hướng dẫn:
NaCl → Na+ + Cl- (1)
Na2SO4 → 2Na+ + SO42- (2)
[Na+] = (0,01 + 0,02)/(0,01+0,01)= 0,15M
[Cl-]= 0,01/(0,01+0,01) = 0,05M
[SO42-] =0,05M
Bài 2: Tính nồng độ mol của các ion CH3COOH, CH3COO-, H+ tại cân bằng trong dung dịch CH3COOH 0,1M có α = 1,32%.
Hướng dẫn:
CH3COOH : H+ + CH3COO-
Ban đầu C0 0 0
Phản ứng C0 . α C0 . α C0 . α
Cân bằng C0 .(1- α) C0 . α C0 . α
Vậy [H+ ] = [CH3COO-] = C0 . α = 0,1. 1,32.10-2 M = 1,32.10-3 M
[CH3COOH] = 0,1M - 0,00132M =0,09868M
Bài 3: Một dung dịch có chứa các ion: Mg2+, Cl-, Br-.
-Nếu cho dd này tác dụng với dd KOH dư thì thu được 11,6 gam kết tủa.
-Nếu cho dd này tác dụng với AgNO3 thì cần vừa đúng 200 ml dd AgNO3 2,5M và sau phản ứng thu được 85,1 g kết tủa.
a. Tính [ion] trong dd đầu? biết Vdd = 2 lít.
b. Cô cạn dung dịch ban đầu thì thu được bao nhiêu gam chất rắn?
Hướng dẫn:
Phương trình ion: Mg2+ + 2OH- → Mg(OH)2↓
0,2 ← 0,2 mol
Ag+ + Cl- → AgCl↓; Ag+ + Br- → AgBr↓
Gọi x, y lần lượt là mol của Cl-, Br-.
x + y = 0,5 (1) ; 143,5x + 188y = 85,1 (2) . Từ (1),(2) ⇒ x = 0,2, y = 0,3
a. [Mg2+] = 0,2/2 = 0,1 M; [Cl-] = 0,2/2 = 0,1 M; [Br-] = 0,3/0,2 = 0,15 M
b. m = 0,2.24 + 0,2.35,5 + 0,3.80 = 35,9 gam
B. Bài tập trắc nghiệm
Bài 1: Trong dung dịch CH3COOH 0,043M, cứ 100 phân tử hòa tan có 2 phân tử phân li thành ion. Nồng độ của ion H+ là
A. 0,001M. B. 0,086M. C. 0,00086M. D. 0,043M.
Lời giải:
Đáp án: C
Độ điện li của CH3COOH là 0,02.
CM(H+)= 0,043.0,02 = 0,00086 (mol)
Bài 2: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion SO42- trong X là
A. 0,2M. B. 0,8M. C. 0,6M. D. 0,4M.
Lời giải:
Đáp án: B
Phản ứng điện li:
MgSO4 → Mg2+ + SO42-
0,1 0,1 (mol)
Al2(SO4)3 → 2Al3+ + 3SO42-
0,1 0,3 (mol)
nSO42- = 0,4 mol ⇒ CM(SO42-) = 0,4/0,5 = 0,8M
Bài 3: Trộn 400 ml dung dịch Fe2(SO4)3 0,2M với 100 ml dung dịch FeCl3 0,3m thu được dung dịch Y. Nồng độ ion Fe3+ trong Y là
A. 0.38M. B. 0,22M. C. 0,19M. D. 0,11M.
Lời giải:
Đáp án: A
Bài 4: Trộn 50 ml dung dịch NaCl 0,1M với 150 ml dung dịch CaCl2 0,2M. Vậy nồng độ của ion Cl- trong dung dịch sau khi trộn là
A. 0,325M. B. 0,175M. C. 0,3M. D. 0,25M.
Lời giải:
Đáp án: A
Số mol Cl- trong dung dịch là: 0,065 mol ⇒ [Cl-] = 0,325 M
Bài 5: Trộn 4g NaOH; 11,7 g NaCl; 10,4 gam BaCl2 H2O thành 200ml dung dịch B. Nồng độ mol/lít các ion có trong dung dịch B là:
A. [Na+] = 0,5 M; Ba2+ = 0,25 M; [OH-] = 1 M; [Cl-] = 1,5 M
B. [Na+] = 1,5 M; Ba2+ = 0,25 M; [OH-] = 0,5 M; [Cl-] = 1,5 M
C. [Na+] = 1 M; Ba2+ = 0,25 M; [OH-] = 0,5 M; [Cl-] = 0,5 M
D. [Na+] = 1,5 M; Ba2+ = 0,25 M; [OH-] = 0,5 M; [Cl-] = 0,5 M.
Lời giải:
Đáp án: B
nNaOH = 4/40 = 0,1 mol; nNaCl = 11,7/58,5 = 0,2 mol; nBaCl2 = 10,4/208 = 0,05 mol
nNa+ = 0,3 mol ⇒ [Na+] = 1,5 M; nBa2+ = 0,05 mol ⇒ [Ba2+] = 0,25 M;
nOH- = 0,1 mol ⇒ [OH-] = 0,5 M; nCl- = 0,3 mol ⇒ [Cl-] = 1,5 M.
Bài 6: Nồng độ mol/l của ion H+ trong dung dịch H2SO4 là 60% (D = 1,503 g/ml) là:
A. 12,4 M B. 14,4 M C. 16,4 M D. 18,4 M
Lời giải:
Đáp án: D
Giả sử trong 100 gam dung dịch H2SO4 là 60% có số mol là: nH2SO4 = (60.100)/(100.98) = 0,61 mol
V = 100/1,503 = 66,5 ml ⇒ CM(H2SO4) = 0,61/0,0665 = 9,2 M
Phương trình đl: H2SO4 → 2H+ + SO42-
⇒ [H+] = 18,4 M
Bài 7: Tính nồng độ ion H+ trong dung dịch CH3COOH 0,1M biết hằng số điện li của axit đó là 2.10-5 .
A. 1,5.10-6M B. 1,14.10-3M C. 2.10-5M D. 1,5 .10-5M
Lời giải:
Đáp án: B
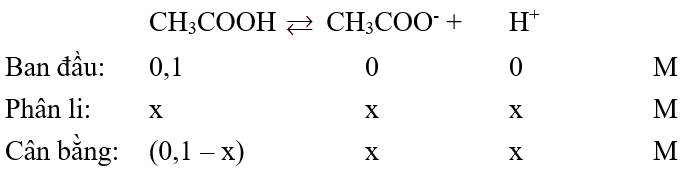
Theo bài ra:
Ka = 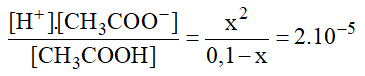
→ x ≈ 1,4.10-3M.
Bài 8: Cho dung dịch HNO2 0,01 M, biết hằng số phân ly Ka = 5.10-5. Nồng độ mol/ lít của NO2- trong dung dịch là
A. 5.10-4 B. 6,8. 10-4 C. 7,0.10-4 D. 7,5.10-4
Lời giải:
Đáp án: C
Gọi x là nồng độ của chất bị điện ly. Ta có; [H+] = [NO3-] = x M
⇒ Ka = x2/(0,01-x) = 5.10-5 ⇒ x = 7.10-4 M
Bài 9: Một dung dịch chứa Mg2+ (0,02 mol), K+ (0,03 mol) , Cl- (0,04 mol) và ion Z (y mol). Ion Z và giá trị của y là
A. NO3- (0,03). B. CO32- (0,015).
C. SO42- (0,01). D. NH4+ (0,01)
Lời giải:
Đáp án: A
Dạng bài tập Phản ứng trao đổi ion trong dung dịch
A. Phương pháp giải & Ví dụ minh họa
Viết phương trình ion thu gọn
+ Viết phản ứng dạng phân tử, phân tích dạng phân tử thành dạng ion. Rút gọn những ion giống nhau ở hai vế, cân bằng điện tích và nguyên tử ở hai vế, thu được phương trình ion rút gọn.
+ Các chất kết tủa, chất khí và chất điện li yếu vẫn giữ ở dạng phân tử.
Ví dụ minh họa
Bài 1: Viết phương trình phân tử và ion rút gọn của các phản ứng sau (nếu có) xảy ra trong dung dịch:
a) KNO3 + NaCl b) NaOH + HNO3
c) Mg(OH)2 + HCl d) Fe2(SO4)3 + KOH
e) FeS + HCl f) NaHCO3 + HCl
g) NaHCO3 + NaOH h) K2CO3 + NaCl
i) CuSO4 + Na2S
Hướng dẫn:
a. Không xảy ra
b. NaOH + HNO3 → NaNO3 + H2O
H+ + OH- → H2O
c. Mg(OH)2 + 2HCl → MgCl2 + H2O
Mg(OH)2 + 2H+ → Mg2+ + H2O
d. Fe2(SO4)3 + 6KOH → 2Fe(OH)3↓ + 3K2SO4
Fe3+ + 3OH- → Fe(OH)3↓
e. FeS + 2HCl → FeCl2 + H2S↑
FeS + 2H+ → Fe2+ + H2S↑
f. NaHCO3 + HCl → NaCl + CO2↑ + H2O
HCO3- + H+ → CO2↑ + H2O
g. NaHCO3 + NaOH → Na2CO3 + H2O
HCO3- + OH- → CO32- + H2O
h. Không xảy ra
i. CuSO4 + Na2S → CuS↓ + Na2SO4
Cu2+ + S2- → CuS↓
Bài 2: Một dung dịch có chứa các ion: Mg2+, Cl-, Br-.
-Nếu cho dd này tác dụng với dd KOH dư thì thu được 11,6 gam kết tủa.
-Nếu cho dd này tác dụng với AgNO3 thì cần vừa đúng 200 ml dd AgNO3 2,5M và sau phản ứng thu được 85,1 g kết tủa.
a. Tính [ion] trong dd đầu? biết Vdd = 2 lít.
b. Cô cạn dung dịch ban đầu thì thu được bao nhiêu gam chất rắn?
Hướng dẫn:
Phương trình ion:
Mg2+ + 2OH- → Mg(OH)2↓
0,2 ← 0,2 mol
Ag+ + Cl- → AgCl↓; Ag+ + Br- → AgBr↓
Gọi x, y lần lượt là mol của Cl-, Br-.
x + y = 0,5 (1) ; 143,5x + 188y = 85,1 (2) . Từ (1),(2) ⇒ x = 0,2, y = 0,3
a.[Mg2+] = 0,2/2 = 0,1 M; [Cl-] = 0,2/2 = 0,1 M; [Br-] = 0,3/0,2 = 0,15 M
b. m = 0,2.24 + 0,2.35,5 + 0,3.80 = 35,9 gam
Bài 3: Dd X chứa các ion: Fe3+, SO42-, NH4+, Cl-. Chia dd X thành hai phần bằng nhau:
Phần 1: tác dụng với lượng dư dd NaOH, đun nóng thu được 0,672 lít khí (đktc) và 1,07 gam kết tủa.
Phần 2: tác dụng với lượng dư dd BaCl2, thu được 4,66 gam kết tủa. Tổng khối lượng các muối khan thu được khi cô cạn dd X là (quá trình cô cạn chỉ có nước bay hơi)
Hướng dẫn:
nNH4+ = nNH3 = 0,672/22,4 = 0,03 mol
nFe3+ = 1,07/107 = 0,01 mol; nSO42- = 4,66/233 = 0,02 mol
Áp dụng đL bảo toàn điện tích: 3.0,01 + 0,03 = 2.0,02 +x ⇒ x = 0,02
m = 0,01.56 + 0,03.18 + 0,02.96 + 0,02.35,5 = 3,73 gam
Khối lượng muối khan trong dung dịch X: 3,73.2 = 7,46 gam
Bài 4: Cho 100ml dung dịch hỗn hợp CuSO4 1M và Al2(SO4)3 1M tác dụng với dung dịch Ba(OH)2 dư, lọc lấy kết tủa nung đến khối lượng không đổi thu được chất rắn có khối lượng là
Hướng dẫn:
m = mCuO + mBaSO4 = 80.0,1 + 233.0,4 = 101,2 gam
Bài 5: Cho hỗn hợp rắn A gồm KCl và KBr tác dụng với dung dịch AgNO3 dư Lượng kết tủa sinh ra khi làm khô có khối lượng bằng lượng AgNO3 đã phản ứng. Thành phần % khối lượng KCl trong hỗn hợp A là
Hướng dẫn:
Gọi mol KCl, KBr lần lượt là x, y mol.
Ta có: 35,5x + 80y = 62.(x+y)
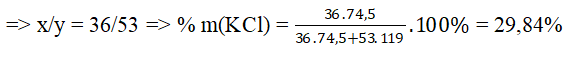
B. Bài tập trắc nghiệm
Bài 1: Phương trình ion rút gọn: H+ + HCO3- → CO2 ↑ + H2O tương ứng với PTHH dạng phân tử nào sau đây ?
(1) 2HCl + Na2CO3 → 2 NaCl + CO2 ↑ + H2O
(2) 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 ↑ + 2 H2O
(3) CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O
(4) Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 ↑ + 2H2O
Lời giải:
Đáp án: B
Bài 2: Các tập hợp ion sau đây có thể tồn tại đồng thời trong cùng một dung dịch
A.Na+, Cu2+, OH-, NO3- B. Ca2+, Fe2+, NO3-, Cl-
C.Na+, Ca2+, HCO3-, OH- D. Fe2+, H+, OH-, NO3-
Lời giải:
Đáp án: B
Bài 3: Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3
A. KBr B. K3PO4 C. HCl D. H3PO4
Lời giải:
Đáp án: D
Bài 4: Cho dung dịch chứa các ion sau : Na+ ,Ca2+ ,Mg2+ ,Ba2+ , H+ , NO3- . muốn tách được nhiều cation ra khỏi dung dịch mà không đưa ion lạ vào dung dịch người ta dùng :
A. dung dịch K2CO3 vừa đủ . B. dung dịch Na2SO4 vừa đủ.
C. dung dịch KOH vừa đủ. D. dung dịch Na2SO3 vừa đủ.
Lời giải:
Đáp án: D
Bài 5: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch ?
A. AlCl3 và Na2CO3 B. HNO3 và NaHCO3
C. NaAlO2 và KOH D. NaCl và AgNO3
Lời giải:
Đáp án: C
Bài 6: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là H+ + OH → H2O ?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4
D. H2SO4 +Ba(OH)2 → 2 H2O + BaSO4
Lời giải:
Đáp án: A
Bài 7: Phương trình: S2- + 2H+ → H2S là phương trình ion rút gọn của phản ứng
A. FeS + 2HCl → FeCl2 + H2S↑.
B. 2NaHSO4 + 2Na2S → 2Na2SO4 + H2S↑
C. 2HCl + K2S → 2KCl + H2S↑.
D. BaS + H2SO4 → BaSO4↓ + H2S↑.
Lời giải:
Đáp án: C
Bài 8: Không thể có dung dịch chứa đồng thời các ion
A. Ba2+, OH-, Na+, SO42- B. K+, Cl-, OH-, Ca2+.
C. Ag+, NO3-, Cl-, H+ D. A và C đúng.
Lời giải:
Đáp án: D
Bài 9: Cho 1 lượng dư dung dịch AgNO3 vào 100 ml dung dịch hỗn hợp NaF 0,05M , NaCl 0,1M , NaBr 0,05M. Khối lượng kết tủa thu được là
A. 3,01 gam B. 2,375 gam C. 2,875 gam D. 3,375 gam
Lời giải:
Đáp án: B
m = 0,01.(108 + 35,5) + 0,005.(108 + 80) = 2,375 gam
Bài 10: Cho 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion trong các ion sau : Ba2+ ,Al3+ , Na+, Ag+ ,CO3- ,NO3- ,Cl- ,SO42-. Các dung dịch đó là :
A. BaCl2,Al2(SO4)3,Na2CO3,AgNO3.
B. Ba(NO3)2, Al2(SO4)3,Na2CO3, AgCl.
C. BaCl2, Al2(SO4)3,Na2CO3,AgNO3.
D. Ba(NO3)2, Al2(SO4)3,NaCl, Ag2CO3.
Lời giải:
Đáp án: A

