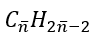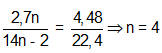Chuyên đề: Hidrocacbon không no - Hoá học lớp 11
Chuyên đề: Hidrocacbon không no
Với Chuyên đề: Hidrocacbon không no Hoá học lớp 11 tổng hợp các dạng bài tập, trên 300 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hidrocacbon không no từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.
Tổng hợp Lý thuyết chương Hidrocacbon không no
- Lý thuyết Tính chất của Anken Xem chi tiết
- Lý thuyết Tính chất của Ankadien Xem chi tiết
- Lý thuyết Tính chất của Ankin Xem chi tiết
- Tóm tắt Lý thuyết về hiđrocacbon không no Xem chi tiết
- Lý thuyết Khái niệm về tecpen Xem chi tiết
Phương pháp giải các dạng bài tập chương Hidrocacbon không no
- 4 dạng bài tập về Hidrocacbon không no trong đề thi Đại học có giải chi tiết
- Dạng 1: Bài tập tính chất hóa học của Anken, Ankađien, Ankin
- Dạng 2: Dạng bài tập Đồng phân, danh pháp của Anken, Ankađien, Ankin
- Dạng 3: Phản ứng cộng của Anken, Ankađien, Ankin
- Dạng 4: Phản ứng đốt cháy của Anken, Ankađien, Ankin
- Dạng 5: Phản ứng oxi hóa Anken, Ankađien, Ankin
- Dạng 6: Phản ứng của Ankin với AgNO3 (Phản ứng thế hidro của Ank-1-in)
Bài tập trắc nghiệm
- 100 câu trắc nghiệm Hidrocacbon không no có lời giải chi tiết (cơ bản)
- 100 câu trắc nghiệm Hidrocacbon không no có lời giải chi tiết (nâng cao)
Phản ứng đốt cháy của Anken, Ankađien, Ankin
A. Phương pháp giải & Ví dụ minh họa
a/ Anken
Lý thuyết và Phương pháp giải
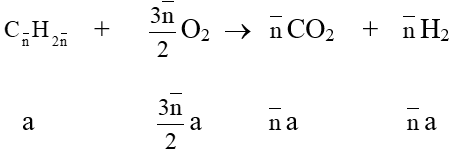
• Khi đốt cháy một nhiều hiđrocacbon thuộc cùng dãy đồng đẳng tính được:
nCO = nH2O hoặc nO = 1,5nCO = 1,5nH2O
→ Các hiđrocacbon đó là anken hay xicloankan.
• Đốt cháy hỗn hợp ankan + anken (xicloankan) thì
nCO < nH2O hoặc nO2 > 1,5nCO2 và nankan = nH2O - nCO = 2(nO2- 1,5nCO2)
Ví dụ minh họa
Bài 1: Đem đốt cháy hoàn toàn 0,1 mol hỗn hợp X gồm 2 anken là đồng đẳng kế tiếp nhau thu được CO2 và nước có khối lượng hơn kém nhau 6,76 gam.
a. Tìm công thức phân tử của 2 anken đó?
b. Tính phần trăm khối lượng mỗi anken trong hỗn hợp X.
Hướng dẫn:
Phương trình đốt cháy:
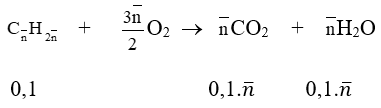
a. Ta có: 44. 0,1.ntb - 18. 0,1.ntb = 6,76 → ntb = 2,6 mol
Vậy công thức phân tử của 2 anken đó là: C2H4 và C3H6
b. Áp dụng sơ đồ đường chéo
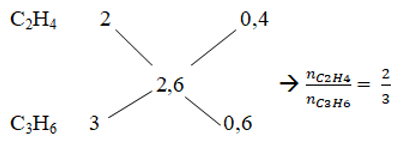
Số mol của C2H4 và C3H6 là: nC2H4 = 0,1.2/5 = 0,4 mol; nC3H6 = 0,1.3/5 = 0,6 mol
Phần trăm khối lượng của mỗi anken là:
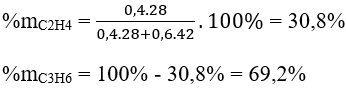
Bài 2: Đốt cháy hoàn toàn 2,24 lít đkc 1 hiđrocacbon X mạch hở, sau đó dẫn sản phẩm cháy lần lượt qua dung dịch H2SO4 và dung dịch Ca(OH)2 dư. Sau thí nghiệm thấy khối lượng bình đựng dung dịch axit tăng 5,4g, bình đựng dung dịch Ca(OH)2 có 30g kết tủa. Tìm CTPT của X.
Hướng dẫn:
Số mol X là: nX = 2,24/22,4 = 0,1 mol
Khối lượng bình đựng dung dịch axit tăng là khối lượng của H2O:
mH2O = 5,4 gam ⇒ nH2O = 5,4/18 = 0,3 mol
Số mol CO2 là: nCO2 = nCaCO3 = 30/100 = 0,3 mol
Nhận thấy: nH2O = nCO2 ⇒ hidrocacbon X là anken
Phương trình đốt cháy:
CnH2n + 3n/2 O2 → nCO2 + nH2O
0,1 0,3
Ta có: 0,1.n = 0,3 ⇒ n = 3. Vậy CTPT của X là C3H6
b/ Akadien và Akin
Lý thuyết và Phương pháp giải
Phản ứng đốt cháy: CnH2n-2 + (3n - 1)/2 O2 → nCO2 + (n - 1)H2O
nCO2 > nH2O và nCO2 - nH2O = nankin.
Ví dụ minh họa
Bài 1: Hỗn hợp A gồm một anken và một ankadien có thể tích là 6,72 lít (đktc) được chia thành 2 phần bằng nhau:
- Phần 1: đốt cháy hoàn toàn hỗn hợp thu được 8,96 lít CO2 và 6,3 gam nước.
- Phần 2: dẫn qua dung dịch brom dư bình tăng m gam.
a. Tính thành phần phần trăm thể tích mỗi khí trong A?
b. Khối lượng m là bao nhiêu?
c. Tìm CTPT của anken và ankađien?
Hướng dẫn:
Số mol của hỗn hợp A là: nA = 6,72/22,4 = 0,3 mol
Số mol A trong một phần là: n = 0,15 mol
Gọi CTPT của anken và ankadien lần lượt là: CnH2n và CmH2m-2 (n > 1; m > 2)
Phương trình đốt cháy:
CnH2n + 3n/2 O2 → nCO2 + nH2O
CmH2m-2 + (3m-1)/2 O2 → mCO2 + (m-1) H2O
Số mol CO2 và mol H2O lần lượt là: nCO2 = 8,96/22,4 = 0,4 mol; nH2O = 6,3/18 = 0,35 mol
Số mol của ankadien là: nankaddien = 0,4 – 0,35 = 0,05 mol
Số mol của anken là: nanken = 0,15 – 0,05 = 0,1 mol
a. Phần trăm thể tích mỗi khí trong A là:
%Vanken = (0,1.100%)/0,15 = 66,67 % ; %Vankaddien = 100% - 66,67% = 33,33%
b. Dẫn A qua dung dịch Brom dư thì khối lượng bình brom tăng là khối lượng của A
mA = m↑ = mC + mH = 0,4.12 + 0,35.2 = 5,5 gam
c. Theo phương trình đốt cháy ta có: 0,05m + 0,1n = 0,4 ⇒ n = 2 và m = 4
Vậy CTPT của anken và ankadien là: C2H4 và C4H6
Bài 2: Đốt cháy hoàn toàn hiđrocacbon X, dẫn toàn bộ sản phẩm lần lượt đi qua bình 1 đựng H2SO4 dư, bình 2 đựng 400ml dd Ca(OH)2 0,5M, không có khí đi ra khỏi bình 2. Kết thúc phản ứng thấy khối lượng bình 1 tăng lên 3,6 gam, bình 2 có 10 gam kết tủa trắng. Xác định CTPT của X ?
Hướng dẫn:
Số mol Ca(OH)2 là: nCa(OH)2 = 0,5.0,4 = 0,2 mol;
Khối lượng bình 1 tăng là khối lượng của H2O: mH2O = 3,6/18 = 0,2 mol
Số mol CaCO3: nCaCO3 = 10/100 = 0,1 mol
TH1: Khí CO2 đi vào bình 2 chỉ sinh ra CaCO3:
nCO2 = nCaCO3 = 0,1 mol
nH2O > nCO2 ⇒ hidrocacbon X là ankan.
Số mol ankan là: nankan = 0,2 – 0,1 = 0,1 mol.
Phương trình đốt cháy:
CnH2n+ 2 + (3n+1)/2 O2 → nCO2 + (n+1)H2O
0,1 0,1 mol
Ta có : 0,1n = 0,1 ⇒ n =1. Vậy CTPT của X là CH4
TH2: Khí CO2 đi vào bình 2 tạo ra 2 muối là CaCO3 và Ca(HCO3)2
nCa(HCO3)2 = 0,2 – 0,1 = 0,1 mol
Bảo toàn nguyên tố C ta có: nCO2 = 0,1.2 + 0,1 = 0,3 mol
nCO2 > nH2O ⇒ Hidrocacbon là ankin
Phương trình đốt cháy: CnH2n-2 + (3n - 1)/2 O2 → nCO2 + (n - 1)H2O
Số mol ankin là: nankin = 0,3 – 0,2 = 0,1 mol
Theo phương trình ta có: 0,1n = 0,3 ⇒ n = 3 . Vậy CTPT của ankin là: C3H4
Bài 3: Đốt cháy hoàn toàn 14,6 gam hh A (gồm 2 ankin X và Y là đồng đẳng liên tiếp, MX < MY) bằng oxi vừa đủ, hấp thụ toàn bộ sản phẩm cháy vào dd Ca(OH)2 dư, thấy dd thu được có khối lượng giảm đi 49 gam.
a. Xác định CTPT của X?
b. Tính % số mol của X, Y trong A?
Hướng dẫn:
a. Gọi CTPT của 2 ankin là:
Phương trình đốt cháy:
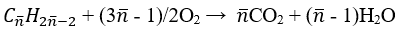
Khối lượng dung dịch giảm 49 gam ta có: m↓ = mCaCO3 – (mH2O + mCO2)
⇒ 49 = 100.nCO2 – (18.nH2O + 44.nCO2) = 56.nCO2 – 18. nH2O (1)
Mặt khác: mA = mC + mH ⇒ 14,6 = 12.nCO2 + 2.nH2O (2)
Từ (1), (2) ta có : nCO2 = 1,1 và nH2O = 0,7 mol
Số mol 2 ankin là : nA = 1,1 – 0,7 = 0,4 mol
Theo phương trình phản ứng: 0,4. ntb = 1,1 ⇒ ntb = 2,75
Vậy CTPT của 2 ankin là: C2H2 và C3H4
b. Áp dụng sơ đồ đường chéo ta có:
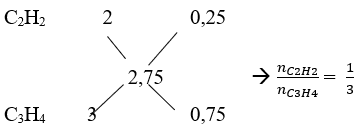
Số mol của C2H2 và C3H4 là: nC2H2 = 0,4.1/4 = 0,1 mol; nC3H4 = 0,4.3/4 = 0,3 mol
Phần trăm khối lượng của mỗi anken là:
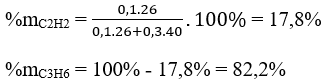
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn hỗn hợp 2 olefin thu được (m + 4)g H2O và (m + 30)g CO2. Giá trị của m là :
A. 14 g B. 21 g C. 28g D. 35 g.
Lời giải:
Đáp án: A
CnH2n + 3n/2 O2 → nCO2 + nH2O
nH2O = nCO2 ⇒ mH2O/18 = mCO2/44 ⇒ m = 14 g
Bài 2: Đốt cháy hoàn toàn a gam hỗn hợp eten, propen, but-2-en cần dùng vừa đủ b lít oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là:
A. 92,4 lít. B. 94,2 lít. C. 80,64 lít. D. 24,9 lít.
Lời giải:
Đáp án: C
CnH2n + 3n/2 O2 → nCO2 + nH2O
nO2 =3/2 nO2 = 3/2 . 2,4 = 3,6 mol ⇒ VO2 = 3,6.22,4 = 80,64 lít
Bài 3: Chia hỗn hợp 2 anken thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần một trong không khí thu được 6,3 gam H2O. Phần hai cộng H2 được hỗn hợp A. Nếu đốt cháy hoàn toàn phần hai thì thể tích CO2 (đktc) tạo ra là:
A. 3,36 lít B. 7,84 lít C. 6,72 lít D. 8,96 lít
Lời giải:
Đáp án: B
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n + H2 → CnH2n + 2
nCO2 = nH2O = 6,3/18 = 0,35 mol; VCO2 = 0,35 .22,4 = 7,84 lít
Bài 4: Hỗn hợp X gồm C3H8 và C3H6 có tỉ khối so với hiđro là 21,8. Đốt cháy hết 5,6 lít X (đktc) thì thu được bao nhiêu gam CO2 và bao nhiêu gam H2O?
A. 33g và 17,1g. B. 22g và 9,9g.
C. 13,2g và 7,2g. D. 33g và 21,6g.
Lời giải:
Đáp án: A
C3H6 + 9/2 O2 → 3CO2 + 3H2O
C3H8 + 5O2 → 3CO2 + 4H2O
nX = 0,25 mol ⇒ nCO2 = 0,25.3 = 0,75 mol; mCO2 = 0,75.44 = 33 gam;
mX = mC + mH ⇔ 21,8.2.0,25 = 0,75.12 + 2.nH2O
⇒ nH2O = 0,95mol; mH2O = 18.0,95 = 17,1 gam
Bài 5: Một hỗn hợp A gồm 2 hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam H2O. CTPT X, Y và khối lượng của X, Y là:
A. 12,6 gam C3H6 và 11,2 gam C4H8.
B. 8,6 gam C3H6và 11,2 gam C4H8.
C. 5,6 gam C2H4 và 12,6 gam C3H6.
D. 2,8 gam C2H4 và 16,8 gam C3H6.
Lời giải:
Đáp án: C
nCO2 = 1,3 mol; nH2O = 1,3 mol ⇒ Hidrocacbon là anken; CTPT là:
CnH2n + 3n/2 O2 → nCO2 + nH2O
nX = 0,5 mol ⇒ ntb = 1,3/0,5 = 2,6 ⇒ 2 anken là: C2H4, C3H6;
nC2H4 : nC3H6 = 2:3 ⇒ nC2H4 = 0,2 mol và nC3H6 = 0,3 mol
⇒ mC2H4 = 0,2.28 = 5,6 gam và mC3H6 = 0,3.42 = 12,6 gam
Bài 6: Đốt cháy hoàn toàn 0,2 mol hồn hợp X gồm một ankan và một anken, thu được 0,35 mol CO2 và 0,4 mol H2O. Thành phần phần trăm số mol của anken có trong X là
A.40% B. 50% C. 25% D. 75%
Lời giải:
Đáp án: D
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1)H2O
nankan = nH2O - nCO2 = 0,4 – 0,35 = 0,05 (mol)
nanken = 0,2 – 0,05 = 0,15 mol → %Vanken = .100% = 75%
Bài 7: Đốt cháy hoàn toàn 0,1 mol hỗm hợp gồm CH4, C4H10 và C2H4 thu được 0,14 mol CO2 và 0,23 mol H2O. Số mol của ankan và anken trong hỗn hợp lần lượt là
A. 0,09 và 0,01. B. 0,01 và 0,09.
C. 0,08 và 0,02 D. 0,07 và 0,04
Lời giải:
Đáp án: A
CnH2n + 3n/2 O2 → nCO2 + nH2O
CnH2n+2 + (3n+1)/2 O2 → nCO2 + (n+1) H2O → nankan = 0,23 – 0,14 = 0,09 mol
⇒ nanken = 0,1 – 0,09 = 0,01 mol
Bài 8: Đốt cháy hoàn toàn 2,7 gam ankađien liên hợp X, thu được 4,48 lít CO2 (đktc). Công thức cấu tạo của X là
A. CH2 = C = CH2 B. CH2 = C – CH = CH2.
C. CH2 = C(CH3) – CH = CH2 D. CH2 = CH – CH = CH2
Lời giải:
Đáp án: D
Đặt CTPT X là CnH2n-2 →
→ CTPT: C4H6
Bài 9: Đốt cháy hoàn toàn 2,24 lít khí X (đktc) gồm buta–1,3–đien và etan sau đó dẫn toàn bộ sản phẩm cháy hấp thụ vào dung dịch H2SO4 đặc thì khối lượng dung dịch axit tăng thêm bao nhiêu gam ?
A. 3,6 g. B. 5,4 g. C. 9,0 g. D. 10,8 g.
Lời giải:
Đáp án: B
nH2O = 3.nX = 3.0,1 = 0,3 mol ⇒ m↑ = mH2O = 0,3.18 = 5,4 gam
Bài 10: 2,24 lít hỗn hợp X gồm buta–1,3–đien và penta–1–3-đien (đktc) có thể tác dụng hết tối đa bao nhiêu lít dung dịch brom 0,10 M ?
A. 2 lít. B. 1 lít. C. 1,5 lít. D. 2,5 lít.
Lời giải:
Đáp án: A
nBr2 = 2nX = 0,2 mol ⇒ VBr2 = 0,2/0,1 = 2 lít
Bài 11: Đốt cháy 8 gam ankin X, rồi hấp thụ hoàn toàn sản phẩm cháy vào dd Ca(OH)2 dư, thu được 60 gam kết tủa. CTPT của X là:
A. C2H2 B. C3H4 C. C5H8 D. C4H6
Lời giải:
Đáp án: B
CnH2n-2 + (3n-1)/2 O2 → nCO2 + (n-1)H2O
nCO2 = nCaCO3 = 0,6 mol ⇒ MX = 8n/0,6 = 40n/3 ⇒ n = 3
Bài 12: Đốt cháy hoàn toàn 1 thể tích A gồm C2H6 và C2H2 thu được CO2 và H2O có tỉ lệ mol là 1:1. Phần trăm thể tích mỗi khí trong hỗn hợp đầu lần lượt là
A. 50%, 50% B. 30%, 70% C. 25% ,75% D. 70% ,30%
Lời giải:
Đáp án: A
giả sử nA = 1 mol ; nC2H6 = x và nC2H2 = y; nH2O = nCO2 = 2 mol; x + y = 1 và 3x + y = 2 ⇒ x = 0,5 và y = 0,5 ⇒ %V
Bài 13: 1 mol hiđrocacbon X đốt cháy cho ra 5 mol CO2, 1mol X phản ứng với 2 mol AgNO3/NH3. Xác định CTCT của X.
A. CH2=CH-CH2-C≡C-H C. CH2=CH-CH=CH-CH3
B. HC≡C-CH2- C≡C-H D. CH2=C=CH-CH-CH2
Lời giải:
Đáp án: B
CTPT X là CxHy; x= 5 ⇒ có 5 nguyên tử C; X có 2 liên kết 3 ở đầu mạch.
Bài 14: Đốt cháy hoàn toàn m gam hiđrocacbon ở thể khí, mạch hở, nhẹ hơn không khí thu được 7,04 gam CO2. Sục m gam hiđrocacbon này vào nước brom dư đến khi phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là:
A. 2 gam. B. 4 gam. C. 10 gam D. 2,08 gam
Lời giải:
Đáp án: D
Hidrocacbon là C2H2 (vì M < Mkk; nBr2 = 2nankin)
nBr2 = 0,16 mol; nCO2 = 0,16 mol; nankin = 0,08 mol; m = 0,08.26 = 2,08 gam.
Bài 15: Hỗn hợp X có tỉ khối so với H2 là 21 gồm propan, propen và propin. Khi đốt cháy hoàn toàn 0,1 mol X, tổng khối lượng của CO2 và H2O thu được là
A. 18,60 gam. B. 18,96 gam. C. 20,40 gam. D. 16,80 gam.
Lời giải:
Đáp án: A
nCO2 = 3nX = 3.0,1 = 0,3 mol; mX = 0,1.21.2 = 4,2 gam
⇒ nH2O = (4,2 – 0,3.12)/2 = 0,3 mol;
m = mCO2 + mH2O = 0,3.44 + 0,3.18 = 18,6 gam
Phản ứng oxi hóa Anken, Ankađien, Ankin
A. Phương pháp giải & Ví dụ minh họa
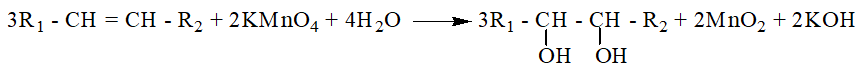
* Tỷ lệ : nAnken : = 3 : 2 và luôn không đổi
n R1 – CH =CH – R2 → Viết phương trình chỉ quan tâm nguyên tử C mang liên kết đôi
Tính tỷ lệ mắt xích: n = Mpolyme/Manken
Ví dụ minh họa
Bài 1: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu đen cần V lít khí C2H4 (đktc). Giá trị tối thiểu của V là
Hướng dẫn:
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH
⇒ V = 0,06.22,4 = 1,344 (lít)
Bài 2: Cho 3,5g một anken tác dụng với dung dịch KMnO4 loãng thì được 5,2g sản phẩm hữu cơ. Tìm CTPT của anken.
Hướng dẫn:
Gọi CTPT của anken là : CnH2n
Phương trình phản ứng :
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 + 2KOH
3.14n 3.14n + 102 M↑ = 102 g/mol
3,5 5,2 m↑ = 1,7 gam
n↑ = 1,7/102 = 1/60 ⇒ nanken = 0,05 mol
Manken = 3,5/0,05 = 70 = 14n ⇒ n = 5
Vậy CTPT của anken là : C5H10
Bài 3: Một hỗn A hợp hai olefin đồng đẳng kế tiếp nhau có thể tích 44,8 lít (đktc) dẫn qua bình chứa dung dịch KMnO4 dư, thấy khối lượng bình chứa dung dịch KMnO4 tăng 70g.
1. Xác định công thức phân tử, viết công thức cấu tạo hai olefin.
2. Sau khi phản ứng xảy ra thu được m gam kết tủa. Tính m?
Hướng dẫn:
Số mol hỗn hợp 2 anken: nA = 44,8/22,4 = 2 mol
Phương trình phản ứng: 3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓+ 2KOH
1. Khối lượng bình KMnO4 tăng là khối lượng của 2 anken :
Manken = 70 gam ⇒ MA = 70/2 = 35 ⇒ ntb = 35/14 = 2,5
Vậy CTPT của 2 anken là : C2H4 và C3H6
2. Theo phương trình phản ứng ta có: nMnO2 = 2.2/3 = 4/3 mol
Vậy khối lượng kết tủa thu được là: m = 84.4/3 = 112 gam
B. Bài tập trắc nghiệm
Bài 1: Oxi hoá etilen bằng dung dịch KMnO4 thu được sản phẩm là:
A. MnO2, C2H4(OH)2, KOH.
B. C2H5OH, MnO2, KOH.
C. K2CO3, H2O, MnO2.
D. C2H4(OH)2, K2CO3, MnO2.
Lời giải:
Đáp án: A
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2MnO2 ↓+ 2KOH
Bài 2: Để khử hoàn toàn 200 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu nâu đen cần V lít khí C2H4 (ở đktc). Giá trị tối thiểu của V là
A. 2,240. B. 2,688. C. 4,480. D. 1,344.
Lời giải:
Đáp án: D
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2MnO2 ↓+ 2KOH
nKMnO4 = 0,2.0,2 = 0,04 mol; nC2H4 = 0,04.3/2 = 0,06 mol ⇒ VC2H4 = 0,06.22,4 = 1,344 lít
Bài 3: Anken A phản ứng hoàn toàn với dung dịch KMnO4 được chất hữu cơ B có MB = 1,81MA. CTPT của A là:
A. C2H4 B. C3H6 C. C4H8 D. C5H10
Lời giải:
Đáp án: B
CTPT của anken A: CnH2n; chất hữu cơ B: CnH2n+2O2;
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓+ 2KOH
MB = 1,81; MA ⇔ 14n + 34 = 1,81.14n ⇒ n = 3
Bài 4: Hiện nay PVC được điều chế theo sơ đồ sau: C2H4 → CH2Cl–CH2Cl → C2H3Cl → PVC. Nếu hiệu suất toàn bộ quá trình đạt 80% thì lượng C2H4 cần dùng để sản xuất 5000kg PVC là:
A. 280kg. B. 1792kg. C. 2800kg. D. 179,2kg.
Lời giải:
Đáp án: C
nPVC = 5000/62,5 = 80 kmol ⇒ mC2H4 = 80.100.28/80 = 2800kg
Bài 5: Thổi 0,25 mol khí etilen qua 125ml dung dịch KMnO4 1M trong môi trường trung tính (hiệu suất 100%) khối lượng etylenglicol thu được bằng
A. 11,625g. B. 23,25g. C. 15,5g. D. 31g.
Lời giải:
Đáp án: A
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n+2O2 + 2MnO2 ↓+ 2KOH
netilenglicol = 0,125.3/2 = 0,1875 mol ⇒ m = 0,1875. 62 = 11,625 gam
Bài 6: Dẫn propen vào dung dịch KMnO4 thu được sản phẩm hữu cơ là
A. CH3CH2CH2CH3 B. CH3CH(OH)CH3.
C. CH3CH=CHCH3 D.CH3CH(OH)CH2OH
Lời giải:
Đáp án: D
Bài 7: Chất nào sau đây không làm đổi màu dung dịch KMnO4 ở nhiệt độ thường?
A. Axetilen B. Toluen C. Propilen D. Striren
Lời giải:
Đáp án: B
Phản ứng của Ankin với AgNO3 (Phản ứng thế hidro của Ank-1-in)
A. Phương pháp giải & Ví dụ minh họa
- Chỉ có ank-1-in hoặc các chất có liên kết ba đầu mạch mới có phản ứng với AgNO3/NH3.
• Tổng quát:
CnH2n-2 + xAgNO3 + xNH3 → CnH2n-2-xAgx↓ + xNH4NO3.
CxHy + aAgNO3 + aNH3 → CxHy-aAga↓ + aNH4NO3.
Chú ý:
+ nankin = n↓ ⇒ m↓ = mankin + 107.n↓.a.
+ Khối lượng bình đựng AgNO3/NH3 tăng bằng khối lượng ankin phản ứng.
+ Để tái tạo lại ankin ta cho ↓ phản ứng với HCl.
+ Anken và ankan không có phản ứng này.
Ví dụ minh họa
Bài 1: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,34 mol H2. Giá trị của a là
Hướng dẫn:
nC3H4 = nC3H3Ag = 17,64/147 = 0,12 mol
nC2H4 + 2nC3H4 = nH2 ⇒ nC2H4 = 0,1 mol ⇒ a = nC2H4 + nC3H4 = 0,22 mol
Bài 2: Hỗn hợp X gồm metan, etilen, axetilen. Sục 7 gam X vào nước brom dư thì thấy có 48 gam brom pư. Cho 7 gam trên pư với AgNO3 dư trong NH3 thì thu được 24 gam kết tủa. Tính khối lượng mỗi chất trong X?
Hướng dẫn:
Gọi số mol của metan, etilen, axetilen lần lượt là x, y, z ta có: 16x + 28y + 26z = 7 (1)
Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2
y………y
C2H2 + 2Br2 → C2H2Br4
z………2z
số mol brom phản ứng: nBr2 = 48/160 = 0,3 mol = y + 2z (2)
C2H2 + 2AgNO3 + 2NH3 → C2H2Ag2↓ + 2NH4NO3.
z……………………………….z
Số mol kết tủa: n↓ = 24/240 = 0,1 mol = z (3)
Từ (1), (2), (3) ta có: x = y = z = 0,1 mol
Khối lượng mỗi chất trong X là:
mmetan = 0,1.16 = 1,6 gam; metilen = 0,1.28 = 2,8 gam; maxetilen = 0,1.26 = 2,6 gam
Bài 3: Một hỗn hợp khí (X) gồm 1 ankan, 1 anken và 1 ankin có V =1,792 lít (ở đktc) được chia thành 2 phần bằng nhau:
+ Phần 1: Cho qua dung dịch AgNO3/NH3 dư tạo 0,735 g kết tủa và thể tích hỗn hợp giảm 12,5%
+ Phần 2: Đốt cháy hoàn toàn rồi hấp thụ sản phẩm cháy vào dung dịch Ca(OH)2 dư thì thấy có 12 gam kết tủa.
Xác định CTPT của các hiđrocacbon và %V các chất trong X biết ankan và anken có cùng số C?
Hướng dẫn:
Số mol ba chất trong X: nX = 0,08 mol⇒ số mol X trong một phần là: n = 0,04 mol
Thể tích hỗn hợp phần 1 giảm 12,5% ⇒ Số mol ankin trong mỗi phần là nankin = 0,04.0,125 = 0,005 mol. Nếu X là axetilen thì khối lượng kết tủa là 1,2 gam (trái với giả thiết)
+ Pư với AgNO3/NH3 ta có:
CnH2n-2 + AgNO3 + NH3 → CnH2n-3Ag↓ + NH4NO3.
Mol:0,005 0,005
⇒ 0,005(14n + 105 ) = 0,735 ⇒ n = 3 ⇒ ankin là propin
+ Số mol CaCO3 : nCaCO3 = 0,12 mol ⇒ Số Ctb = 3 ⇒ hai chất còn lại là propan và propen.
B. Bài tập trắc nghiệm
Bài 1: Dẫn V lít (đktc) axetilen qua dung dịch AgNO3/NH3 dư thấy thu được 60 gam kết tủa. Giá trị V là:
A. 5,6 lit B. 11,2 lit C. 2,8 lit D. 10,11 lit
Lời giải:
Đáp án: A
n↓ = 60/240 = 0,25 mol ⇒ naxetilen = 0,25.22,4 = 5,6 lít
Bài 2: Dẫn 10,8 gam but-1-in qua dd AgNO3/NH3 dư, sau phản ứng thu x gam kết tủa. Giá trị của x là
A. 26,8g B. 16,1g C. 53,6g D. 32,2g
Lời giải:
Đáp án: D
nankin = 10,8/54 = 0,2 mol; n↓ = 0,2 mol ⇒ x = 0,2 .161 = 32,2 g
Bài 3: Dẫn 6,72 lít một ankin X qua dung dịch AgNO3/NH3 dư thấy thu được 44,1g kết tủa. CTPT của X là:
A. C2H2. B. C3H4. C. C5H8. D. C4H6.
Lời giải:
Đáp án: B
nX = 0,3 mol ⇒ Mkết tủa = 44,1/0,3 = 147 ⇒ ankin là C3H4.
Bài 4: Dẫn 11,2 lít hh khí X (gồm axetilen và propin) vào dd AgNO3/NH3 dư (các phản ứng xảy ra hoàn toàn), sau phản ứng thu được 92,1 gam kết tủa. % số mol của axetilen trong X là.
A.70% B. 30% C. 60% D. 40%
Lời giải:
Đáp án: D
gọi số mol của axetilen và propin lần lượt là: x và y mol; x + y = 0,5 mol; 240x + 147y = 92,1 ⇒ x = 0,2 và y = 0,3 ; %naxetilen = 0,2.100%/0,5 = 40%
Bài 5: Hỗn hợp X gồm propin và ankin A có tỉ lệ mol 1:1. Lấy 0,3 mol X tác dụng với dd AgNO3/NH3 dư thu được 46,2 gam kết tủa. Vậy A là:
A. Axetilen B. But-2-in. C. But-1-in. D. Pent-1-in.
Lời giải:
Đáp án: C
npropin = nA = 0,15 mol; m↓ = 0,15.147 + m↓A ⇒ m↓A = 46,2 – 22,05 = 22,05 ⇒ M↓ = 22,05/0,15 = 161 ⇒ ankin A là: C4H6 (but-1-in)
Bài 6: Một hỗn hợp gồm C2H2 và đồng đẳng A của axetilen có tỷ lệ mol 1:1. Chia hh thành 2 phần bằng nhau
+ Phần 1 tác dụng vừa đủ với 8,96 lít H2 (đktc) tạo hidrocacbon no.
+ Phần 2 tác dụng với 300ml dd AgNO3 1M/NH3 thu được 40,1g kết tủa. Tên gọi của A là:
A. pent-1-in B. Vinylaxetilen C. but-1-in D. propin
Lời giải:
Đáp án: C
nC2H2 = nA = x; 2x + 2x = 4x = 0,4 mol ⇒ x = 0,1 mol; m↓C2H2 = 0,1.240 = 24 gam ⇒ m↓A = 40,1 – 24 = 16,1 gam ⇒ M↓A = 16,1/0,1 = 161 ⇒ A là but-1-in
Bài 7: Cho 17,92 lít hỗn hợp X gồm 3 hiđrocacbon khí là ankan, anken và ankin lấy theo tỉ lệ mol 1:1:2 lội qua bình đựng dd AgNO3/NH3 lấy dư thu được 96 gam kết tủa và hỗn hợp khí Y còn lại. Đốt cháy hoàn toàn hỗn hợp Y thu được 13,44 lít CO2. Biết thể tích đo ở đktc. Khối lượng của X là
A. 19,2 gam. B. 1,92 gam. C. 3,84 gam. D. 38,4 gam.
Lời giải:
Đáp án: A
nX = 0,8 mol; nankan = nanken = 0,2 mol; nankin = 0,4 mol; M↓ankin = 96/0,4 = 240 ⇒ ankin là C2H2; nCO2 = 0,6 = 0,2n + 0,2m ⇒ n = 1 và m = 2 ⇒ ankan và ankin là: CH4 và C2H4
⇒ mX = 0,2.16 + 0,2.28 + 0,4.26 = 19,2 g
Bài 8: Đốt cháy hoàn toàn m gam ankin A bằng O2 vừa đủ thu được 22,4 lít CO2 (đktc). Mặt khác, dẫn m gam A qua dd AgNO3/NH3 dư thấy có 35 gam kết tủa màu vàng nhạt. CTPT của A là.
A. C7H12 B. C8H14 C. C5H8 D. C6H10
Lời giải:
Đáp án: C
CTPT ankin A: CnH2n-2 ; nA = 1/n; M↓A = 35n ⇒ n =5, M = 175 ⇒ A là C5H8