Tổng hợp Lý thuyết chương Dẫn xuất Halogen, Ancol, Phenol - Hoá học lớp 11
Tổng hợp Lý thuyết chương Dẫn xuất Halogen, Ancol, Phenol
Tài liệu Tổng hợp Lý thuyết chương Dẫn xuất Halogen, Ancol, Phenol Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về chương Dẫn xuất Halogen, Ancol, Phenol từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

- Lý thuyết Dẫn xuất halogen của hidrocacbon Xem chi tiết
- Lý thuyết Tính chất của Ancol Xem chi tiết
- Lý thuyết Tính chất của Phenol Xem chi tiết
- Lý thuyết Dẫn xuất halogen, ancol, phenol Xem chi tiết
Lý thuyết Dẫn xuất halogen của hidrocacbon
I. Khái niệm, phân loại, đồng phân, danh pháp
1. Khái niệm
Khi thay thế 1 hay nhiều nguyên tử hidro trong phân tử hidrocacbon bằng 1 hay nhiều nguyên tử halogen ta được dẫn xuất halogen.
2. Phân loại
- Dựa vào loại halogen có: dẫn xuất flo, dẫn xuất clo, dẫn xuất brom, dẫn xuất iot, dẫn xuất chứa đồng thời một vài halogen khác nhau.
- Dựa theo cấu tạo của gốc:
+ Dẫn xuất halogen no: CH2FCl, CH2-Cl-CH2Cl, CH3-CHBr-CH3, …
+ Dẫn xuất halogen không no: CF2=CF2, CH2=CH-Cl, CH2=CH-CH2Br, …
+ Dẫn xuất halogen thơm: C6H5F, C6H5CH2Cl, C6H5I, …
- Dựa theo bậc của cacbon: bậc của dẫn xuất halogen chính là bậc của nguyên tử C liên kết trực tiếp với nguyên tử halogen.
+ Dẫn xuất halogen bậc I: CH3CH2Cl (etyl clorua).
+ Dẫn xuất halogen bậc II: CH3CHClCH3 (isopropyl clorua).
+ Dẫn xuất halogen bậc III: (CH3)C-Br (tert - butyl bromua).
3. Đồng phân, danh pháp
a. Đồng phân: Dẫn xuất halogen có đồng phân mạch cacbon và đồng phân vị trí nhóm chức.
b. Danh pháp
- Tên thông thường:
CHCl3 (clorofom), CHBr3(bromofom) , CHI3 (iodofom).
- Tên gốc-chức
CH2=CH-Cl (vinyl clorua); CH2=CH-CH2-Cl (anlyl clorua); C6H5CH2Cl (benzyl clorua).
- Tên thay thế: coi các nguyên tử halogen là các nhóm thế.
CH2-Cl-CH2Cl (1,2-dicloetan); CHCl3 (triclometan).
II. Tính chất vật lý
- Ở điều kiện thường các dẫn xuất monohalogen có phân tử khối nhỏ như CH3Cl, CH3Br, C2H5Cl là chất khí. Các chất khác là chất lỏng, rắn, đều không màu.
- Không tan trong nước, dễ tan trong các dung môi hữu cơ.
- Nhiều dẫn xuất halogen có hoạt tính sinh học cao CHCl3 có tác dụng gây mê, C6H6Cl6 diệt sâu bọ.
III. Tính chất hóa học
1. Phản ứng thế nguyên tử halogen bằng nhóm –OH
- Các ankyl halogenua không phản ứng với nước nhưng bị thủy phân khi đun nóng với dung dịch kiềm tạo ancol:
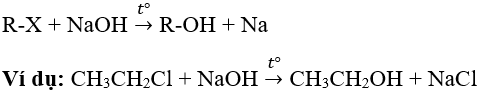
- Dẫn xuất loại anlyl halogenua bị thủy phân ngay khi đun sôi với nước:
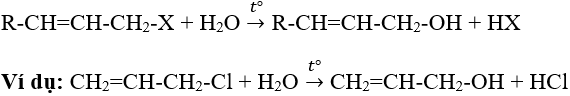
- Dẫn xuất loại vinyl halogenua và phenyl halogenua chỉ phản ứng với kiềm ở điều kiện nhiệt độ và áp suất cao:
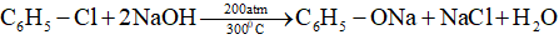
2. Phản ứng tách hidro halogenua
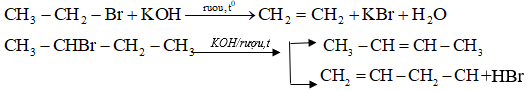
Quy tắc Zai-xép: Khi tách HX khỏi dẫn xuất halogen, nguyên tử halogen X ưu tiên tách ra cùng nguyên tử H ở cacbon bậc cao hơn bên cạnh tạo sản phẩm chính.
3. Phản ứng magie: tạo hợp chất cơ magie.
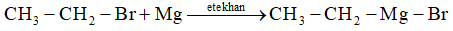
4. Một số phản ứng khác
a. Tác dụng với NH3
R-Cl + NH3 → R-NH2 + HCl
b. Tác dụng với Na
R-Cl + 2Na + R'-Cl → R-R' + 2NaCl
5. Với dẫn xuất halogen của hidrocacbon không no có 1 số phản ứng riêng
a. Phản ứng cộng và phản ứng trùng hợp
CH2=CH-CH2Cl + Cl2 → CH2Cl-CHCl-CH2Cl
b. Phản ứng trao đổi của nguyên tử halogen
Nguyên tử X linh động và dễ tham gia phản ứng trao đổi. Tức là dễ thủy phân khi có kiềm.
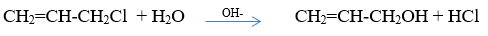
IV. Ứng dụng và điều chế
1. Ứng dụng
a. Làm dung môi
Metylen clorua, clorofom, cacbon tetraclorua, 1,2-đicloetan là những chất lỏng hòa tan được nhiều chất hữu cơ đồng thời chúng còn dễ bay hơi, dễ giải phóng khỏi hỗn hợp, vì thế được dùng làm dung môi để hòa tan hoặc để tinh chế các chất trong phòng thí nghiệm cũng như trong công nghiệp.
b. Làm nguyên liệu cho tổng hợp hữu cơ
- Các dẫn xuất halogen của etilen, của butađien được dùng làm monome để tổng hợp các polime quan trọng.
- Ví dụ:
CH2=CHCl tổng hợp ra PVC dùng chế tạo một số loại ống dẫn, vải giả da, ...
CF2=CF2 tổng hợp ra teflon, một polime siêu bền dùng làm những vật liệu chịu kiềm, chịu axit, chịu mài mòn, ...
Teflon bền với nhiệt tới trên 300oC nên được dùng làm lớp che phủ chống bám dính cho xoong, chảo, thùng chứa.
c. Các ứng dụng khác
- Dẫn xuất halogen thường là những hợp chất có hoạt tính sinh học rất đa dạng.
- Ví dụ: CHCl3,ClBrCH−CF3 được dùng làm chất gây mê trong phẫu thuật.
- Một số dẫn xuất halogen được dùng là thuốc trừ sâu, phòng bệnh cho cây trồng.
- CFCl3 và CF2Cl2 trước đây được dùng phổ biến trong các máy lạnh, hộp xịt ngày nay đang bị cấm sử dụng, do chúng gây tác hại cho tầng ozon.
2. Điều chế
- Phản ứng thế halogen vào hiđrocacbon no.
- Phản ứng cộng HX vào hiđrocacbon chưa no.
CH3-CH=CH2 + HBr → CH3-CHBr-CH3
- Phản ứng giữa HX và rượu (có H2SO4 đặc làm xúc tác)
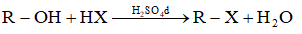
* Giới thiệu một số chất dẫn xuất hiđrocacbon
- CH2Cl-CH2Cl (đicloetan): là chất lỏng dùng để hòa tan nhựa, chất béo.
- CHCl3 (clorofom): là chất lỏng dùng làm dung môi, gây mê.
- CCl4 (tetraclo cacbon): là chất lỏng dùng làm dung môi hòa tan cao su, chất béo, dầu mỡ.
- CCl2F2 (Freon): là chất khí, không màu, không mùi, không cháy, không độc, dùng làm chất sinh hàn trong máy lạnh. Tuy vậy, nó có nhược điểm lớn nhất là phá hủy tầng ozon bảo vệ Trái Đất, cho nên người ta đang tìm cách hạn chế sản xuất và sử dụng nó.
Lý thuyết Tính chất của Ancol
I. Định nghĩa, phân loại, đồng phân và danh pháp
1. Định nghĩa
Ancol là những hợp chất hữu cơ mà phân tử có nhóm hidroxyl (OH) liên kết trực tiếp với nguyên tử cacbon no.
Công thức tổng quát của ancol: R(OH)n (n ≥ 1), với R là gốc hiđrocacbon.
- Công thức của ancol no mạch thẳng, đơn chức: CnH2n+1OH hay CnH2n+2O (với n ≥ 1).
2. Phân loại
- Gốc R có thể là mạch hở no hay chưa no hoặc mạch vòng.
Ví dụ: CH3-OH; CH2=CH-CH2-OH; C6H5-CH2-OH.
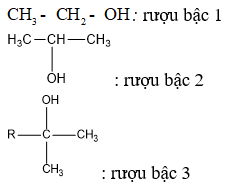
- Nhóm OH- có thể dính vào cacbon bậc 1, bậc 2, bậc 3 tạo thành ancol tương ứng bậc 1, bậc 2, bậc 3.
Lưu ý: Bậc của ancol bằng bậc của nguyên tử cacbon liên kết với nhóm OH.
Ví dụ:
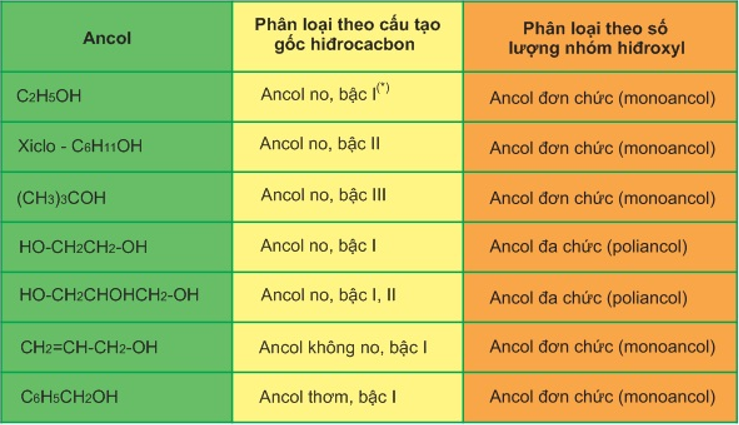
Bảng phân loại ancol
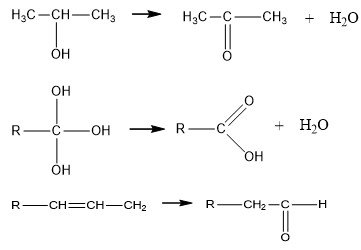
- Ancol không bền khi:
+ Nhiều nhóm –OH cùng đính vào một nguyên tử cacbon.
+ Nhóm –OH đính vào nguyên tử cacbon có nối đôi.
Ví dụ:
3. Đồng phân và danh pháp
a. Đồng phân
- Mạch cacbon khác nhau.
- Vị trí của các nhóm –OH khác nhau.
- Ngoài ra ancol đơn chức có đồng phân là ete: R-O-R’.
Ví dụ: Viết đồng phân của C3H8O.
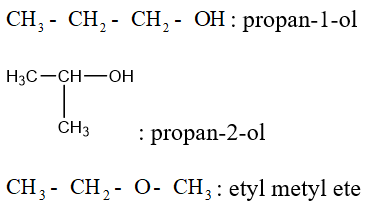
b. Danh pháp
- Tên thông thường: Tên ancol = tên gốc hiđrocacbon no tương ứng + ic.
Ví dụ:
CH3-CH2-OH: ancol etylic.
CH3-OH: ancol metylic.
- Tên thay thế: Tên ancol = tên gốc hiđrocacbon no tương ứng + ol.
Ví dụ:
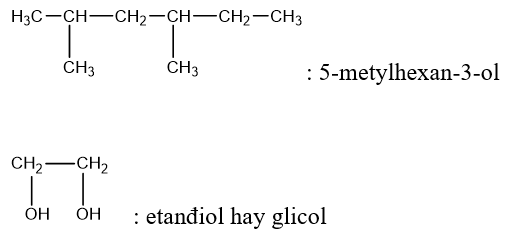
II. Tính chất vật lý
- Các ancol có nhiệt độ sôi cao hơn các hiđcacbon có cùng phân tử khối hoặc đồng phân ete của nó là do giữa các phân tử ancol có liên kết hiđro → Ảnh hưởng đến độ tan.
- Từ C1 đến C12 ancol ở thể lỏng (khối lượng riêng d < 1), từ C13 trở lên ở thể rắn.
- C1 đến C3 tan vô hạn trong nước vì có liên kiết H với nước.
- Độ rượu = (Vancol nguyên chất/Vdd ancol).100
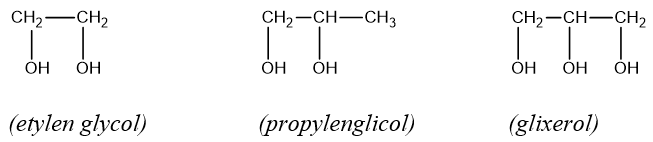
- Các poli như etylen glicol, glixerol thường sánh, nặng hơn nước và có vị ngọt.
III. Tính chất hóa học
1. Phản ứng thế nguyên tử hiđro của nhóm OH ancol (phản ứng đặc trưng của Ancol)
- Tính chất chung của ancol:
2ROH + Na → 2RONa + H2↑
- Tính chất đặc trưng của glixerol:
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + H2O
(ĐK: muốn tác dụng với Cu(OH)2 phải có 2 nhóm -OH trở lên liền kề nhau)
→ Phản ứng này dùng để phân biệt ancol đơn chức với ancol đa chức có 2 nhóm OH cạnh nhau trong phân tử.
2. Phản ứng thế nhóm OH
- Phản ứng với axit vô cơ:
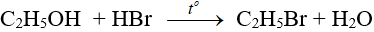
- Phản ứng tạo dien: dùng sản xuất cao su buna.
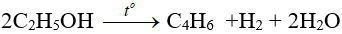
(ĐK: phải có xúc tác là Al2O3 + MgO hoặc ZnO/500ºC)
3. Phản ứng tách nước (phản ứng đêhidrat hoá)
Chú ý:
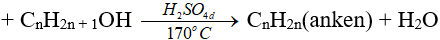
(ĐK n ≥ 2, theo quy tắc Zai-xép)
(ancol bậc càng cao thì càng dễ khử nước tạo anken)
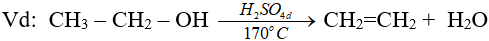
(phải là rượu no, đơn chức)
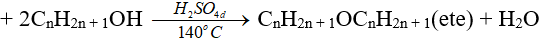
(ancol bậc càng thấp thì càng dễ khử nước tạo ete)
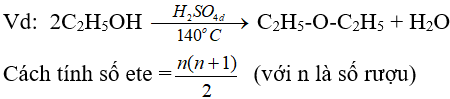
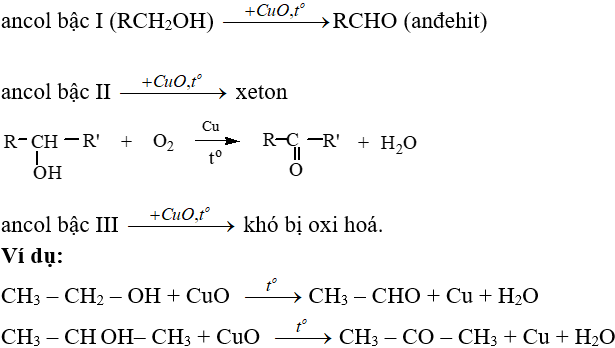
4. Phản ứng oxi hoá
- Phản ứng oxi hoá hoàn toàn:
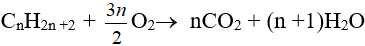
- Phản ứng oxi hoá không hoàn toàn:
IV. Ứng dụng và điều chế
1. Ứng dụng
2. Điều chế
a. Phương pháp tổng hợp
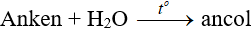
Ví dụ: Điều chế etanol từ etilen CH2=CH2 + H2O → CH3CH2OH
b. Phương pháp sinh hoá: từ tinh bột, đường, ...
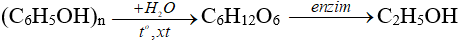
c. Điều chế metanol trong công nghiệp
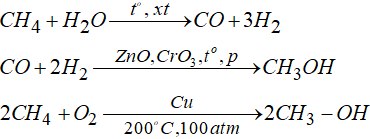
* Giới thiệu một số rượu
a. Rượu metylic (CH3OH)
- Là chất lỏng, không màu, nhẹ hơn nước, tan vô hạn trong nước, có mùi đặc trưng, nhiệt độ sôi 65oC.
- Rất độc: nếu uống phải dễ mù mắt, uống nhiều có thể gây tử vong.
- Dùng để điều chế anđehit fomic, tổng hợp chất dẻo, làm dung môi.
- Điều chế:
+ Tổng hợp trực tiếp:
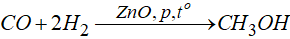
+ Bằng cách trưng gỗ.
b. Rượu etylic (C2H5OH)
- Là chất lỏng, nhẹ hơn nước, tan vô hạn trong nước, có mùi thơm, nhiệt độ sôi 78oC.
- Có ứng dụng rất lớn trong thực tế: để chế tạo cao su và một số chất tổng hợp khác như este, axit axetic, ete, … Để làm dung môi hòa tan vecni, dược phẩm, nước hoa.
c. Rượu butylic (C4H9OH)
- Có 4 đồng phân. Là những chất lỏng, ít tan trong nước hơn 3 chất đầu dãy đồng đẳng. Có mùi đặc trưng.
d. Rượu allylic (CH2=CH-CH2OH)
- Là chất lỏng không màu, mùi xốc, nhiệt độ sôi 97oC.
- Được dùng để sản xuất chất dẻo.
- Khi oxi hóa ở vị trí nối đôi tạo thành glixerol.
e. Một số rượu đa chức