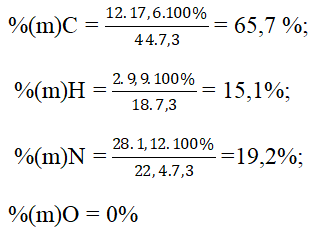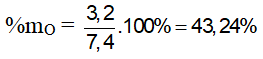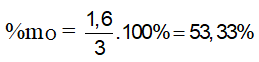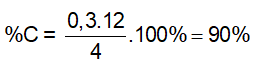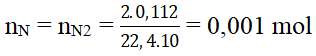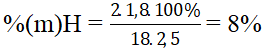Xác định hàm lượng nguyên tố trong hợp chất hữu cơ - Hoá học lớp 11
Xác định hàm lượng nguyên tố trong hợp chất hữu cơ
Với Xác định hàm lượng nguyên tố trong hợp chất hữu cơ Hoá học lớp 11 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Xác định hàm lượng nguyên tố trong hợp chất hữu cơ từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

A. Phương pháp giải & Ví dụ minh họa
Cho hợp chất hữu cơ có công thức CxHyOzNt khối lượng a gam
- Áp dụng các công thức tính sau:
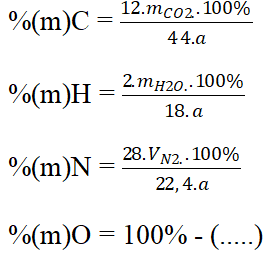
Ví dụ minh họa
Bài 1: Oxi hóa hoàn toàn 0,6 gam hợp chất hữu cơ A thu được 0,672 lit khí CO2 đktc và 0,72 gam H2O. Tính thành phần phần trăm khối lượng của các nguyên tố trong phân tử chất A?
Hướng dẫn:
Oxi hóa A thu được CO2 và H2O ⇒ hợp chất A có C, H có thể có O.
nCO2 = 0,672/22,4 = 0,03 mol; nH2O = 0,72/18 = 0,04 mol
⇒ nC = nCO2 = 0,03 mol; nH = 2nH2O = 0,08 mol;
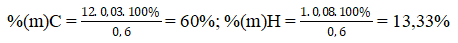
%(m)O = 100% - (60% + 13,33%) = 26,67%
Bài 2: Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm chảy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đụng dung dịch Ca(OH)2 dư, sau thí nghiệm, khối lượng bình (1) tăng 5,4 gam, ở bình (2) có 30 gam kết tủa. Thành phần phần trăm khối lượng oxi trong X là
Hướng dẫn:
nCO2 = nCaCO3 =30/100 = 0,3 mol; nH2O = 5,4/18 = 0,3 mol
mX = mC + mH + mO = 12nCO2 + 2nH2O + mO
⇒ 12.0,3 + 2.0,3 + mO = 7,4 ⇒ mO = 3,2 gam ⇒
Bài 3: Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ X ( C, H, O ). Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư. Sau thí nghiệm , thu được 10 gam kết tủa và khối lượng dung dịch giảm 3,8 gam so với dung dịch Ca(OH)2 ban đầu. Thành phần phần trăm khối lượng oxi trong X là
Hướng dẫn:
nCO2 = nCaCO3 = 10/100 = 0,1 mol
mgiảm = mCaCO3 - (mCO2 + mH2O) = 3,8g mCO2 + mH2O = 10-3,8 = 6,2g
mH2O = 6,2 – 0,1.44 = 1,8 (gam) ⇒ nH2O = 1,8/18 = 0,1 mol
mX = mC + mH + mO = 12nCO2 + 2nH2O + mO
12.0,1 + 2.0,1 + mO = 3 ⇒ mO = 1,6 gam ⇒
Bài 4: Đốt cháy hoàn toàn 4 gam hi đrocacbon X. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2. Sau thí nghiệm, thu được 25 gam kết tủa và khối lượng dung dịch giảm 8,2 gam so với dung dịch Ca(OH)2.ban đầu. Thành phần phần trăm khối lượng cacbon trong X là
Hướng dẫn:
mgiảm = mCaCO3 - (mCO2 + mH2O) = 8,2g mCO2 + mH2O = 25-8,2 = 16,8g
44nCO2 + 18nH2O = 16,8 (1)
mX = mC + mH = 12nCO2 + 2nH2O = 4 (2)
Từ (1), (2) ⇒ nCO2 = 0,3 mol; nH2O = 0,2 mol ⇒
Bài 5: Oxi hoá hoàn toàn 0,135 g HCHC A rồi cho sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH, thì thấy khối lượng bình 1 tăng lên 0,117 g, bình 2 tăng thêm 0,396 g. Ở thí nghiệm khác, khi nung 1,35 g hợp chất A với CuO thì thu được 112 ml (đktc) khí nitơ. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Hướng dẫn:
Khối lượng bình 1 tăng là khối lượng của H2O
⇒ nH = 2nH2O = 2.0,117/18 = 0,013 mol
Khối lượng bình 2 tăng là khối lượng của CO2
⇒ nC = nCO2 = 0,396/44 = 0,009 mol
Số mol N trong 0,135 gam hợp chất hữu cơ A là :
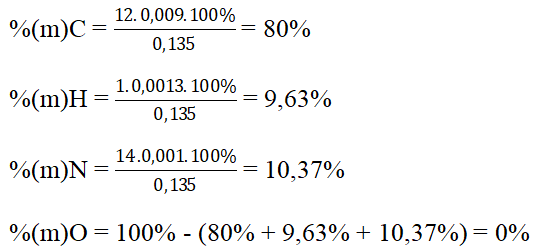
B. Bài tập trắc nghiệm
Bài 1: Nung một hợp chất hữu cơ X với lượng dư chất oxi hóa CuO, thấy thoát ra khí CO2, hơi nước và khí N2. Chọn kết luận đúng nhất.
A. X chắc chắn chứa C, H, N và có thể có oxi.
B. X là hợp chất chỉ chứa 3 nguyên tố C, H, N.
C. X luôn có chứa C, H và có thể không có N.
D. X là hợp chất chứa 4 nguyên tố C, H, N, O.
Lời giải:
Đáp án: A
Bài 2: Để đốt cháy hoàn toàn 2,50 g chất A phải dùng vừa hết 3,36 lít O2 (đktc). Sản phẩm cháy chỉ có CO2 và H2O, trong đó khối lượng CO2 hơn khối lượng H2O là 3,70 g. Phần trăm khối lượng của H trong A là :
A. 11,5%. B. 9%. C. 8% D. 7,8%
Lời giải:
Đáp án: C
mCO2 + mH2O = 2,5 + 0,15.32 = 7,3 gam ; mCO2 – mH2O = 3,7 ⇒ mCO2 = 5,5 gam và mH2O = 1,8 gam ⇒
Bài 3: Đốt cháy hoàn toàn m gam hợp chất hữu cơ X ( C, H, O ). Cần vừa đủ 7,84 lít O2 (đktc), thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Thành phần phần trăm khối lượng oxi trong X là
A. 16,62% B. 45,95% C. 28,85 % D. 43,24%.
Lời giải:
Đáp án: D
nCO2 = 6,72/22,4 = 0,3 mol; nH2O = 5,4/18 = 0,3 mol; nO2 = 7,84/22,4 = 0,35 mol
Theo bảo toàn khối lượng:
mX + mO2 = mCO2 + mH2O ⇒ mX = 0,3.44 + 5,4 – 0,35.32 = 7,4 (gam)
nO(X) + 2nO2 = 2nCO2 + nH2O ⇒ nO(X) = 2.0,3 + 0,3 - 2.0,35 = 0,2 mol
⇒ %mO = 43,24%

Bài 4: Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm chảy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đụng dung dịch KOH dư, sau thí nghiệm, khối lượng bình (1) tăng 7,2 gam, khối lượng bình (2) tăng 17,6 gam. Thành phần phần trăm khối lượng oxi trong X là
A. 36,36% B. 27,27% C. 40,91% D. 54,54%.
Lời giải:
Đáp án: A
Độ tăng khối lượng bình đựng H2SO4 chính là khối lượng H2O
Độ tăng khối lượng bình đựng dung dịch KOH chính là khối lượng CO2
nCO2 = 17,6/44 = 0,4 mol; nH2O = 7,2/18 = 0,4 mol
mX = mC + mH + mO = 12nCO2 + 2nH2O + mO
⇒ 12.0,4 + 2.0,4 + mO = 8,8 ⇒ mO = 3,2 gam ⇒ %mO =36,36%
Bài 5: Đốt cháy hoàn toàn 1,25g chất Y thu được 0,896 lít CO2 ở đktc và 0,54g H2O. Mặt khác đốt cháy Y cho sản phẩm tác dụng với dung dịch AgNO3 dư thu được 1,435g kết tủa trắng. Các nguyên tố có trong Y và phần trăm của C là:
A. C, H, O, Br; %(m)C = 42,6%. B. C, H, O, Cl; %(m)C = 38,4%
C. C, H, Cl; %(m)C = 38,4%. D. C, H, O, Br; %(m)C = 38,4%
Lời giải:
Đáp án: B
mO = 1,25 – (0,04.12 + 0,03.2 + 0,01.35,5) = 0,355 gam ⇒ các chất có trong Y là C, H, O, Cl; %(m)C = 0,04.12.100%/1,25 = 38,4%
Bài 6: Đốt cháy hoàn toàn m gam hợp chất hữu cơ X ( C, H, O ). Cần vừa đủ 6,72 lít O2 (đktc), thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Thành phần phần trăm khối lượng oxi trong X là
A. 34,78% B. 69,56% C. 76,19 % D. 67,71%
Lời giải:
Đáp án: A
nCO2 = 4,48/22,4 = 0,2 mol; nH2O = 5,4/18 = 0,3 mol; nO2 = 6,72/22,4 = 0,3 mol
Theo bảo toàn khối lượng:
mX = 0,2.44 + 5,4 – 0,3.32 = 4,6 (gam)
nO(X) + 2nO2 = 2nCO2 + nH2O ⇒ nO(X) = 2.0,2 + 0,3 - 2.0,3 = 0,1 mol
⇒ %mO = 34,78%
Bài 7: Đốt cháy chất A (chỉ chứa C và H) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng nước vôi dư. Thấy khối lượng bình 1 tăng 5,4g, bình 2 có 60g kết tủa. Phần trăm khối lượng của C và H trong A lần lượt là:
A. 78%, 22%. B. 92,3%, 7,7%. C. 80%, 20%. D. 78,4%, 21,6%
Lời giải:
Đáp án: B
mA = mC + mH = 0,6.12 + 0,3.2 = 7,8 gam ⇒ %(m)C = 7,2.100%/7,8 = 92,3% ⇒%(m)O = 7,75

Bài 8: Đốt cháy 7,3g chất A dẫn toàn bộ sản phẩm qua bình đựng nước vôi dư. Thấy có 1,12 lít khí N2 thoát ra, khối lượng bình tăng 27,5g và khối lượng kết tủa trong bình là 40g. Phần trăm của C, H, O, N lần lượt là:
A.65,7%, 15,1%; 19,2%, 0%. B. 56,4%, 10,4%, 13,1%, 20,1%
C. 69,7%, 9,6%; 20,7%, 0%. D. 59%, 16,4%, 16,5%, 8,2%
Lời giải:
Đáp án: A
mCO2 = 0,4.44 = 17,6 gam ⇒ mH2O = 27,5 – 17,6 = 9,9 gam;