Phản ứng oxi hóa Benzen và đồng đẳng - Hoá học lớp 11
Phản ứng oxi hóa Benzen và đồng đẳng
Với Phản ứng oxi hóa Benzen và đồng đẳng Hoá học lớp 11 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Phản ứng oxi hóa Benzen và đồng đẳng từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

A. Phương pháp giải & Ví dụ minh họa
- Oxi hóa hoàn toàn: CnH2n-6 + (3n-3)/2 O2 → n CO2 + (n-3)H2O
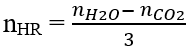
- Oxi hóa không hoàn toàn:
Benzen không làm mất màu dung dịch thuốc tím ở điều kiện thường và đun nóng.
Ankyl benzen không làm mất màu dung dịch thuốc tím ở điều kiện thường nhưng làm mất màu dung dịch thuốc khi đun nóng.
C6H5CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O
Ví dụ minh họa
Bài 1: Chất A là một đồng đẳng của benzen. Khi đốt cháy hoàn toàn 1,5 g chất A, người ta thu được 2,52 lít khí CO2 ( đktc).
a. Xác định CTPT.
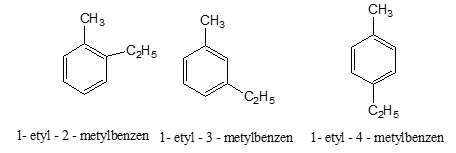
b. Viết các CTCT của A. Gọi tên.
c. Khi A tác dụng với Br2 có chất xúc tác Fe và nhiệt độ thì một nguyên tử H đính với vồng benzen bị thay thế bởi Br, tạo ra dẫn xuất monobrom duy nhất. Xác định CTCT của A.
Hướng dẫn:
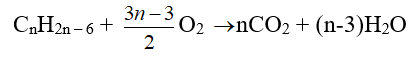
Cứ ( 14n -6)g A tạo ra n mol CO2
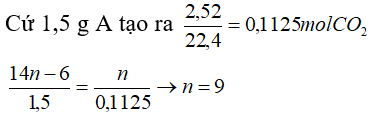
CTPT: C9H12
Các CTCT:
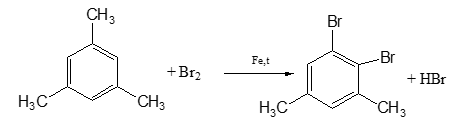
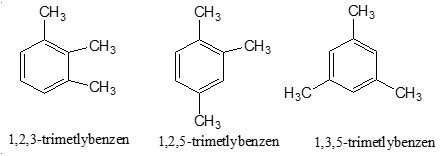
Bài 2: Đốt cháy hết 9,18 g 2 đồng đẳng của benzen A, B thu được 8,1 g H2O và CO2. Dẫn toàn bộ lượng CO2 vào 100ml dd NaOH 1M thu được m g muối. Giá trị của m và thành phần của muối:
Hướng dẫn:
mC = 9,18 – 0,45.2 = 8,28 gam; nCO2 = 0,69 mol; T = 0,1/0,69 = 0,14 ⇒ tạo muối NaHCO3
mNaHCO3 = 0,1. 84 = 8,4 g
Bài 3: Để oxi hoá hết 10,6 gam o-xylen (1,2-đimetylbenzen) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng. Giả sử dùng dư 20% so với lượng phản ứng.
Hướng dẫn:
no-Xilen = 10,6/ 106 = 0,1 mol ⇒ nKMnO4 pư = 0,1.2 = 0,2 mol; dùng dư 20% ⇒ nKMnO4 = 0,2.120/100 = 0,24 mol ⇒ V = 0,24/0,5 = 0,48 lít.

Bài 4: Đốt cháy hết 9,18 g 2 đồng đẳng của benzen A, B thu được H2O và 30,36 g CO2. Cộng thức phân tử của A và B lần lượt là:
A. C8H10; C9H14 B. C8H10; C9H12
C. C8H12; C9H14 D. C8H14; C9H16
Hướng dẫn:
nCO2 = 30,36/44 = 0,36 mol ⇒ nhh = 0,36/ntb ⇒ M = 306ntb/23 ⇒ ntb = 8,625 ⇒ CTPT A và B là: C8H10; C9H12
B. Bài tập trắc nghiệm
Bài 1: Đốt cháy hoàn toàn 9,2g một ankyl benzen A thu được 30,8g CO2. Công thức phân tử của A là:
A.C6H6 B. C8H10 C. C7H8 D. C9H12
Lời giải:
Đáp án: C
nCO2 = 0,7 mol; MA = 13,1n ⇒ n = 7
Bài 2: Đốt cháy 12,72 g A (CxHy) → 10,8g H2O. A có chứa 1 vòng benzen. Công thức phân tử của A là:
A. C3H4 B. C8H10 C. C9H12 D. C12H16
Lời giải:
Đáp án: C
nH2O = 0,6 mol; MA = (12,72.(n-3))/0,6 ⇒ n = 8
Bài 3: Đốt cháy hoàn toàn m g A đồng đẳng của benzen thu được 20,16 lít CO2 (đktc) và 10,8 ml H2O (lỏng). Công thức của A là:
A. C7H8 B. C8H10
C. C9H12 D. C10H14
Lời giải:
Đáp án: C
nCO2 = 20,16/22,4 = 0,9 mol; nH2O = 10,8/18 = 0,6 mol; 0,9/0,3 = n/(n-3) ⇒ n = 9
Bài 4: Đốt cháy hoàn toàn 0,1 mol CxHy thu được 15,68 lít CO2 (đktc) và 7,2 g H2O (lỏng). Công thức của CxHy là:
A. C7H8 B. C8H10 C. C10H14 D. C9H12
Lời giải:
Đáp án: A
nCO2 = 0,7 mol; nH2O = 0,4 mol; ⇒ x = 7; y = 8
Bài 5: Đốt cháy hết m gam 2 đồng đẳng của benzen A, B thu được 4,05 gam H2O và 7,728 lítCO2 (đktc). Giá trị của m và số tổng số mol của A, B là:
A. 4,59 và 0,04. B. 9,18 và 0,08. C. 4,59 và 0,08. D. 9,14 và 0,04.
Lời giải:
Đáp án: A
nCO2 = 7,728/ 22,4 = 0,345 mol; nH2O = 4,05/18 = 0,225 ⇒ m = mC + mH = 0,345.12 + 0,225.2 = 4,59 g; n = (0,345 – 0,225)/3 = 0,04 mol

Bài 6: Đốt cháy hoàn toàn ankybenzen X thu được 7,84 lít CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của X là
A.C6H6 B. C7H8 C. C8H8 D. C8H10
Lời giải:
Đáp án: B
Đặt CTPT X là CnH2n-6
3nX = nH2O - nCO2 = 0,35 – 0,2 = 0,15 mol → nX = 0,05 mol
→ 0,05n = 0,35 → n = 7 → CTPT C7H8
Bài 7: Đốt cháy hoàn toàn Hiđrocacbon X, thu đuộc CO2 và H2O có số mol theo tỉ lệ tương ứng 2 : 1. Mặt khác, 1 mol X tác dụng được tối đa với 4 mol H2 (Ni, t°) : 1 mol X tác dụng được tối đa 1 mol Br2. Công thức của X là.
A. C2H2 B. C4H4 C. C6H6 D. C8H8
Lời giải:
Đáp án: D
Bài 7. nC : nH = 2 : (1.2) = 1 : 1 → CTPT: CnHn
1 mol X + 4 mol H2 (Ni, to); 1 mol X + 1 mol Br2
→ X chứa vòng benzen + 1 liên kết đôi ở nhánh → k = 5
CTPT X: CnH2n+2-2k → 2n + 2 – 2k = n → k = 5; n = 8 → CTPT: C8H8
Bài 8: Đốt cháy hoàn toàn 5,3 gam ankybenzen X thu được 8,96 lít CO2 (đktc). Công thức phân tử của X là
A.C6H6 B. C7H8 C. C8H8 D. C8H10
Lời giải:
Đáp án: D
Đặt CTPT X là CnH2n-6 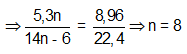
→ CTPT: C8H10

