Tổng hợp Lý thuyết chương Nhóm Cacbon, Silic - Hoá học lớp 11
Tổng hợp Lý thuyết chương Nhóm Cacbon, Silic
Tài liệu Tổng hợp Lý thuyết chương Nhóm Cacbon, Silic Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về chương Nhóm Cacbon, Silic từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

- Lý thuyết Tính chất của Cacbon Xem chi tiết
- Lý thuyết Hợp chất của Cacbon Xem chi tiết
- Lý thuyết Tính chất của Silic và hợp chất của Silic Xem chi tiết
- Lý thuyết Công nghiệp silicat Xem chi tiết
- Lý thuyết tính chất hóa học của cacbon, silic và hợp chất của chúng Xem chi tiết
Lý thuyết Tính chất của Cacbon
Cacbon
I. Vị trí cấu tạo và tính chất vật lý
1. Vị trí - Cấu hình electron nguyên tử
- Cacbon ở ô thứ 6, chu kỳ 2, nhóm IVA của bảng tuần hoàn.
- Cấu hình e: 1s22s22p2. C có 4 electron lớp ngoài cùng.
- Các số oxi hóa của C là: -4, 0, +2, +4.
2. Tính chất vật lý
- C có ba dạng thù hình chính: Kim cương, than chì và fuleren.
- Kim cương là chất tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém. Kim cương có cấu trúc tinh thể nguyên tử và cứng nhất trong tất cả các chất.
- Than chì là tinh thể màu xám đen, có ánh kim, dẫn điện tốt nhưng kém kim loại. Tinh thể than chì có cấu trúc lớp.
II. Tính chất hóa học
- Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
- Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
a. Tính khử
- Tác dụng với oxi
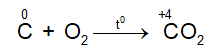
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
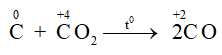
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
b. Tính oxi hóa
- Tác dụng với hidro
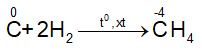
- Tác dụng với kim loại
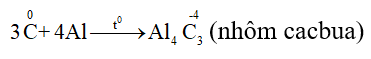
III. Trạng thái tự nhiên
- Kim cương và than chì là cacbon ở dạng tự do gần như tinh khiết.
- Cacbon còn có trong các khoáng vật như canxit (đá vôi, đá hoa, đá phấn đều chứa CaCO3), magiezit (MgCO3), đolomit (CaCO3.MgCO3). Dầu mỏ, khí thiên nhiên là hỗn hợp của các chất khác nhau chứa cacbon. Cơ thể động thực vật cũng chứa nhiều hợp chất của cacbon.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Kim cương được dùng làm đồ trang sức. Trong kĩ thuật, kim cương được dùng làm mũi khoan, dao cắt thuỷ tinh, bột mài.
- Than chì được dùng làm điện cực; làm nồi, chén để nấu chảy các hợp kim chịu nhiệt; chế tạo chất bôi trơn; làm bút chì đen.
- Than cốc được dùng làm chất khử trong luyện kim để luyện kim loại từ quặng.
- Than gỗ được dùng để chế thuốc nổ đen, thuốc pháo, chất hấp phụ.
- Than muội được dùng làm chất độn khi lưu hoá cao su, để sản xuất mực in, xi đánh giày.
2. Điều chế
- Kim cương nhân tạo được điều chế bằng cách nung than chì ở 2000oC, p từ 50 - 100 nghìn atm, xúc tác là Fe, Cr, Ni.
- Than chì nhân tạo được điều chế bằng cách nung than cốc ở 2500 - 3000oC trong lò điện, không có không khí.
- Than cốc được điều chế bằng cách nung than mỡ khoảng 1000oC trong lò cốc, không có không khí.
- Than gỗ được tạo nên khi đốt cháy gỗ trong điều kiện thiếu không khí.
- Than muội được tạo nên khi nhiệt phân metan ở điều kiện nhiệt độ và xúc tác thích hợp.
- Than mỏ được khai thác trực tiếp từ các vỉa than nằm sâu dưới mặt đất.
Lý thuyết Hợp chất của Cacbon
A. Cacbon monooxit (CO)
I. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo của CO là C≡O (trong đó có 1 liên kết thuộc kiểu cho - nhận).
- CO là chất khí, không màu, không mùi, không vị, tan rất ít trong nước và rất bền với nhiệt.
- CO là khí độc vì nó kết hợp với hemoglobin ở trong máu tạo thành hợp chất bền làm cho hemoglobin mất tác dụng vận chuyển khí O2.
II. Tính chất hóa học
- Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường C rất trơ, chỉ hoạt động trong điều kiện nhiệt độ cao.
- CO là oxit trung tính không có khả năng tạo muối → không tác dụng với dung dịch bazơ và dung dịch axit ở nhiệt độ thường.
- CO là chất khử mạnh.
+ Tác dụng với các phi kim:
2CO + O2 → 2CO2 (700ºC)
CO + Cl2 → COCl2 (photgen)
+ CO khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (phản ứng xảy ra ở nhiệt độ cao).
3CO + Fe2O3 → 3CO2 + 2Fe
CO + CuO → CO2 + Cu
III. Điều chế
- Trong công nghiệp: Khí CO được điều chế theo hai phương pháp:
+ Khí than ướt
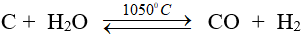
+ Khí lò gas
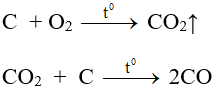
- Trong phòng thí nghiệm:
HCOOH → CO + H2O (H2SO4 đặc, tº)
B. Cacbon đioxit (CO2)
I. Cấu tạo phân tử và tính chất vật lý
1. Cấu tạo phân tử
- Cấu tạo của CO2 là O=C=O.
2. Tính chất vật lý
- Là chất khí không màu, nặng gấp 1,5 lần không khí.
- Tan ít trong nước.
- CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
II. Tính chất hóa học
- Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
1. CO2 là oxit axit
- CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇋ H2CO3 (dd)
- CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 → CaCO3 (tº)
- CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
2. CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇋ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C
(Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
3. CO2 còn được dùng để sản xuất ure.
CO2 + 2NH3 → NH4O-CO-NH2 (amoni cacbamat)
NH4O-CO-NH2 → H2O + (NH2)2CO (180ºC; 200at)
III. Điều chế
- Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
- Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
- Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2 H2O
- Trong công nghiệp:
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
- Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
C. Axit Cacbonic và muối Cacbonat
I. Axit Cacbonic (H2CO3)
- Là axit kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân hủy thành CO2 và H2O.
- Là axit hai nấc, trong dung dịch phân li hai nấc.
H2CO3 ⇋ H+ + HCO3-
HCO3- ⇋ H+ + CO32-
II. Muối Cabonat
Là muối của axit cacbonic (gồm muối CO32- và HCO3-).
1. Tính tan
- Muối cacbonat của các kim loại kiềm, amoni và đa số muối hiđrocacbonat đều tan. Muối cacbonat của kim loại khác thì không tan.
2. Tính chất hóa học
- Tính chất hóa học chung của muối:
+ Tác dụng với axit → muối mới + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2↑ + H2O
HCO3- + H+ → CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
Chú ý:
Nếu cho H+ vào muối tan thì CO32- → HCO3- → H2O + CO2.
Nếu cho H+ vào muối không tan thì CO32- → CO2 + H2O.
+ Tác dụng với dung dịch kiềm → muối mới + bazơ mới.
NaHCO3 + NaOH → Na2CO3 + H2O
+ Tác dụng với muối → 2 muối mới.
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
+ Tác dụng với kim loại đứng trước kim loại tạo muối → muối mới + kim loại mới.
Cu(HCO3)2 + Mg → Mg(HCO3)2 + Cu
- Phản ứng thủy phân: Muối cacbonat của kim loại kiềm bị thủy phân mạnh tạo môi trường kiềm:
Na2CO3 → 2Na+ + CO32-
CO32- + H2O ⇋ HCO3- + OH-
→ Trong một số phản ứng trao đổi Na2CO3 đóng vai trò như 1 bazơ:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
Chú ý: Muối (NH4)2CO3 có môi trường trung tính.
- Phản ứng nhiệt phân:
+ Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân:
MgCO3 → MgO + CO2 (tº)
+ Tất cả các muối hiđrocacbonat đều bị nhiệt phân:
2NaHCO3 → Na2CO3 + CO2 + H2O
Ca(HCO3)2 → CaCO3 + H2O + CO2
3. Nhận biết
Cho tác dụng với axit → CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
4. Tính chất và ứng dụng của một số muối cacbonat
- Canxi cacbonat (CaCO3) tinh khiết là chất bột nhẹ, màu trắng, dùng làm chất dộn trong cao su và 1 số ngành công nghiệp.
- Natricacbonat (Na2CO3) khan (sođa khan) là chất bột màu trắng, tan nhiều trong nước. Dùng trong công ngiệp thủy tinh, đồ gốm, bột giặt, …
- Natri hidrocacbonat (NaHCO3) là chất tinh thể màu trắng, hơi ít tan trong nước. Dùng trong công nghiệp thực phẩm, trong y học dùng làm thuốc giảm đau dạ dày.
Lý thuyết Tính chất của Silic và hợp chất của Silic
A. Silic
I. Tính chất vật lý
- Silic có hai dạng thù hình: silic tinh thể và silic vô định hình.
II. Tính chất hóa học
- Silic có các số oxi hóa: -4, 0, +2 và +4 (số oxi hóa +2 ít đặc trưng hơn).
- Trong các phản ứng hóa học, silic vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
a. Tính khử
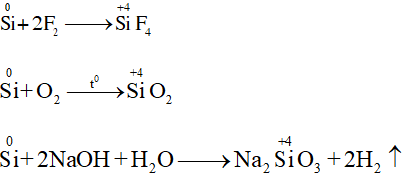
b. Tính oxi hóa
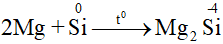
III. Trạng thái tự nhiên
- Silic là nguyên tố phổ biến thứ hai sau oxi, chiếm gần 29,5% khối lượng vỏ Trái Đất.
- Trong tự nhiên chỉ gặp silic dưới dạng các hợp chất, chủ yếu là cát (SiO2), các khoáng vật silicat và aluminosilicat như: cao lanh (Al2O3.2SiO2.2H2O), xecpentin (3MgO.2SiO2.2H2O), ...
- Silic còn có trong cơ thể động vật, thực vật với lượng nhỏ và có vai trò đáng kể trong hoạt động của thế giới hữu sinh.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Silic siêu tinh khiết là chất bán dẫn được dùng trong kĩ thuật vô tuyến và điện tử. Pin mặt trời chế tạo từ silic có khả năng chuyển năng lượng mặt trời thành điện năng, cung cấp cho các thiết bị trên tàu vũ trụ.
- Trong luyện kim, hợp kim ferosilic được dùng để chế tạo thép chịu axit.
2. Điều chế
- Khử SiO2 ở nhiệt độ cao.
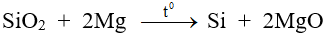
B. Hợp chất của Silic
I. Silic đioxit
- SiO2 là chất ở dạng tinh thể.
- Tan chậm trong dung dịch kiềm đặc nóng, tan dễ trong kiềm nóng chảy.
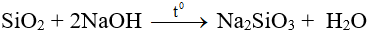
- Tan được trong axit HF.
SiO2 + 4HF → SiF4 + 2H2O
- Dựa vào tính chất này, người ta dùng dung dịch HF để khắc chữ lên thủy tinh.
II. Axit silixic
- H2SiO3 là chất ở dạng keo, không tan trong nước. Khi mất một phần nước tạo thành vật liệu xốp là silicagen. Dùng để hút hơi ẩm trong các thùng đựng hàng hóa.
- Axit silixic là axit yếu, yếu hơn cả axit cacbinic nên bị axit này đẩy ra khỏi dung dịch muối.
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3↓
III. Muối silicat
- Đa số các muối silicat đều không tan, chỉ có muối silicat của kim loại kiềm tan được trong nước.
- Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng.

