Tổng hợp Lý thuyết chương Anđehit, Xeton, Axit Cacboxylic - Hoá học lớp 11
Tổng hợp Lý thuyết chương Anđehit, Xeton, Axit Cacboxylic
Tài liệu Tổng hợp Lý thuyết chương Anđehit, Xeton, Axit Cacboxylic Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về chương Anđehit, Xeton, Axit Cacboxylic từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

- Lý thuyết Tính chất của Anđehit và xeton Xem chi tiết
- Lý thuyết Tính chất của Anđehit Xem chi tiết
- Lý thuyết Tính chất của Xeton Xem chi tiết
- Lý thuyết Tính chất của Axit cacboxylic Xem chi tiết
- Lý thuyết về Anđehit và xeton Xem chi tiết
Lý thuyết Tính chất của Anđehit và xeton
A. ANDEHIT
I. Định nghĩa, cấu trúc, phân loại, danh pháp
1. Đặc điểm cấu tạo, phân loại
a. Cấu tạo
– Công thức tổng quát của anđehit là: R(CHO)m (m ≥ 1).
R có thể là H hoặc gốc hiđrocacbon và đặc biệt có hợp chất CHO-CHO, trong đó m = 2, R không có.
– Công thức của anđehit no đơn chức, mạch thẳng:
CnH2n+1CHO (n ≥ 0)
– Trong phân tử anđehit có nhóm chức -CHO liên kết với gốc R có thể no hoặc không no.
b. Phân loại
- Dựa vào đặc điểm cấu tạo gốc hidrocacbon:
+ Anđehit no.
+ Anđehit không no.
+ Anđehit thơm.
- Dựa vào số nhóm –CHO:
+ Anđehit đơn chức.
+ Anđehit đa chức.

CH2=CH-CH=O propenal: Anđehit không no.
C6H5-CH=O benzanđehit: Anđehit thơm.
O=CH-CH=O anđehit oxalic: Anđehit đa chức.
2. Danh pháp
- Tên thay thế: Tên hiđrocacbon no tương ứng với mạch chính + al.
- Tên thông thường: anđehit + tên axit tương ứng.
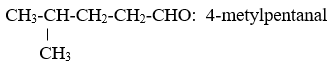
II. Tính chất vật lý
- Ở điều kiện thường, các anđehit đầu dãy là các chất khí và tan rất tốt trong nước. Các anđehit tiếp theo là các chất lỏng hoặc rắn, độ tan giảm khi phân tử khối tăng.
– Nhiệt độ sôi của anđehit thấp hơn của rượu tương ứng vì giữa các phân tử anđehit không có liên kết hidro.
- Dung dịch bão hòa của anđehit fomic (37 - 40%) được gọi là fomalin.
III. Tính chất hóa học
1. Phản ứng cộng
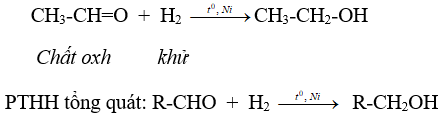
2. Phản ứng oxi hóa
a. Tác dụng với ion bạc trong dung dịch amoniac
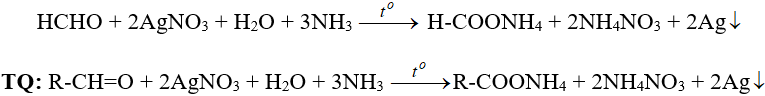
Phản ứng trên còn được gọi là phản ứng tráng bạc.
Hay:
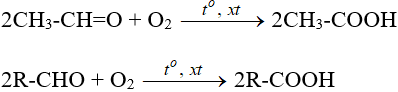
Nhận xét: Anđehit vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
b. Tác dụng với brom và kali pemanganat
Anđehit rất dễ bị oxi hoá, nó làm mất màu nước brom, dung dịch kali pemanganat và bị oxi hoá thành axit cacboxylic, thí dụ:
RCH=O + Br2 + H2O → R-COOH + 2HBr
* Chú ý: Đối với HCHO phản ứng xảy ra như sau:
HCH=O + 2Br2 + H2O → CO2 + 4HBr
3. Phản ứng ở gốc hidrocacbon
Nguyên tử hiđro ở bên cạnh nhóm cacbonyl để tham gia phản ứng.
Ví dụ:
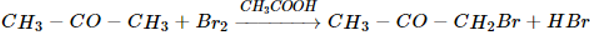
IV. Ứng dụng và điều chế
1. Điều chế
- Từ ancol: Oxi hóa ancol bậc I.
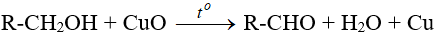
- Fomanđehit được điều chế trong công nghiệp bằng cách oxi hoá metanol nhờ oxi không khí ở 600ºC - 700ºC với xúc tác là Cu hoặc Ag:
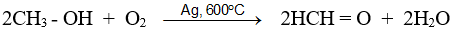
- Từ hiđrocacbon:
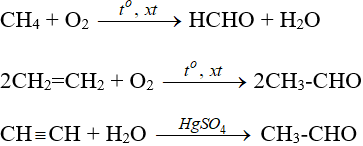
2. Ứng dụng
- Fomanđehit:
+ Fomanđehit được dùng chủ yếu để sản xuất poli(phenolfomanđehit) (làm chất dẻo) và còn được dùng trong tổng hợp phẩm nhuộm, dược phẩm.
+ Dung dịch 37- 40% fomanđehit trong nước gọi là fomalin (còn gọi là fomol) được dùng để ngâm xác động vật, thuộc da, tẩy uế, diệt trùng, ...
- Axetanđehit: Axetanđehit chủ yếu được dùng để sản xuất axit axetic.
B. XETON
I. Định nghĩa, cấu trúc, phân loại, danh pháp
1. Đặc điểm cấu tạo
Xeton là những hợp chất hữu cơ mà phân tử có nhóm C=O liên kết trực tiếp với hai nguyên tử cacbon.
Công thức tổng quát:
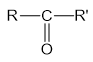
Trong đó R, R’ là gốc hiđrocacbon có thể giống hoặc khác nhau.
Ví dụ:

2. Danh pháp
Theo IUPAC, tên thay thế của xeton gồm tên của hiđrocacbon tương ứng ghép với đuôi on, mạch chính chứa nhóm >C=O, đánh số 1 từ đầu gần nhóm đó. Tên gốc - chức của xeton gồm tên hai gốc hiđrocacbon đính với nhóm >C=O và từ xeton. Ví dụ:
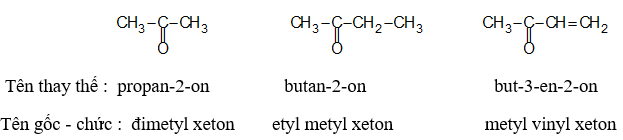
II. Tính chất vật lý
– Axeton là chất lỏng, các xeton khác là chất rắn, thường có mùi thơm.
– Axeton tan vô hạn trong nước, các xeton khác có độ tan giảm dần khi mạch cacbon tăng.
– Axeton dùng làm dung môi và nguyên liệu đầu để tổng hợp một số chất hữu cơ.
III. Tính chất hóa học
1. Cộng với hidro tạo rượu bậc 2
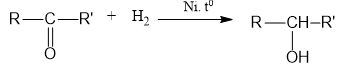
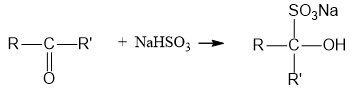
2. Cộng với bisunfit tạo kết tủa
3. Khó bị oxi hóa
Xeton không bị oxi hóa bởi dung dịch AgNO3/NH3 (không tráng gương) hoặc Cu(OH)2 nhưng có thể bị oxi hóa mạnh thì bị cắt mạch cacbon.
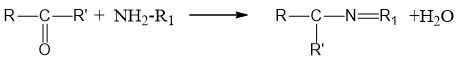
4. Tác dụng với amin
5. Phản ứng ở gốc hiđrocacbon
Nguyên tử hiđro ở bên cạnh nhóm cacbonyl dễ tham gia phản ứng.
Ví dụ:
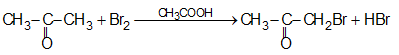
IV. Ứng dụng và điều chế
1. Điều chế
- Từ ancol: oxi hóa không hoàn toàn ancol bậc II.
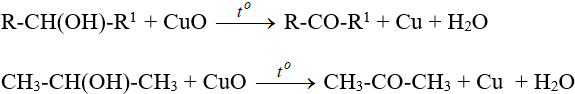
- Oxi hoá cumen rồi chế hoá với axit sunfuric thu được axeton cùng với phenol.
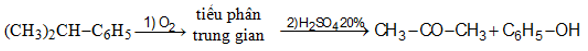
2. Ứng dụng
Axeton có khả năng hoà tan tốt nhiều chất hữu cơ và cũng dễ dàng được giải phóng ra khỏi các dung dịch đó (do ts thấp) nên được dùng làm dung môi trong sản xuất nhiều loại hoá chất, kể cả một số polime.
Axeton còn dùng làm chất đầu để tổng hợp ra nhiều chất hữu cơ quan trọng khác như clorofom, iođofom, bisphenol-A, ...
Lý thuyết Tính chất của Anđehit
1. Đặc điểm cấu tạo, phân loại
a/ Cấu tạo
– Công thức tổng quát của anđehit là: R(CHO)m (m ≥ 1)
R có thể là H hoặc gốc hiđrocacbon và đặc biệt có hợp chất CHO-CHO, trong đó m = 2, R không có.
– Công thức của anđehit no đơn chức, mạch thẳng:
CnH2n+1CHO (n ≥ 0)
– Trong phân tử anđehit có nhóm chức -CHO liên kết với gốc R có thể no hoặc không no.
b/ Phân loại:
- Dựa vào đặc điểm cấu tạo gốc hidrocacbon:
+ Anđehit no
+ Anđehit không no
+ Anđehit thơm
- Dựa vào số nhóm –CHO
+ Anđehit đơn chức
+ Anđehit đa chức

CH2=CH-CH=O propenal: Anđehit không no
C6H5-CH=O benzanđehit: Anđehit thơm
O=CH-CH=O anđehit oxalic: Anđehit đa chức
2. Danh pháp
- Tên thay thế: Tên hiđrocacbon no tương ứng với mạch chính + al
- Tên thông thường: anđehit + tên axit tương ứng.
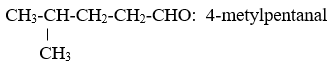
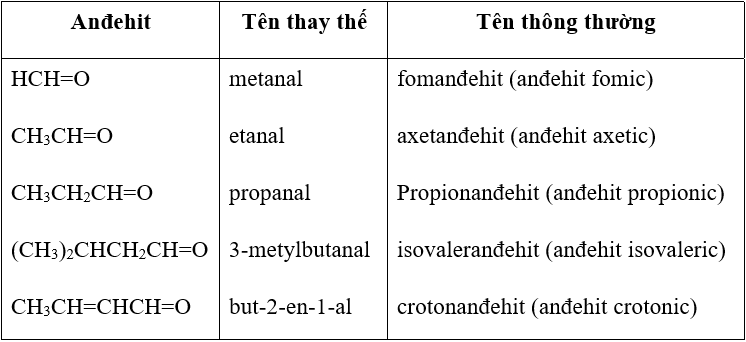
| Anđehit | Tên thay thế | Tên thông thường |
|
HCH=O CH3CH=O CH3CH2CH=O (CH3)2CHCH2CH=O CH3CH=CHCH=O |
metanal etanal propanal 3-metylbutanal but-2-en-1-al |
fomanđehit (anđehit fomic) axetanđehit (anđehit axetic) Propionanđehit (anđehit propionic) isovaleranđehit (anđehit isovaleric) crotonanđehit (anđehit crotonic) |
3. Tính chất vật lý
- Ở đk thường, các anđehit đầu dãy là các chất khí và tan rất tốt trong nước. Các anđehit tiếp theo là các chất lỏng hoặc rắn, độ tan giảm khi phân tử khối tăng.
– Nhiệt độ sôi của anđehit thấp hơn của rượu tương ứng vì giữa các phân tử anđehit không có liên kết hidro.
- Dung dịch bão hòa của anđehit fomic (37 - 40%) được gọi là fomalin.
4. Tính chất hóa học
a. Phản ứng cộng hiđro
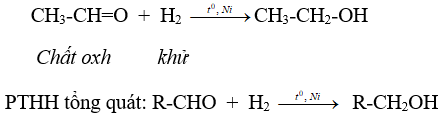
b. Phản ứng oxi hóa không hoàn toàn
HCHO + 2AgNO3 + H2O + 3NH3 −tº→ H-COONH4 + 2NH4NO3 + 2Ag
TQ: R-CH=O + 2AgNO3 + H2O + 3NH3 −tº→ R-COONH4 + 2NH4NO3 + 2Ag
Pư trên còn được gọi là pư tráng bạc.
Hay: 2CH3-CH=O + O2 −tº, xt→ 2CH3-COOH
2R-CHO + O2 −tº, xt→ 2R-COOH
Nhận xét: Anđehit vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
c. Tác dụng với brom và kali pemanganat
Anđehit rất dễ bị oxi hoá, nó làm mất màu nước brom, dung dịch kali pemanganat và bị oxi hoá thành axit cacboxylic, thí dụ :
RCH=O + Br2 + H2O → R-COOH + 2HBr
* Chú ý : Đối với HCHO phản ứng xảy ra như sau :
HCH=O + 2Br2 + H2O → CO2 + 4HBr
5. Điều chế, ứng dụng
a. Điều chế
- Từ ancol: Oxi hóa ancol bậc I.
R-CH2OH + CuO −tº→ R-CHO + H2O + Cu
- Fomanđehit được điều chế trong công nghiệp bằng cách oxi hoá metanol nhờ oxi không khí ở 600ºC - 700ºC với xúc tác là Cu hoặc Ag :
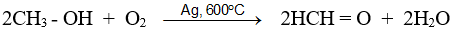
- Từ hiđrocacbon
CH4 + O2 −tº, xt→ HCHO + H2O
2CH2=CH2 + O2 −tº, xt→ 2CH3-CHO
CH CH + H2O −HgSO4→ CH3-CHO
b. Ứng dụng
- Fomanđehit :
Fomanđehit được dùng chủ yếu để sản xuất poli(phenolfomanđehit) (làm chất dẻo) và còn được dùng trong tổng hợp phẩm nhuộm, dược phẩm.
Dung dịch 37- 40% fomanđehit trong nước gọi là fomalin (còn gọi là fomol) được dùng để ngâm xác động vật, thuộc da, tẩy uế, diệt trùng...
- Axetanđehit : Axetanđehit chủ yếu được dùng để sản xuất axit axetic.

