100 câu trắc nghiệm Nitơ, Photpho có lời giải chi tiết (cơ bản) - Hoá học lớp 11
100 câu trắc nghiệm Nitơ, Photpho có lời giải chi tiết (cơ bản)
Với 100 câu trắc nghiệm Nitơ, Photpho có lời giải chi tiết (cơ bản) Hoá học lớp 11 tổng hợp 100 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nitơ, Photpho từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Bài 1: Cặp công thức đúng của magie nitrua và nhôm nitrua là:
A. Mg3N2 và AlN B. Mg2N và AlN3
C. MgN và Al3N D. Mg3N và Al2N3
Lời giải:
Hướng dẫn: Đáp án A
Các công thức đúng của magie nitrua và nhôm nitrua là Mg3N2 và AlN
Bài 2: Một oxit nitơ có tỉ khối hơi so với H2 là 54. Thành phần % khối lượng của oxi trong oxit đó là:
A. 46,67% B. 25,92% C. 74,074% D. 53,33%
Lời giải:
Hướng dẫn: Đáp án C
MNxOy= 54.2=108 →14x + 16y= 108
Biện luận:
x=1 →y=5,875 (loại)
x=2→y= 5
x=3→ y= 4,125
x=4→ y=3,25
x=5→ y=2,375
x=6→ y= 1,6
x=7→ y= 0,625
Vậy oxit nito là N2O5 có %O= 74,074%
Bài 3: Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính oxi hóa vừa tính khử khi tham gia phản ứng hóa học?
A. NH3, N2O5, N2, NO2 B. NH3, NO, HNO3, N2O5
C. N2, NO, NO2, N2O5 D. NO2, N2, NO, N2O3
Lời giải:
Hướng dẫn: Đáp án D
Nguyên tố nitơ có khả năng vừa thể hiện tính oxi hóa vừa tính khử khi có số oxi hóa trung gian.
Bài 4: Phần trăm khối lượng của N trong một oxit của nó là 30,43%.Tỉ khối của A so với He bằng 23. Xác định CTPT của oxit đó là:
A. N2O B. N2O4 C. N2O5 D. NO2
Lời giải:
Hướng dẫn: Đáp án D
Phân tử khối của A là 46. Gọi công thức của oxit là NxOy
Có %N/%O=14x/16y= 30,43/69,57
suy ra x/y= 1/2 → Công thức đơn giản nhất là NO2
Mà MA= 46→ A là NO2
Bài 5: Nguyên tố M tạo được hợp chất khí với hiđro có dạng MH3, trong đó H chiếm 17,64% khối lượng. Tính % khối lượng của nguyên tố M trong oxit cao nhất?
A. 25, 926% B. 36,842% C. 43,662% D. 53,36%
Lời giải:
Hướng dẫn: Đáp án A
%H= 3/ M+3= 17,64/100 → M= 14 → M là nguyên tố nitơ
→Công thức oxit cao nhất là N2O5 có %N=25,926%
Bài 6: R có oxit cao nhất là R2O5, trong hợp chất của R với hiđro có 17,64% khối lượng H. Nguyên tố R là:
A. S B. P C. N D. Cl
Lời giải:
Hướng dẫn: Đáp án C
R có oxit cao nhất là R2O5→ hợp chất của R với hiđro có dạng RH3
%H= 3/ M+3= 17,64/100 → M= 14 → M là nguyên tố nitơ
Bài 7: “Lúa chiêm lấp ló đầu bờ Hễ nghe tiếng sấm phất cờ mà lên” Hai câu trên mô tả cho phương trình hóa học nào sau đây?
A. N2 + O2→ 2NO B. 2NH3+ CO2→ (NH2)2CO + H2O
C. 2NO + O2 → 2NO2 D. (NH2)2CO + 2H2O→ (NH4)2CO3
Lời giải:
Hướng dẫn: Đáp án A
Bài 8: Trong các oxit của nito thì oxit được điều chế trực tiếp từ phản ứng của nitơ với oxi là:
A. NO2 B. NO C. N2O D. N2O5
Lời giải:
Hướng dẫn: Đáp án B
N2 + O2→ 2NO
Bài 9: Cho 2,64 gam kim loại tác dụng với N2 tạo nên 2,92 gam nitrua. Công thức của nitrua đó là:
A. Ba3N2 B. Sr3N2 C. AlN D. Đáp án khác
Lời giải:
Hướng dẫn: Đáp án B
mN2= 2,92-2,64=0,28 gam → nN2= 0,01 mol
6M + xN2 → 2M3Nx
nM= 6/x. nN2= 6/x. 0,01= 0,06/x (mol) → MM= 44.x
Ta thấy x=2, M=88 thì M là Sr thỏa mãn
→ Muối nitrua là Sr3N2
Bài 10: Đốt cháy hoàn toàn 6,2 gam P bằng oxi dư rồi cho sản phẩm vào 200 gam dung dịch NaOH 5%. Tính tổng khối lượng muối thu được?
A. 16,2 B. 25,1 C. 32,8 D. 29,6
Lời giải:
Hướng dẫn: Đáp án B
2P+ 5O2→ P2O5
nP= 0,2 mol; nNaOH=0,25 mol; nP2O5= 0,1 mol
Có nNaOH/ nP2O5= 2,5→ Sản phẩm tạo thành sau phản ứng là NaH2PO4 và Na2HPO4
P2O5+ 2NaOH+ H2O → 2NaH2PO4
x 2x 2x mol
P2O5+ 4NaOH → 2Na2HPO4+ H2O
y 4y 2y mol
Ta có x+y= 0,1; 2x+ 4y= 0,25
→x= 0,075; y= 0,025→ mmuối= 2x.120+ 2y.142=25,1 gam
Bài 11: Khí nitơ có thể được tạo thành bằng phản ứng hóa học nào sau đây?
A. Đốt cháy NH3 trong oxi khi có mặt chất xúc tác Pt
B. Nhiệt phân NH4NO3
C. Nhiệt phân AgNO3
D. Nhiệt phân NH4NO2
Lời giải:
Hướng dẫn: Đáp án D
NH4NO2→ N2+ 2H2O
Bài 12: Người ta sản xuất khí nitơ trong công nghiệp bằng cách nào đây?
A. Chưng cất phân đoạn không khí lỏng
B. Nhiệt phân NH4NO3
C. Dùng phương pháp dời nước
D. Nhiệt phân HNO3
Lời giải:
Hướng dẫn: Đáp án A
Chưng cất phân đoạn không khí lỏng ở -196oC thu được N2.
Bài 13: Để sản xuất nitơ trong công nghiệp, người ta chưng cất phân đoạn không khí lỏng. Phương pháp này có thể dùng sản xuất một khí khác, khí đó là:
A. O2 B. CO2 C. H2 D. N2
Lời giải:
Hướng dẫn: Đáp án A
Chưng cất phân đoạn không khí lỏng ở -196oC thu được N2, ở -1830C thu được khí O2.
Bài 14: Trộn 200 ml dung dịch Ca(H2PO4)2 1M với 200 ml dung dịch Ca(OH)2 1M. Khối lượng kết tủa thu được là:
A. 31 B. 45 C. 54,4 D. 54
Lời giải:
Hướng dẫn: Đáp án C
nH2PO4(2-)=0,4 mol; nOH-= 0,4 mol; nCa2+=0,4 mol
H2PO4-+ OH-→ HPO42-+ H2O
0,4 0,4 0,4
Ca2++ HPO42-→ CaHPO4
0,4 0,4 0,4
mCaHPO4= 0,4. 136= 54,4 gam
Bài 15: Người ta điều chế khí N2 từ phản ứng nhiệt phân muối amoni nitrit theo phương trình NH4NO2 → N2+ 2H2O. Biết khi nhiệt phân 32 gam muối thu được 10 gam chất rắn. Hiệu suất của phản ứng này là:
A. 6,67% B. 75,00% C. 68,75% D. 80%
Lời giải:
Hướng dẫn: Đáp án C
NH4NO2 → N2+ 2H2O
x x 2x mol
mchất rắn giảm= mN2+ mH2O= 28x + 2. 18x= 32-10= 22
→ x= 0,34375 mol → H= nNH4NO2 pứ/ nNH4NO2 ban đầu= x/0,5.100%= 68,75%
Bài 16: Cho dung dịch có chứa 0,25 mol KOH vào dung dịch có chứa 0,1 mol H3PO4. Muối thu được sau phản ứng là:
A. K2HPO4 và K3PO4 B. K2HPO4 và KH2PO4
C. K3PO4 và KH2PO4 D. KH2PO4 và K2HPO4 và K3PO4
Lời giải:
Hướng dẫn: Đáp án A
Ta có T= nKOH / nH3PO4 = 0,25/0,1=2,5 → Sản phẩm thu được có chứa K2 HPO4 và K3 PO4 .
Bài 17: Khí N2 tương đối trơ ở nhiệt độ thường là do:
A. Nitơ có bán kính nguyên tử nhỏ, phân tử không phân cực
B. Nguyên tử nitơ có độ âm điện lớn nhất trong nhóm nitơ
C. Trong phân tử N2, mỗi nguyên tử còn một cặp electron chưa tham gia liên kết
D. Trong phân tử N2 chứa liên kết 3 rất bền
Lời giải:
Hướng dẫn: Đáp án D
Bài 18: N2 phản ứng với O2 tạo thành NO ở điều kiện nào dưới đây?
A. điều kiện thường B. nhiệt độ cao khoảng 1000C C. nhiệt độ cao khoảng 10000C D. nhiệt độ khoảng 30000C
Lời giải:
Hướng dẫn: Đáp án D
N2 phản ứng với O2 tạo thành NO ở nhiệt độ khoảng 30000C.
Bài 19: Trộn 30 ml NO với 30 ml O2. Hỗn hợp sau phản ứng có thể tích (ở cùng điều kiện nhiệt độ, áp suất) là:
A. 60 ml B. 300 ml C. 45 ml D. 90 ml
Lời giải:
Hướng dẫn: Đáp án C
2 NO+ O2 → 2 NO2
30 30 30 ml
Hỗn hợp sau phản ứng có: 30 ml NO2; 15 ml O2 còn dư→ Tổng thể tích là 45 ml
Bài 20: Người ta điều chế khí N2 từ phản ứng nhiệt phân muối amoni đicromat theo phương trình (NH4)2Cr2O7 → Cr2O3+ N2+ 4H2O. Biết khi nhiệt phân 32 gam muối thu được 20 gam chất rắn. Hiệu suất của phản ứng này là:
A. 90% B. 94,5% C. 91% D. 80%
Lời giải:
Hướng dẫn: Đáp án B (NH4)2Cr2O7 → Cr2O3+ N2+ 4H2O x mol x x 4x mol mchất rắn giảm= mN2+ mH2O= 28x + 18.4x= 32-20 → x= 0,12 mol; n(NH4)2Cr2O7 ban đầu=8/63 mol H= npứ/ nban đầu. 100%= 94,5%
Bài 21: Trong phòng thí nghiệm để điều chế nito, người ta nhiệt phân NH4NO2, nhưng thực tế do chất này kém bền khó bảo quản nên người ta thường trộn hai dung dịch X và Y lại với nhau. Đó là:
A. NaNO2 và NH4Cl B. KNO2 và NH4NO3
C. NaNO2 và NH4NO3 D. KNO2 và NH4Cl
Lời giải:
Hướng dẫn: Đáp án A
NaNO2+ NH4Cl → N2+ 2H2O + NaCl
Bài 22: Nhiệt phân dung dịch hòa tan m gam hỗn hợp NH4Cl và NaNO2 có tỉ lệ số mol NH4Cl : NaNO2= 2:3 thu được 5,6 lít N2 (đktc). Giá trị của m là:
A. 22,4 gam B. 26,17 gam C. 78,5 gam D. 39,25 gam
Lời giải:
Hướng dẫn: Đáp án D
NaNO2 + NH4Cl → N2+ 2H2O + NaCl
3x 2x 2x= 0,25 mol
→ x= 0,125 mol→ m= 3x. 69+ 2x. 53,5= 39,25 gam

Bài 23: Nhiệt phân hoàn toàn 16 gam NH4NO2 trong bình kín dung tích 10 lít rồi đưa nhiệt độ bình về 1270C. Khi đó áp suất khí trong bình là:
A. 8,2 atm B. 0,82 atm C. 2,46 atm D. 1,64 atm
Lời giải:
Hướng dẫn: Đáp án C
NH4NO2 → N2+ 2H2O
0,25 0,25 0,5 mol
nhỗn hợp= 0,75 mol → P=nRT/V= 2,46 atm
Bài 24: Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm đựng dung dịch Al2(SO4)3. Hiện tượng quan sát được là:
A. Có kết tủa keo trắng xuất hiện, sau đó kết tủa lại tan tạo dung dịch trong suốt
B. Có kết tủa keo màu trắng xuất hiện
C. Có kết tủa màu xanh nhạt xuất hiện, sau đó kết tủa lại tan dần
D. Không có hiện tượng gì
Lời giải:
Hướng dẫn: Đáp án B
6NH3+ Al2(SO4)3+ 6H2O→ 2Al(OH)3+3 (NH4)2SO4
Hiện tượng: xuất hiện kết tủa trắng
Bài 25: Amoniac phản ứng được với nhóm chất nào sau đây trong điều kiện thích hợp?
A. O2, CuO, Cu(OH)2, HNO3, NH4HSO4
B. Cl2, CuO, Ca(OH)2, HNO3, Zn(OH)2
C. Cl2, O2, HNO3, AgNO3, AgI
D. Cl2, HCl, Zn(OH)2, Al(OH)3
Lời giải:
Hướng dẫn: Đáp án C
2NH3 + 3Cl2 →N2+ 6HCl
2NH3+ 3/2 O2→N2+3 H2O
2NH3+ AgNO3→ [Ag(NH3)2]NO3
2NH3+ AgI→ [Ag(NH3)2]I

Bài 26: Phát biểu nào sau đây không đúng?
A. NH3 là chất khí không màu, không mùi, tan nhiều trong nước
B. Dung dịch NH3 là một bazơ yếu
C. Phản ứng tổng hợp NH3 là phản ứng thuận nghịch
D. Đốt cháy NH3 không có xúc tác thu được N2 và H2O
Lời giải:
Hướng dẫn: Đáp án A
A. Sai vì NH3 là khí có mùi khai
B. Đúng
C. Đúng: N2+ 3H2 ⇄ 2NH3
D. Đúng: 2NH3+ 3/2 O2→N2+3 H2O
Bài 27: Không khí trong phòng thí nghiệm bị ô nhiễm bởi khí clo.Để khử độc, có thể xịt vào không khí dung dịch nào sau đây?
A. Dung dịch H2SO4 loãng B. Dung dịch NaCl
C. Dung dịch HCl D. Dung dịch NH3
Lời giải:
Hướng dẫn: Đáp án D
Vì khi đó xảy ra phản ứng: 2NH3 + 3Cl2 → N2 + 6HCl
Bài 28: Cho các phản ứng:
a)NH3+ HCl → NH4Cl
b) 4NH3+ 3O2 → 2 N2+ 6 H2O
c) 3NH3+ 3 H2O + AlBr3→ Al(OH)3+ 3NH4Br
d) NH3+ H2O ↔ NH4++ OH-
Nhận xét nào sau đây là đúng?
A. NH3 là bazơ trong phản ứng a, c, d và là chất khử trong phản ứng b
B. NH3 là bazơ trong phản ứng a, c, d và là chất oxi hóa trong phản ứng b
C. NH3 là bazơ trong phản ứng a, d và là chất khử trong phản ứng b, c
B. NH3 là axit trong phản ứng a, c, d và là chất khử trong phản ứng b
Lời giải:
Hướng dẫn: Đáp án A
NH3 là bazơ trong phản ứng a, c vì NH3 tác dụng với các chất có tính axit
NH3 là bazơ trong phản ứng d vì phản ứng sinh ra OH-
NH3 là chất khử trong phản ứng b vì số oxi hóa của N tăng từ -3 (trong NH3) lên 0 (trong N2)
Bài 29: Cho 2,13 gam P2O5 vào dung dịch có chứa 1,6 gam NaOH, thêm nước vào cho vừa đủ 400 ml. Tính CM của các muối trong dung dịch thu được?
A. 0,01 và 0,02 B. 0,025 và 0,05
C. 0,0375 và 0,0375 D. 0,015 và 0,015
Lời giải:
Hướng dẫn: Đáp án B
Ta có P2O5+ 3H2O→2H3PO4
nH3PO4= 2.nP2O5=0,03 mol, nNaOH=0,04 mol
Ta xét tỉ lệ T= nNaOH/ nH3PO4= 0,04/0,03= 1,333
→ 1 ⟨T ⟨2
→Khi H3PO4 tác dụng với NaOH xảy ra 2 phương trình sau :
H3PO4+ NaOH→ NaH2PO4+ H2O
x x x mol
H3PO4+ 2NaOH→ Na2HPO4+2 H2O
y 2y ymol
ta có: nH3PO4= x+ y= 0,03 ; nNaOH= x+2y= 0,04
Suy ra x= 0,02 ; y= 0,01
→CMNaH2PO4 = 0,02/0,4= 0,05M ; CM Na2HPO4= 0,01/0,4= 0,025M

Bài 30: Cho lượng khí NH3 đi từ từ qua ống sứ chứa 32 gam CuO nung nóng, thu được chất rắn A và 2,24 lít khí N2 (đktc). Chất rắn A phản ứng vừa đủ với V ml dung dịch HCl 1M. Giá trị của V là:
A. 180 B. 200 C. 100 D. 150
Lời giải:
Hướng dẫn: Đáp án B
Ta có : nCuO ban đầu= 0,4 mol ; nN2= 0,1 mol
2NH3+ 3CuO→ N2+ 3Cu + 3H2O (1)
CuO + 2HCl→ CuCl2+ H2O (2)
Theo PT (1) : nCuO pt1= 3.nN2= 0,3 mol
→n3CuO PT2= nCuO ban đầu- nCuO PT1= 0,1 mol
→nHCl= 2.nCuO PT2= 0,2 mol→ V= 0,2/1=0,2 lít= 200 ml
Bài 31: Dẫn V lít khí NH3 đi qua ống sứ đựng lượng dư bột CuO (m gam) nung nóng thu được (m-4,8) gam chất rắn X và V’ lít khí Y (đktc). Giá trị của V’ là:
A. 4,48 B. 2,24 C. 1,12 D. 3,36
Lời giải:
Hướng dẫn: Đáp án B
2NH3+ 3CuO →N2+ 3Cu + 3H2O (1)
2x 3x x 3x 3x mol
Theo ĐL bảo toàn khối lượng:
mNH3+ mCuO= mchất rắn X+ mN2+ mH2O
→17.2x+m=m-4,8+ 28x+18.3x → x= 0,1 mol→V’= VN2= 22,4.x= 2,24 lít
Bài 32: Cho vào bình kín thể tích không đổi 0,2 mol NO và 0,3 mol O2, áp suất trong bình là P1. Saukhi phản ứng hoàn toàn đưa bình về nhiệt độ ban đầu thì áp suất là P2. Tỉ lệ của P1 và P2 là:
A. P1= 1,25P2 B. P1= 0,8P2 C. P1=2P2 D. P1= P2
Lời giải:
Hướng dẫn: Đáp án A
2NO+ O2 → 2NO2
Tổng số mol khí trước phản ứng là n1= 0,2+ 0,3= 0,5 mol
Ta có 0,2/2 ⟨ 0,3/1 nên NO phản ứng hết và O2 còn dư
2NO+ O2 → 2NO2
Trước pứ 0,2 0,3 mol
Phản ứng 0,2 0,1 0,2 mol
Sau pứ 0 0,2 0,2 mol
Số mol khí sau phản ứng là n2= nO2+ nNO2= 0,4 mol
Do sau khi phản ứng đưa bình về nhiệt độ ban đầu nên tỉ lệ về áp suất chính là tỉ lệ về số mol.
Ta có P1/P2= n1/n2=0,5/0,4=1,25 → P1= 1,25P2
Bài 33: Hợp chất X có các đặc điểm sau:
(1)Là chất khí ở nhiệt độ thường, nhẹ hơn không khí
(2)Được thu bằng phương pháp đẩy không khí
(3)Bị hấp thụ bởi dung dịch HCl đặc tạo khói trắng
X là chất nào trong các chất sau?
A. NH3 B. N2 C. SO2 D. O2
Lời giải:
Hướng dẫn: Đáp án A
(1) NH3 là chất khí, có MNH3= 17 ⟨29 nên nhẹ hơn không khí
(2)NH3 nhẹ hơn không khí nên ta sẽ để úp ống nghiệm
(3) NH3+ HCl →NH4Cl
Bài 34: Có các so sánh NH3 với NH4+:
(1)Trong NH3 và NH4+, nitơ đều có số oxi hóa -3
(2) NH3 có tính bazơ, NH4+ có tính axit
(3) Phân tử NH3 và ion NH4+ đều chứa liên kết cộng hóa trị
(4) NH3 và NH4+ đều tan tốt trong nước
Số so sánh đúng là:
A. 2 B. 3 C. 4 D. 5
Lời giải:
Hướng dẫn: Đáp án C
(1)Trong NH3 và NH4+, nitơ đều có số oxi hóa -3: Đúng
(2) NH3 có tính bazơ, NH4+ có tính axit: Đúng
(3) Phân tử NH3 và ion NH4+ đều chứa liên kết cộng hóa trị: Đúng
(4) Trong NH3 và NH4+, nitơ đều có cộng hóa trị 3: Sai
Trong NH3, N có cộng hóa trị là 3, còn trong NH4+ có 4 liên kết cộng hóa trị
(5) NH3 và NH4+ đều tan tốt trong nước: Đúng
Vậy có 4 so sánh đúng
Bài 35: Hấp thụ V lít khí NH3 (đktc) vào dung dịch Al2(SO4)3 dư thu được m gam kết tủa. Đem nung m gam kết tủa này đến khối lượng không đổi thu được (m-1,08) gam chất rắn khan. Giá trị của m là:
A. 1,56 gam B. 6,24 gam C. 3,12 gam D. 0,78 gam
Lời giải:
Hướng dẫn: Đáp án C
6NH3+ Al2(SO4)3+ 6H2O→ 2Al(OH)3+3 (NH4)2SO4 (1)
2Al(OH)3→Al2O3+ 3H2O (2)
m gam kết tủa là Al(OH)3→ n3Al(OH)3= m/78 mol
Chất rắn thu được khi nung Al(OH)3 là Al2O3 → nAl2O3= (m-1,08)/102 mol
Ta có: nAl(OH)3= 2.nAl2O3 nên m/78= 2. (m-1,08)/ 102 suy ra m= 3,12 gam
Bài 36: Sục khí NH3 dư vào 200 ml dung dịch hỗn hợp chứa AlCl3 1M và CuCl2 0,5M sau khi phản ứng xảy ra hoàn toàn thu được kết tủa, lọc kết tủa đem nung nóng đến khối lượng không đổi thì thu được chất rắn có khối lượng là bao nhiêu?
A. 10,2 gam B. 20,4 gam C. 18,2 gam D. 28,4 gam
Lời giải:
Hướng dẫn: Đáp án A
3NH3+ AlCl3+ 3H2O→2Al(OH)3+3 NH4Cl (1)
2NH3+ CuCl2+ 2H2O→ Cu(OH)2+2 NH4Cl (2)
4NH3+ Cu(OH)2 → [Cu(NH3)4](OH)2 (3)
Do NH3 dư nên sau phản ứng chỉ thu được kết tủa Al(OH)3
2Al(OH)3Al2O3+ 3H2O (3)
Có: nAl(OH)3= nAlCl3= 0,2 mol → nAl2O3= 0,1 mol→mAl2O3= 0,1.102=10,2 gam
Bài 37: Dẫn 1,344 lít khí NH3 vào bình chứa 0,672 lít khí Cl2 (đktc). Khối lượng muối thu được sau phản ứng là:
A. 1,07 gam B. 2,14 gam C. 1,605 gam D. 3,21 gam
Lời giải:
Hướng dẫn: Đáp án B
Ta có nNH3= 0,06 mol; nCl2= 0,03 mol
2NH3+3 Cl2 →N2+ 6HCl (1)
Ban đầu 0,06 0,03
Phản ứng 0,02 0,03 0,06 mol
Sau pứ 0,04 0,06 mol
NH3 + HCl→ NH4Cl (2)
0,04 0,06 0,04 mol
Do 0,04 ⟨0,06 nên NH3 hết, còn HCl dư
Có nNH4Cl= nNH3= 0,04 mol→ mNH4Cl= 53,5.0,04= 2,14 gam
Bài 38: Cho lượng khí NH3 đi từ từ qua ống sứ chứa 3,2 gam CuO nung nóng, thu được chất rắn A và một khí B. Chất rắn A phản ứng vừa đủ với 20 ml dung dịch HCl 1M. Tính thể tích khí N2 (đktc) được tạo thành sau phản ứng:
A. 0,224 lít B. 0,448 lít C. 0,336 lít D. 0,112 lít
Lời giải:
Hướng dẫn: Đáp án A
Ta có : nCuO ban đầu= 0,04 mol ; nHCl= 0,02 mol
2NH3+ 3CuO →N2+ 3Cu + 3H2O (1)
CuO + 2HCl→ CuCl2+ H2O (2)
Theo PT (2) nCuO PT2= ½.nHCl= 0,01 mol
→nCuO PT 1= nCuO- nCuO PT2= 0,04-0,01=0,03 mol → nN2=1/3.n CuO PT3= 0,01 mol
→ VN2=0,224 lít
Bài 39: Dẫn 2,24 lít khí NH3 (đktc) đi qua ống sứ đựng 32 gam bột CuO nung nóng thu được chất rắn X và khí Y. Thể tích khí Y sinh ra là:
A. 2,24 B. 1,12 C. 3,36 D. 1,344
Lời giải:
Hướng dẫn: Đáp án B
Ta có : nCuO ban đầu= 0,4 mol ; nNH3= 0,1 mol
2NH3+ 3CuO→ N2+ 3Cu + 3H2O (1)
Có: 0,1/2 ⟨0,4/3 nên NH3 phản ứng hết, CuO dư
Theo PT (1) ta có : nN2= ½. nNH3= 0,05 mol → VNH3=1,12 lít
Bài 40: Hòa tan 14,2 gam P2O5 trong 250 g dung dịch H3PO4 9,8%. Nồng độ % của dung dịch axit H3PO4 thu được là:
A. 5,4 B. 14,7 C. 16,7 D. 17,6
Lời giải:
Hướng dẫn: Đáp án C
Ta có: nP2O5= 0,1 mol; mH3PO4 ban đầu= 250.9,8/100=24,5 gam
P2O5+ 3H2O→ 2H3PO4
0,1 0,2 mol
Tổng khối lượng H3PO4 là: 0,2.98+ 24,5=44,1 gam
Khối lượng dung dịch là: 14,2+ 250=264,2 gam

Bài 41: Dẫn khí X đi qua ống sứ đựng CuO nung nóng, thu được hỗn hợp khí và hơi Y. Cho Y lần lượt qua ống (1) đựng CuSO4 khan dư và ống 2 đựng nước vôi trong. Thấy ống 1 chất rắn chuyển từ màu trắng sang màu xanh và ống 2 thấy nước vôi trong không bị vẩn đục. Vậy khí X là:
A. CH4 B. H2S C. NH3 D. HCl
Lời giải:
Hướng dẫn: Đáp án C
2NH3+ 3CuO→ N2+ 3Cu + 3H2O (1)
X là NH3, Y chứa N2, H2O, có thể NH3 dư
-Cho Y qua ống (1) đựng CuSO4 khan:
CuSO4 khan+ 5H2O → CuSO4.5H2O
Trắng xanh
-Cho Y quaống 2 đựng nước vôi trong: không có phản ứng nên nước vôi không bị vẩn đục
Đáp án A không đúng vì nếu X là CH4 thì Y chứa CO2, H2O
Khi cho Y qua nước vôi trong thì nước vôi trong bị vẩn đục do :
CO2+ Ca(OH)2 → CaCO3+ H2O
Đáp án B không đúng vì khí H2S không tác dụng với CuO
Đáp án D không đúng vì khí HCl không tác dụng với CuO
Bài 42: Tính lượng quặng photphoric chứa 90% canxi photphat dùng để điều chế 6,2 kg photpho nếu hiệu suất các phản ứng đều là 80%?
A. 43,056 g B. 43,056 kg C. 34,444 g D. 34,444 kg
Lời giải:
Hướng dẫn:Đáp án A
Ta có sơ đồ phản ứng:
Ca3(PO4)2 → 2P
Theo sơ đồ : nCa3(PO4)2= ½. nP= ½. 6200/31=100 mol
→mCa3(PO4)2= 100. 310= 310 00 gam= 31 kg
Do hiệu suất đạt 80% nên mCa3(PO4)2 thực tế= 31.100/80=38,75 gam
→ mquặng= 38,75.100/90=43,056 kg
Bài 43: Cho khí NH3 dư đi từ từ vào dung dịch X (chứa hỗn hợp CuCl2, FeCl3, AlCl3) thu được kết tủa Y. Nung kết tủa Y ta được chất rắn Z, rồi cho luồng khí NH3 dư đi từ từ qua Z nung nóng thu được chất rắn R. Trong R chứa:
A. Cu, Al, Fe B. Al2O3 và Fe 2O3 C. Fe D. Al2O3 và Fe
Lời giải:
Hướng dẫn: Đáp án D
3NH3+ AlCl3+ 3H2O→ 2Al(OH)3+3 NH4Cl (1)
3NH3+ FeCl3+ 3H2O→ 2Fe(OH)3+3 NH4Cl (2)
2NH3+ CuCl2+ 2H2O→ Cu(OH)2+2 NH4Cl (3)
4NH3+ Cu(OH)2 → [Cu(NH3)4](OH)2 (4)
Do NH3 dư nên sau phản ứng chỉ thu được kết tủa Y gồm Al(OH)3 và Fe(OH)3
2Al(OH)3→Al2O3+ 3H2O (5)
2Fe(OH)3→Fe2O3+ 3H2O (6)
Chất rắn Z chứa Al2O3, Fe2O3
NH3 là chất khử chỉ khử được các oxit kim loại sau nhôm trong dãy hoạt động hóa học
2NH3+ Fe2O3→ N2+ 2Fe + 3H2O (1)
Vậy chất rắn R chứa Al2O3 và Fe
Bài 44: Cho 1,42 gam P2O5 tác dụng hoàn toàn với 50 ml dung dịch KOH 1M, thu được dung dịch X. Cô cạn dung dịch X thu được chất rắn khan gồm:
A. H3PO4 và KH2PO4 B. K3PO4 và KOH
C. KH2PO4 và K2HPO4 D. K2HPO4 và K3PO4
Lời giải:
Hướng dẫn: Đáp án D
Ta có P2O5+ 3H2O→2H3PO4
nH3PO4= 2.nP2O5=0,02 mol, nKOH=0,05 mol
Ta xét tỉ lệ T= nKOH/ nH3PO4= 0,05/0,02= 2,5
→ 2 ⟨T ⟨3
→Khi H3PO4 tác dụng với KOH xảy ra 2 phương trình sau :
H3PO4+ 2KOH→ K2HPO4+2 H2O
H3PO4+ 3KOH→ K3PO4+3 H2O
Cô cạn dung dịch X thu được K2HPO4 và K3PO4
Bài 45: Dẫn 1,344 lít khí NH3 vào bình chứa 0,672 lít khí Cl2 (đktc). Thành phần % thể tích của mỗi khí trong hỗn hợp khí sau phản ứng là:
A. 40%; 60% B. 20%, 80%
C. 30%, 70% D. 50%; 50%
Lời giải:
Hướng dẫn: Đáp án A
Ta có nNH3= 0,06 mol; nCl2= 0,03 mol
2NH3+3 Cl2 →N2+ 6HCl (1)
Ban đầu 0,06 0,03
Phản ứng 0,02 0,03 0,06 mol
Sau pứ 0,04 0,06 mol
Sau phản ứng thu được 0,04 mol NH3 và 0,06 mol HCl
→%VNH3= 40%; %VHCl= 60%
Bài 46: Cho dung dịch NH3 đến dư vào 20 ml dung dịch Al2(SO4)3. Để hòa tan hết kết tủa thu được sau phản ứng cần tối thiểu 10 ml dung dịch NaOH 2M. Nồng độ mol của dung dịch Al2(SO4)3 ban đầu là:
A. 0,6M B. 0,5M C. 0,4M D. 0,3M
Lời giải:
Hướng dẫn: Đáp án B 6NH3+ Al2(SO4)3+ 6H2O→ 2Al(OH)3+3 (NH4)2SO4 (1) NaOH + Al(OH)3 → NaAlO2+ H2O (2) Có nAl(OH)3= nNaOH= 0,01.2= 0,02 mol → nAl2(SO4)3= ½. nAl(OH)3= 0,01 mol → CM Al2(SO4)3= 0,01/ 0,02= 0,5M
Bài 47: Cho phản ứng tổng hợp ammoniac:
N2+ 3H2 ↔ 2 NH3
Khi giảm nồng độ NH3 (các yếu tố khác giữ nguyên) thì phản ứng sẽ chuyển dịch theo chiều nào?
A. thuận B. nghịch C. không thay đổi D. không xác định
Lời giải:
Hướng dẫn: Đáp án A
Theo nguyên lí chuyển dịch cân bằng khi giảm nồng độ NH3 thì cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó tức là chuyển dịch theo chiều thuận.
Bài 48: Trong 3 oxit: FeO, Fe2O3, Fe3O4 thì chất nào phản ứng với HNO3đặc nóng không tạo ra khí là:
A. Fe2O3 B. FeO và Fe3O3 C. Fe3O3 D. FeO
Lời giải:
Hướng dẫn: Đáp án A
Fe2O3+ 6 HNO3→ 2Fe(NO3)3+ 3H2O
FeO + 4HNO3 đặc nóng → Fe(NO3)3+ NO2↑+2 H2O
3Fe3O3 + 28HNO3đặc nóng → 9Fe(NO3)3+ NO2↑+ 14H2O
Bài 49: Cho V lít (đktc) hỗn hợp N2 và H2 có tỉ lệ mol 1:4 vào bình kín và đun nóng. Sau phản ứng thu được 1,5 mol NH3. Biết hiệu suất phản ứng là H= 25%. Giá trị của V là:
A. 42 lít B. 268,8 lít C. 336 lít D. 448 lít
Lời giải:
Hướng dẫn: Đáp án B
N2+ 3H2⇄ 2NH3
Do hiệu suất tính theo N2
Đặt số mol N ban đầu là x mol, n3= 4x mol;
Do hiệu suất phản ứng là 25% nên nN2 pứ= 25%.x= 0,25x mol
N2+3H2⇄ 2NH3
Ban đầu x 4x mol
Phản ứng 0,25x 0,75x 0,5x mol
Sau pứ 0,75 x 3,25x 0,5x mol
Sau phản ứng nNH3= 0,5x= 1,5 suy ra x=3 mol
→V= 22,4. (x+3x)= 22,4.4.3=268,8 lít
Bài 50: Từ 10 m3 hỗn hợp N2 và H2 lấy theo tỉ lệ 1:3 về thể tích, biết hiệu suất phản ứng tổng hợp thực tế là 95%. Có thể sản xuất được lượng amoniac là:
A. 5 m3 B. 4,25 m3 C. 4,75 m3 D. 7,5 m3
Lời giải:
Hướng dẫn: Đáp án C
Ở cùng điều kiện tỉ lệ về số mol bằng tỉ lệ thể tích
Đặt VN2=x m3, VH2= 3x m3 → Vhh= x+ 3x= 10 m3 → x= 2,5
→ VN2=2,5 m3, VH2= 7,5 m3
Ta có VN2/1= VH2/3 nên hiệu suất tính theo N2 hoặc H2
VN2 pứ= VN2.95%= 2,375 m3
N2+ 3H2 ⇄2NH3
2,375 → 4,75 m3
Bài 51: Phải dùng bao nhiêu lít khí nitơ để điều chế 17 gam NH3 biết hiệu suất phản ứng là 25%, các thể tích đo ở đktc.
A. 44,8 lít B. 22,4 lít C. 1,12 lít D. 4,48 lít
Lời giải:
Hướng dẫn: Đáp án A
N2+ 3H2⇄ 2NH3
nNH3= 1mol
Theo PTHH: nN2 (PT)= ½.nNH3= 0,5 mol; nH2 (PT)= 3/2. nNH3=1,5 mol
Công thức tính hiệu suất:
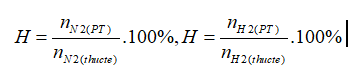
→nN2(thực tế)=2mol; nH2 (thực tế)= 6 mol
→VN2(thực tế)=44,8 lít;
Bài 52: Cho phản ứng: N2+ 3 H2 ↔ 2 NH3
Sau một thời gian, nồng độ các chất như sau: [N2]= 2,5 mol/l; [H2]= 1,5 mol/l; [NH3]= 2 mol/l. Nồng độ ban đầu của N2 và H2 lần lượt là:
A. 2,5M và 4,5 M B. 3,5 M và 2,5M
C. 1,5M và 3,5M D. 3,5M và 4,5M
Lời giải:
Hướng dẫn: Đáp án D
Nồng độ ban đầu của N2 và H2 lần lượt là: x, y mol/l
N2+ ⇄ 3H2 2NH3
Ban đầu x y mol/l
Phản ứng 1 3←2 mol/l
Sau pứ x-1 y-32 mol/l
Ta có: [N2]= 2,5 mol/l= x-1 nên x= 3,5M
[H2]= 1,5 mol/l= y-3 nên y=4,5M
Bài 53: Hiệu suất của phản ứng giữa N2 và H2 tạo thành sẽ tăng nếu:
A. giảm áp suất, tăng nhiệt độ B. giảm áp suất, giảm nhiệt độ
C. tăng áp suất, tăng nhiệt độ D. tăng áp suất, giảm nhiệt độ
Lời giải:
Hướng dẫn: Đáp án D
N2+ ⇄ 3H2 2NH3 ∆H ⟨0
Khi tăng áp suất cân bằng chuyển dịch theo chiều làm giảm số mol khí (tức là chiều thuận)
Phản ứng thuận có ∆H ⟨0 là phản ứng tỏa nhiệt
Nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thuận (tỏa nhiệt)
Vậy hiệu suất của phản ứng giữa N2 và H2 tạo thành sẽ tăng nếu: tăng áp suất và giảm nhiệt độ.
Bài 54: Tính số mol P2O5 cần thêm vào 0,3 lít dung dịch hỗn hợp KOH 1M và NaOH 1M để sau phản ứng thu được dung dịch chứa hai anion HPO42- và H2PO4- với số mol bằng nhau:
A. 0,1 B. 0,2 C. 0,3 D. 0,4
Lời giải:
Hướng dẫn: Đáp án B
P2O5+ 3H2O → 2 H3PO4 (1)
Tổng số mol OH- có trong dung dịch là 0,3.1+0,3.1= 0,6 mol
Đặt số mol HPO42- là x mol, số mol H2PO4- là x mol
OH-+ H3PO4 →H2PO4-+ H2O (2)
2OH-+ H3PO4 → HPO42-+ 2H2O (3)
Theo PT (2), (3) có nOH-= nH2PO4-+ 2nHPO4(2-)= x+ 2x= 3x (mol)= 0,6
Suy ra x= 0,2 mol→ nH3PO4 PT (2), (3)= x+ x= 0,4 mol
→nP2O5= ½. nH3PO4= 0,2 mol
Bài 55: Để làm khô khí amoniac có thể dùng hóa chất nào dưới đây?
A. H2SO4 đặc B. P2O5 khan C. CaO khan D. CuSO4 khan
Lời giải:
Hướng dẫn: Đáp án C
Để làm khô khí amoniac có thể dùng CaO khan vì CaO khan có khả năng hút ẩm nhưng không phản ứng với amoniac: CaO + H2O → Ca(OH)2
Không lựa chọn H2SO4 đặc vì: 2NH3+ H2SO4→ (NH4)2SO4
Không lựa chọn P2O5 vì: P2O5+ 3H2O → 2 H3PO4
Sau đó H3PO4 phản ứng với NH3 theo PT: 3NH3+ H3PO4→ (NH4)3PO4
Không lựa chọn CuSO4 khan vì:
2NH3+ CuSO4+ 2H2O→ Cu(OH)2+(NH4)2SO4
4NH3+ Cu(OH)2 → [Cu(NH3)4](OH)2
Chất được chọn để làm khô phải có khả năng hút nước và không phản ứng với chất cần làm khô.
Bài 56: Để điều chế 4 lít NH3 từ N2 và H2 với hiệu suất 50% thì thể tích H2 cần dùng ở điều kiện là bao nhiêu?
A. 4 lít B. 6 lít C. 8 lít D. 12 lít
Lời giải:
Hướng dẫn: Đáp án D
N2+ 3H2⇄ 2NH3
Theo PT VH2=3/2VNH3= 6 lít
Do hiệu suất 50% nên VH2 thực tế= 100. VH2/50= 100.6/50= 12 lít
Bài 57: Thể tích hỗn hợp N2 và H2 (đktc) cần lấy để điều chế 102 gam NH3 (H=25%) là:
A. 1075 lít B. 538 lít C. 1075,2 lít D. 537,6 lít
Lời giải:
Hướng dẫn: Đáp án C
N2+ 3H2⇄ 2NH3
Ta có nNH3=6mol
Theo PT : nN2= ½. nNH3= 3 mol, nH2= 3/2nNH3=9 mol
Do hiệu suất bằng 25% nên nN2 thực tế= nN2.100/25=12 mol
Ta có nH2 thực tế= nH2.100/25= 9.4= 36 mol
→Tổng nhỗn hợp= 12+ 36= 48 mol→ Vhỗn hợp= 48.22,4=1075,2 lít
Bài 58: Để điều chế 2 lít khí NH3 từ N2 và H2 với hiệu suất 25% thì cần bao nhiêu lít khí N2 ở cùng điều kiện?
A. 8 lít B. 2 lít C. 4 lít D. 1 lít
Lời giải:
Hướng dẫn:
N2+ 3H2⇄ 2NH3
Trong cùng điều kiện thì tỉ lệ thể tích bằng tỉ lệ số mol
Theo PT : VN2= ½. VNH3= 1 lít, VH2= 3/2. VNH3=3 lít
Do hiệu suất 25% nên VN2 thực tế= VN2.100/25= 4 lít
Bài 59: Đưa một hỗn hợp khí N2 và H2 có tỉ lệ 1:3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng:
A. 20%; 60%; 20% B. 22,22%; 66,67%; 11,11%
C. 30%; 60%; 10% D. 33,33%; 50%; 16,67%
Lời giải:
Hướng dẫn: Đáp án B
Chọn thể tích ban đầu của N2 là 1 lít, H2 là 3 lít → Thể tích ban đầu là 4 lít
→Thể tích khí giảm là Vkhí giảm= 1/10.Vban đầu= 1/10.4= 0,4 lít
→VNH3 sinh ra= Vban đầu- Vsau= Vkhí giảm= 0,4 lít
N2+ 3H2⇄ 2NH3
VN2 pứ= 1/2VNH3 sỉnh = 0,2 lít, VH2 pứ= 3/2.VNH3sinh= 0,6 lít
→VN2 dư= 0,8 lít, VH2 dư= 3-0,6= 2,4 lít
Tổng thể tích khí sau phản ứng là Vsau=9/10.Vban đầu= 0,9.4= 3,6 lít
→%VN2 dư= 0,8.100%/3,6=22,22%; %VH2 dư= 2,4.100%/3,6=66,67%
%VNH3=11,11%

Bài 60: Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là:
A. Có kết tủa trắng
B. Không có hiện tượng
C. Có khí mùi khai bay lên và có kết tủa trắng
D. Có khí mùi khai bay lên
Lời giải:
Hướng dẫn: Đáp án C
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
Bài 61: Có 4 dung dịch trong 4 lọ mất nhãn: amoni sunfat, amoni clorua, natri sunfat, natri hiđroxit. Nếu chỉ được phép dùng một thuốc thử để nhận biết 4 chất lỏng trên ta có thể dùng thuốc thử nào sau đây?
A. dung dịch AgNO3 B. dung dịch KOH
C. dung dịch BaCl2 D. dung dịch Ba(OH)2
Lời giải:
Hướng dẫn: Đáp án D
Khi cho dung dịch Ba(OH)2 vào 4 dung dịch:
-Nếu xuất hiện kết tủa trắng và có khí mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
-Nếu xuất hiện kết tủa trắng thì đó là Na2SO4
Na2SO4+ Ba(OH)2→ BaSO4↓ + 2 NaOH
-Nếu xuất hiện khí có mùi khai thì đó là NH4Cl
2NH4Cl+ Ba(OH)2→ BaCl2+ 2NH3↑ + 2H2O
-Còn lại không hiện tượng là NaOH
Bài 62: Đun nóng hỗn hợp rắn gồm 2 muối (NH4)2CO3 và NH4HCO3 thu được 13,44 lít khí NH3 và 11,2 lít khí CO2 (đktc). Thành phần % của NH4HCO3 là:
A. 23,3% B. 76,7% C. 75% D. 25%
Lời giải:
Hướng dẫn: Đáp án B
Đặt n(NH4)2CO3= xmol; nNH4HCO3= y mol
(NH4)2CO3→ 2NH3+ CO2+ 2H2O
x 2x x mol
NH4HCO3 →NH3+ CO2+ H2O
y y y mol
Ta có nNH3= 2x+y= 13,44/22,4= 0,6
nCO2= x+y= 11,2/22,4= 0,5
Suy ra x=0,1, y=0,4→ mchất rắn= 0,1.96+ 0,4.79=41,2 gam
→% của NH4HCO3 là: 0,4.79.100%/41,2=76,7%
Bài 63: Hòa tan hỗn hợp gồm 8,49 gam P và S vào lượng HNO3 vừa đủ thu được dung dịch X và sản phẩm khử duy nhất là NO2. Để trung hòa hoàn toàn X thì cần vừa đủ 0,69 mol NaOH. Số mol NO2 thu được là:
A. 1,47 mol B. 1,5 mol C. 1,28 mol D. 1,35 mol
Lời giải:
Hướng dẫn: Đáp án A
Đặt số mol P và S lần lượt là x, y mol → 31x+ 32y= 8,49 (1)
P+ 5HNO3→ H3PO4+ 5NO2+ H2O (1)
S+ 6HNO3→ H2SO4+ 6NO2+ 2H2O (2)
Dung dịch X chứa H3PO4 và H2SO4
H3PO4+ 3NaOH→ Na3PO4+ 3H2O(3)
H2SO4+ 2NaOH→ Na2SO4+ 2H2O (4)
Theeo PT (1) , (2), (3), (4)
Tổng số mol NaOH pứ ở (3), (4) là:
nNaOH= 3nH3PO4+ 2nH2SO4= 3.nP+ 2.nS= 3x+2y=0,69 (2)
Giải hệ gồm (1) và (2) có x=0,15; y= 0,12
Theo PTHH (1) và (2) : nNO2= 5nP+ 6nS= 5x+ 6y= 1,47 mol
Bài 64: Có 4 lọ chứa 4 dung dịch riêng biệt sau: 1. NH3; 2. FeSO4; 3. BaCl2; 4. HNO3. Các cặp dung dịch nào có thể phản ứng nhau:
A. 1 và 4; 2 và 3;2 và 4; 1 và 2
B. 1 và 3; 2 và 3; 3 và 4;1 và 2
C. 1 và 4;2 và 3; 3 và 4;1 và 2
D. 1 và 3; 1 và 4; 2 và 4; 1 và 2
Lời giải:
Hướng dẫn: Đáp án A
Các phương trình hóa học xảy ra là:
1 và 4 xảy ra PT: NH3+ HNO3→ NH4NO3
2 và 3xảy ra PT: FeSO4+ BaCl2 → BaSO4+ FeCl2
2 và 4xảy ra PT: 3Fe2++ 4H++ NO3-→ 3Fe3++ NO + 2H2O
1 và 2xảy ra PT: 2NH3+ FeSO4+ 2H2O→ Fe(OH)2+ (NH4)2SO4
Bài 65: Có 6 dung dịch đựng trong 6 lọ: NH4Cl; (NH4)2SO4; MgCl2; AlCl3; FeCl2; FeCl3. Chỉ dùng một hóa chất nào sau đây có thể giúp nhận biết chất nào trên?
A. Na dư B. dung dịch NaOH dư C. Ba dư D. dung dịch AgNO3
Lời giải:
Hướng dẫn: Đáp án C
Khi cho Ba vào các dung dịch trên thì Ba+ H2O →Ba(OH)2+ H2
Lấy dung dịch Ba(OH)2thu được ở trên cho vào 6 dung dịch:
-Nếu xuất hiện kết tủa trắng và có khí mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
-Nếu xuất hiện khí có mùi khai thì đó là NH4Cl
2NH4Cl+ Ba(OH)2→ BaCl2+ 2NH3↑ + 2H2O
-Nếu xuất hiện kết tủa trắng, không tan trong kiềm dư thì đó là MgCl2
Ba(OH)2+ MgCl2 → Mg(OH)2↓ + BaCl2
-Nếu xuất hiện kết tủa trắng, tan trong kiềm dư thì đó là AlCl3
3Ba(OH)2+ 2AlCl3 → 2Al(OH)3↓ + 3BaCl2
Ba(OH)2+ 2Al(OH)3 → Ba(AlO2)2+4 H2O
-Nếu xuất hiện kết tủa trắng xanh, không tan trong kiềm dư thì đó là FeCl2
Ba(OH)2+ FeCl2 → Fe(OH)2↓ + BaCl2
-Nếu xuất hiện kết tủa nâu đỏ, không tan trong kiềm dư thì đó là FeCl3
3Ba(OH)2+ 2FeCl3 → 2Fe(OH)3↓ + 3BaCl2
Bài 66: Cho 1,32 gam (NH4)2SO4 tác dụng với lượng dư dung dịch NaOH dư, đun nóng thu được một sản phẩm khí. Hấp thụ toàn bộ lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là:
A. (NH4)3PO4 B. NH4H2PO4
C. (NH4)2HPO4 D. NH4H2PO4 và (NH4)2HPO4
Lời giải:
Hướng dẫn: Đáp án C
(NH4)2SO4+ 2NaOH→ Na2SO4 + 2NH3↑ + 2H2O (1)
Theo PT (1): nNH3= 2. n(NH4)2SO4= 2.0,01=0,02 mol
Có: nH3PO4=0,04mol → T= nNH3/nH3PO4= 2 → Xảy ra PT sau:
2NH3+ H3PO4→ (NH4)2HPO4
Bài 67: Cho 6,16 lít khí NH3 và V ml dung dịch H3PO4 0,1M phản ứng hết với nhau được dung dịch X. X phản ứng được tối đa 300 ml dung dịch NaOH 1M. Khối lượng muối khan có trong X bằng:
A. 147,0 g B. 13,235 g C. 14,475 g D. 14,9 g
Lời giải:
Hướng dẫn:
n(NH3) = 6,16/22,4 = 0,275mol
n(NaOH) = 1.0,3 = 0,3mol
Dung dịch X phản ứng tối đa với NaOH nên muối thu được là muối Na3PO4
Theo ĐL bảo toàn nguyên tố:
n(H3PO4) = n(Na3PO4) = n(NaOH)/3 = 0,3/3 = 0,1mol
n(NH3)/n(H3PO4) = 0,275/0,1 = 2,75
2 ⟨ n(NH3)/n(H3PO4)⟨ 3 → cả 2 chất đều tham gia pư hết
Theo ĐL bảo toàn khối lượng, khối lượng muối thu được là:
m(muối) = m(NH3) + m(H3PO4) = 17.0,275 + 98.0,1 = 14,475g
Bài 68: Có những nhận định sau về muối amoni:
1)Tất cả muối amoni đều tan trong nước
2)Các muối amoni đều là chất điện li mạnh, trong nước muối amoni điện li hoàn toàn tạo ra ion NH4+ không màu, tạo môi trường bazơ
3)Muối amoni đều phản ứng với dung dịch kiềm giải phóng khí amoniac
4)Muối amoni kém bền đối với nhiệt
Nhóm gồm các nhận định đúng là:
A. 1, 2, 3 B. 1, 3,4 C. 2, 3,4 D. 1, 2, 4
Lời giải:
Hướng dẫn: Đáp án B
1)Đúng
2)Sai vì NH4+ tạo môi trường axit
3)Đúng
4)Đúng
Bài 69: Dãy các muối amoni nào khi bị nhiệt phân tạo thành khí NH3?
A. NH4Cl, NH4HCO3, (NH4)2CO3
B. NH4Cl, NH4NO3, NH4HCO3
C. NH4Cl, NH4NO3, NH4NO2
D. NH4NO3, NH4HCO3, (NH4)2CO3
Lời giải:
Hướng dẫn: Đáp án A
Đáp án A:
(NH4)2CO3→ 2NH3+ CO2+ 2H2O
NH4HCO3 →NH3+ CO2+ H2O
NH4Cl→ NH3+ HCl
Còn ở đáp án B: NH4NO3→N2O+ 2H2O (không tạo khí NH3)
Ở đáp án C: NH4NO2→N2+ 2H2O (không tạo khí NH3)
Ở đáp án D: NH4NO3→N2O+ 2H2O (không tạo khí NH3)
Bài 70:Cho sơ đồ phản ứng sau:
Khí X dung dịch X Y X Z T
Công thức của X, Y, Z, T tương ứng là:
A. NH3, (NH4)2SO4, N2, NH4NO3
B. NH3, (NH4)2SO4, N2, NH4NO2
C. NH3, (NH4)2SO4, NH4NO3, N2O
D. NH3, N2, NH4NO3, N2O
Lời giải:
Hướng dẫn: Đáp án C
Khí NH3+ H2O → dung dịch NH3
2NH3+ H2SO4→(NH4)2SO4 (Y)
(NH4)2SO4+ 2NaOH→ Na2SO4+ 2NH3 (X)+ H2O
NH3+ HNO3→ NH4NO3 (Z)
NH4NO3→N2O (T)+ 2H2O
Bài 71: Tính số mol P2O5 cần thêm vào dung dịch chứa 0,03 mol KOH để sau phản ứng thu được dung dịch chứa hai muối K2HPO4 và KH2PO4 với số mol bằng nhau:
A. 0,01 B. 0,02 C. 0,03 D. 0,04
Lời giải:
Hướng dẫn: Đáp án A
Ta có P2O5+ 3H2O→2H3PO4 (1)
H3PO4+ KOH→ KH2PO4+ H2O (2)
H3PO4+ 2KOH→ K2HPO4+2H2O (3)
Đặt số mol K2HPO4 và KH2PO4 đều là x mol
Theo PT (2), (3) : nKOH= nKH2PO4+ 2nK2HPO4=x+ 2x= 3x= 0,03
Suy ra x= 0,01 mol→ nH3PO4=nKH2PO4+ nK2HPO4= x+ x= 0,02 mol
→nP2O5= ½. nH3PO4= 0,01 mol
Bài 72: Cho sơ đồ:
X → Y→ Z→ T→ X
Các chất X, T (đều chứa nguyên tố C trong phân tử) có thể lần lượt là:
A. CO, NH4HCO3 B. CO2, NH4HCO3
C. CO2, Ca(HCO3)2 D. CO2, (NH4)2CO3
Lời giải:
Hướng dẫn: Đáp án A
CO2 (X) + 2NH3 → (NH2)2CO (Y) + H2O
(NH2)2CO +2 H2O → (NH4)2CO3 (Z)
(NH4)2CO3 → NH4HCO3 (T)+ NH3
NH4HCO3 →NH3+ CO2+ H2O
Vậy X là CO2 và T là NH4HCO3
Bài 73: Muối X là hợp chất chứa nguyên tố N. X có các phản ứng sau:
X+ NaOH→Y + Z+ A
X → T+ A
X không thể là chất nào dưới đây?
A. NH4NO3 B. NH4Cl C. NH4HCO3 D. (NH4)2HPO4
Lời giải:
Hướng dẫn: Đáp án C
-Ở đáp án A: NH4NO3 (X)+ NaOH →NaNO3(Y)+ NH3 (Z)+ H2O (A)
NH4NO3→N2O (T)+ 2H2O (A)
-Ở đáp án B: NH4Cl (X)+ NaOH →NaCl(Y)+ NH3 (A)+ H2O (Z)
NH4Cl→ NH3 (A)+ HCl (T)
-Ở đáp án C: NH4HCO3 (X)+ 2NaOH →Na2CO3(Y)+ NH3 (A)+ 2H2O (Z)
NH4HCO3→ NH3 (A)+ CO2+ H2O
PT thứ 2 tạo ra 3 sản phẩm trong khi đề chỉ cho tạo ra 2 sản phẩm → X không thể là NH4HCO3
-Ở đáp án D:(NH4)2HPO4(X)+ 3NaOH →Na3PO4(Y)+ 2NH3 (A)+ 3H2O (Z)
(NH4)2HPO4→2NH3 (A)+ H3PO4 (T)
Bài 74: Cho sơ đồ:
(NH4)2SO4→NH4Cl→ NH4NO3
Trong sơ đồ X, Y lần lượt là các chất:
A. CaCl2, HNO3 B. HCl, HNO3
C. BaCl2, AgNO3 D. HCl, AgNO3
Lời giải:
Hướng dẫn:Đáp án C
(NH4)2SO4+ BaCl2 (X) → BaSO4↓+ 2NH4Cl
NH4Cl+ AgNO3 (Y)→ AgCl↓ + NH4NO3
Đáp án A loại vì CaSO4 ít tan
Đáp án B loại vì HCl không phản ứng với (NH4)2SO4
Bài 75: Khi so sánh NH3 và NH4+, phát biểu nào sau đây không đúng?
A. Trong NH3 và NH4+, nitơ đều có số oxi hóa -3
B. Trong NH3 và NH4+, nitơ đều có cộng hóa trị 3
C. NH3 có tính bazơ, NH4+có tính axit
D. Phân tử NH3 và ion NH4+ đều có chứa liên kết cộng hóa trị
Lời giải:
Hướng dẫn: Đáp án B
Trong NH3 nitơ có cộng hóa trị 3 còn trong NH4+ thì N có cộng hóa trị là 4.
Bài 76: Trong phân tử HNO3, nguyên tử N có:
A. cộng hóa trị 4, số oxi hóa +4
B. cộng hóa trị 5, số oxi hóa +4
C. cộng hóa trị 4, số oxi hóa +5
D. cộng hóa trị 5, số oxi hóa +5
Lời giải:
Hướng dẫn: Đáp án C
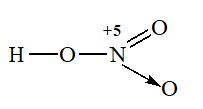
Vì xung quanh N có 4 liên kết nên N có cộng hóa trị là 4.

Bài 77: Axit nitric mới điều chế không màu, khi để lâu ngày:
A. dung dịch chuyển màu vàng do HNO3 bị phân hủy thành NO2
B. dung dịch chuyển màu vàng do HNO3 bị oxi hóa bởi oxi không khí
C. dung dịch chuyển màu nâu đỏ do HNO3 bị phân hủy thành NO2
D. dung dịch chuyển màu nâu đỏ do HNO3 bị oxi hóa bởi oxi không khí
Lời giải:
Hướng dẫn: Đáp án A
Axit nitric kém bền. Ngay ở điều kiện thường, khi có ánh sáng, dung dịch axit nitric đặc bị phân hủy một phần giải phóng khí nitơ đioxit. Khí này tan trong dd axit làm dd có màu vàng.
4HNO3→4 NO2+ O2+ 2H2O
Bài 78: Khi cho kim loại Mg tác dụng với HNO3, sau phản ứng không thấy xuất hiện khí. Tổng số hệ số của các chất (là các số nguyên tối giản) có trong phương trình khi cân bằng là:
A. 24 B. 22 C. 20 D. 29
Lời giải:
Hướng dẫn: Đáp án B
Khi cho kim loại Mg tác dụng với HNO3, sau phản ứng không thấy xuất hiện khí.
→ Sản phẩm khử là NH4NO3
PTHH:
4Mg+10 HNO3→ 4Mg(NO3)2+ NH4NO3+ 3H2O
→Tổng hệ số các chất là 22
Bài 79: Để điều chế 50 ml dung dịch HNO3 0,1M cần dùng một thể tích khí NH3 (đktc) là:
A. 224 ml B. 112 ml C. 560 ml D. 280 ml
Lời giải:
Hướng dẫn: Đáp án B
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2→ 4NO + 6H2O
2NO + O2→2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có: nNH3= nHNO3=0,05.0,1=5.10-3 mol
→ VNH3=0,112 lít=112 ml
Bài 80: Tính khối lượng dung dịch HNO3 60% điều chế được từ 112 000 lít khí NH3 (đktc). Giả thiết hiệu suất của cả quá trình là 80%?
A. 42 kg B. 525 kg C. 420 kg D. 52,5 kg
Lời giải:
Hướng dẫn: Đáp án C
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2→ 4NO + 6H2O
2NO + O2→2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có:
nHNO3=nNH3=112 000/22,4=5000 mol
→mHNO3=315 000 gam= 315 kg→ mddHNO3= 315.100/60=525 kg
Do hiệu suất bằng 80% nên mddHNO3 thực = mPT.80/100= 525.80/100=420 kg
Bài 81: Cho cacbon tác dụng với một lượng HNO3 đặc nóng vừa đủ. Sản phẩm là hỗn hợp khí X (gồm CO2 và NO2). Tỉ khối hơi của X so với H2 là:
A. 22,5 B. 22,8 C. 22,2 D. 22,75
Lời giải:
Hướng dẫn: Đáp án B
C+ 4HNO3 đặc nóng→ CO2+ 4NO2+ 2H2O
Đặt số mol CO2 là x mol → nNO2= 4x mol
→mhh= mCO2+ mNO2= 44x+ 46.4x=228 x mol
Và nhh= nCO2+ nNO2= x+ 4x= 5x mol
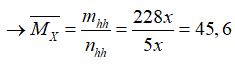
Bài 82: Cho phản ứng oxi hóa khử:
8R + 30 HNO3→ 8R(NO3)3+ 3 NxOy+ 15 H2O. Hỏi NxOy là chất nào dưới đây?
A. N2O B. N2O3 C. NO D. NO2
Lời giải:
Hướng dẫn:
Bảo toàn nguyên tố N ta có: 30 = 8.3+3x suy ra x=2
Bảo toàn nguyên tố O ta có: 30.3= 8.3.3+ 3y+15 suy ra y=1
→NxOy là N2O
Bài 83: Cho các phản ứng sau:
X (khí) + Y (khí)→ Z (khí)
Z + Cl2 → X + HCl
Z + HNO2→ T
T→ X+ 2H2O
X, Y, Z, T tương ứng với nhóm chất là:
A. N2, H2, NH3, NH4NO2 B. H2, N2, NH3, NH4NO3
C. N2, H2, NH4Cl, NH4NO3 D. N2O, H2, NH3, NH4NO3
Lời giải:
Hướng dẫn: Đáp án A
N2 (X)+ 3H2 (Y)⇄ 2NH3 (Z)
2NH3 (Z)+ 3Cl2 → N2 (X)+ 6HCl
NH3 (Z)+ HNO2→ NH4NO2 (T)
NH4NO2(T)→N2+ 2H2O
Bài 84: Trong phòng thí nghiệm, người ta cho kim loại Cu tác dụng với HNO3 đặc. Biện pháp xử lí để khí tạo thành khi thoát ra ngoài ít gây ô nhiễm môi trường nhất là:
A. nút ống nghiệm bằng bông khô
B. nút ống nghiệm bằng bông tẩm nước
C. nút ống nghiệm bằng bông tẩm dung dịch Ca(OH)2
D. nút ống nghiệm bằng bông tẩm cồn
Lời giải:
Hướng dẫn:Đáp án C
Khi cho Cu tác dụng với HNO3 đặc thì tạo thành khí NO2 độc
Để loại bỏ khí NO2 dùng bông tẩm dung dịch Ca(OH)2 để chuyển thành muối không độc
Cu+ 4HNO3→ Cu(NO3)2+ 2NO2+2 H2O
4NO2+2Ca(OH)2 → Ca(NO2)2+ Ca(NO3)2+ 2H2O
Bài 85: Cho a mol kim loại Mg phản ứng vừa đủ với dung dịch chứa b mol HNO3 thu được dung dịch chứa hai muối và không thấy khí thoát ra. Vậy a,b có mối quan hệ với nhau là:
A. 2a=5b B. 5a= 2b C. a=4b D. 4a= 3b
Lời giải:
Hướng dẫn:Đáp án B
Khi cho kim loại Mg tác dụng với HNO3, sau phản ứng không thấy xuất hiện khí.
→ Sản phẩm khử là NH4NO3
PTHH:
4Mg+10 HNO3→ 4Mg(NO3)2+ NH4NO3+ 3H2O
a b mol
Suy ra 10a= 4b → 5a=2b
Bài 86: Cho sơ đồ tổng hợp HNO3 như sau:
NH3→NO →NO2→HNO3
Biết hiệu suất mỗi phản ứng lần lượt là 60%; 50%; 80%.
Tính khối lượng HNO3 thu được nếu ban đầu dùng 44,8 lít khí NH3 (đktc)?
A. 30,24 gam B. 75,60 gam
C. 50,40 gam D. 15,12 gam
Lời giải:
Hướng dẫn: Đáp án A
Theo bảo toàn nguyên tố N ta có;
nHNO3= nNH3= 2 mol → mHNO3=126 gam
Do hiệu suất mỗi phản ứng lần lượt là 60%; 50%; 80% nên
mHNO3 thực tế thu được= 126. 60%.50%.80%= 30,24 gam
Bài 87: Hòa tan hoàn toàn 8,4 gam Fe vào dung dịch HNO3 đặc nóng dư thu được V lít khí NO2 duy nhất ở đkc. Giá trị của V là:
A. 11,2 lít B. 5,6 lít C. 3,36 lít D. 10,08 lít
Lời giải:
Hướng dẫn: Đáp án D
Fe+6 HNO3 đặc → Fe(NO3)3+ 3NO2+3 H2O
Ta có : nNO2= 3.nFe= 3. 8,4/56=0,45 mol → V=10,08 lít
Bài 88: Hòa tan hoàn toàn 12,0 gam hỗn hợp X gồm Fe và Cu vào dung dịch HNO3 dư thu được 11,2 lít (đktc) khí NO2 duy nhất. Xác định %khối lượng Fe trong hỗn hợp?
A. 46,67% B. 53,33% C. 40,45% D.59,55%
Lời giải:
Hướng dẫn: Đáp án A
Fe+6 HNO3 đặc → Fe(NO3)3+ 3NO2+3 H2O
Cu+ 4HNO3→ Cu(NO3)2+ 2NO2+2 H2O
Đặt nFe= xmol; nCu= y mol
Ta có mhhX= 56x+ 64y= 12,0
Số mol khí NO2 là nNO2= 3x+ 2y= 0,5 mol
Giải hệ có x= 0,1; y=0,1 → %mFe=46,67%
Bài 89: Để trung hòa hoàn toàn dung dịch thu được khi thủy phân 4,5375 gam một photpho trihalogenua cần 55 ml dung dịch NaOH 3M. Halogen là nguyên tố nào sau đây?
A. Flo B. Clo C. Brom D. Iot
Lời giải:
Hướng dẫn: Đáp án B
Đặt công thức của photpho trihalogenua là PX3
PX3+ 3H2O → 3HX+ H3PO3 (1)
Đặt số mol PX3 là x mol → nHX= 3x mol; nH3PO3=x mol
HX+ NaOH → NaX + H2O (2)
H3PO3+ 2NaOH → Na2HPO3+ 2H2O (3)
Theo PT (2) và (3) có nNaOH= nHX+ 2nH3PO3=3x+ 2x= 5x mol= 0,055.3
→ x=0,033 mol→ MPX3= m/n= 4,5375/ 0,033=137,5 → X=35,5 Nên X là Clo
Bài 90: Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3 dư thu được 6,72 lít (đktc) khí X gồm NO và NO2 có dX/H2= 19 và dung dịch Y (không chứa NH4+). Tính m ?
A. 5,6 gam B. 11,2 gam C. 16,8 gam D. 22,4 gam
Lời giải:
Hướng dẫn: Đáp án B
Đặt số mol NO là x mol; số mol NO2 là y mol
ta có nX= nNO+ nNO2= x+y= 6,72/22,4= 0,3 mol
mX= mNO+ mNO2= 30x+ 46y= 19.2.0,3 (gam)
Giải hệ trên ta được x= 0,15 và y= 0,15
QT cho e:
Fe → Fe3++ 3e
QT nhận e:
N+5+ 3e→ NO
0,45← 0,15
N+5+ 1e→ NO2
0,15← 0,15
→Tổng số mol e nhận= 0,45+ 0,15= 0,60 mol
Theo định luật bảo toàn electron: ne cho= ne nhận= 0,60 mol
→nFe= 0,60/3= 0,2 mol → mFe=11,2 gam
Bài 91: Hòa tan hoàn toàn hỗn hợp X gồm 0,11 mol Al và 0,15 mol Cu vào dung dịch HNO3 thì thu được 1,568 lít (đktc) hỗn hợp Y gồm 2 khí là NO và N2 và dung dịch Z chứa 2 muối. Số mol HNO3 đã tham gia phản ứng là:
A. 0,63 mol B. 0,70 mol C. 0,77 mol D. 0,76 mol
Lời giải:
Hướng dẫn: Đáp án D
QT cho e:
Al → Al3++ 3e
0,11→ 0,33
Cu → Cu2++ 2e
0,15→ 0,3
Tổng số mol e cho: ne cho= 0,33+ 0,3= 0,63 mol
nY= 0,07 mol
Đặt số mol khí NO là x mol. Khí N2 có số mol là y mol→ x+y= 0,07 (1)
QT nhận e:
NO3-+ 3e + 4H+→ NO + 2H2O (1)
3x← x mol
2NO3-+ 10e+ 12H+ →N2+ 6 H2O (2)
10y← y mol
Tổng số mol e nhận là 3x+10 y mol
Theo ĐL bảo toàn e: ne cho= ne nhận nên 3x+10y=0,63 (2)
Từ (1) và (2) ta có x= 0,01 và y= 0,06
Theo 2 bán phản ứng (1) và (2) ta có: nH+= 4x+ 12y=0,76 mol= nHNO3

Bài 92: P2O5 có tính chất hóa học là phản ứng được với:
1. Nước 2. Sắt 3. NaOH 4. dd AgNO3 5.HNO3
Cho biết tính chất nào đúng?
A. 1, 2, 5, 4 B. 1, 2, 3
C. 1, 3, 5 D. 1, 3, 4
Lời giải:
Hướng dẫn: Đáp án D
1) P2O5+ 3H2O→ 2 H3PO4
3) P2O5+ 3H2O→ 2 H3PO4
H3PO4+ NaOH → NaH2PO4+ H2O
H3PO4+ 2NaOH → Na2HPO4+ 2H2O
H3PO4+ 3NaOH → Na3PO4+ 3H2O
4) P2O5+ 3H2O→ 2 H3PO4
3AgNO3+ H3PO4→ Ag3PO4+ 3HNO3
Bài 93: Axit H3PO4 không phản ứng được với:
1. H2O 2. NaOH 3. HCl 4. NaCl 5. Cu(OH)2
A. 1, 2, 3 B. 2, 3, 4 C. 1, 2, 4 D. 1, 3, 4
Lời giải:
Hướng dẫn: Đáp án D
Axit H3PO4 không phản ứng được với: H2O, HCl, NaCl
Axit H3PO4 phản ứng được với: NaOH; Cu(OH)2
H3PO4+ NaOH → NaH2PO4+ H2O
H3PO4+ 2NaOH → Na2HP O4+ 2H2O
H3PO4+ 3NaOH → Na3PO4+ 3H2O
2H3PO4+ 3Cu(OH)2 → Cu3(PO4)2+6 H2O
Bài 94: Cho 150 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M. Sau phản ứng trong dung dịch chứa các muối:
A. KH2PO4 và K2HPO4 B. KH2PO4 và K3PO4
C. K2HPO4 và K3PO4 D. KH2PO4, K2HPO4, K3PO4
Lời giải:
Hướng dẫn: Đáp án A
Ta có: nKOH= 0,15 mol; nH3PO4= 0,1 mol
Ta có: T= nKOH/ nH3PO4= 1,5→ Xảy ra các PT:
H3PO4+ KOH →KH2PO4+ H2O
H4PO4+ 2KOH → K2HP O4+ 2H2O
Bài 95: Để điều chế được 24,7 kg amophot (tỉ lệ mol các muối trong amophot là 1:1) thì khối lượng H3PO4 nguyên chất cần dùng là:
A. 9,8 kg B. 14,7 kg C. 16,8 kg D. 19,6 kg
Lời giải:
Hướng dẫn: Đáp án D
Amophot gồm: NH4H2PO4 (x mol) và (NH4)2HPO4 (x mol)
→mAmophot=115x + 132x= 247x= 24,7.103 (gam)
→x= 100 mol
NH3+ H3PO4 → NH4H2PO4
2NH3+ H3PO4 →(NH4)2HPO4
Bảo toàn nguyên tố P ta có: nH3PO4= nNH4H2PO4+ n(NH4)2HPO4= 2x= 200 mol
→H3PO4=19600 gam=19,6 kg
Bài 96: Một mẫu supephotphat đơn khối lượng 15,55 gam chứa 35,43% Ca(HPO4)2 còn lại là CaSO4. Độ dinh dưỡng của loại phân bón trên là:
A. 21,69% B. 61,20% C. 16% D. 45,81%
Lời giải:
Hướng dẫn: Đáp án A
Khối lượng Ca(HPO4)2 là: mCa(HPO4)2= 15,55.35,43%=5,509365 gam
→nCa(HPO4)2=0,0237 mol→ nP2O5= nCa(HPO4)2=0,02375 mol (Bảo toàn nguyên tố P)
Độ dinh dưỡng của loại phân bón trên là:
%P2O5= mP2O5.100%/mphân= 0,02375.142.100%/15,55= 21,69%
Bài 97: Một loại phân ure có chứa 95% (NH2)2CO, còn lại là (NH4)2CO3. Độ dinh dưỡng của loại phân này là:
A. 46,00% B. 43,56% C. 44,33% D. 45,79%
Lời giải:
Hướng dẫn: Đáp án D
Giả sử có 100 gam phân ure → m(NH2)2CO= 95 gam; m(NH4)2CO3= 5 gam
→ n(NH2)2CO= 19/12 mol; n(NH4)2CO3= 5/96 mol
→ nN= 2. n(NH2)2CO +2n(NH4)2CO3=157/48 mol (Bảo toàn nguyên tố N)
Độ dinh dưỡng của phân đạm được tính bằng hàm lượng % N trong phân.
Độ dinh dưỡng của phân đạm là:
%N= mN.100%/mphân= 157/48. 14.100%: 100= 45,79%
Bài 98: Khối lượng NH3 và dung dịch HNO3 45% đủ để điều chế 100 kg phân đạm có 34% N là:
A. 20,6 kg và 76,4 kg B. 7,225 kg và 26,775 kg
C. 20,6 kg và 170 kg D. 7,75 kg và 59,5 kg
Lời giải:
Hướng dẫn: Đáp án C
Khối lượng N có trong phân đạm là 100.34%= 34 kg= 34 000 gam
→nN= 17 000/7 mol
NH3+ HNO3→ NH4NO3
Đặt nNH3= nHNO3= x mol→ bảo toàn nguyên tố N ta có:
nN= x+ x= 17 000/7 → x=8500/7 mol
→mNH3= 20642 gam= 20,6 kg
và mddHNO3 45% = (8500/7).63.100/45=170 000 gam= 170 kg
Bài 99: Phân đạm ure thường chỉ chứa 46% N. Khối lượng (kg) ure đủ cung cấp 70 kg N là:
A. 152,2 B. 145,5 C. 160,9 D. 200,0
Lời giải:
Hướng dẫn: Đáp án A
Phân đạm ure thường chỉ chứa 46% N
→ Khối lượng ure là mure= mN.100/46= 70.100/46=152,2 kg
Bài 100: Cho 15,62 gam P2O5 vào 400 ml dung dịch NaOH aM (hai chất đều phản ứng hết) thu được dung dịch có tổng khối lượng các chất tan bằng 24,2 gam. Giá trị của a là:
A. 0,2 B. 0,3 C. 0,4 D. 0,5
Lời giải:
Hướng dẫn: Đáp án B
P2O5+ 3H2O→ 2 H3PO4
→ nH3PO4= 2. nP2O5= 2.15,62/142= 0,22 mol
H3PO4+ NaOH → NaH2PO4+ H2O
H3PO4+ 2NaOH → Na2HP O4+ 2H2O
H3PO4+ 3NaOH → Na3PO4+ 3H2O
Theo các phương trình trên ta có: nH2O =nNaOH= 0,4a mol
Theo ĐLBT khối lượng:
mH3PO4+ mNaOH=mmuối+ mH2O
→ 0,22.98+ 0,4a.40=24,2+ 18.0,4a →a= 0,3 mol

