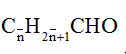5 dạng bài tập Andehit, Xeton, Axit cacboxylic trong đề thi Đại học có giải chi tiết - Hoá học lớp 11
5 dạng bài tập Andehit, Xeton, Axit cacboxylic trong đề thi Đại học có giải chi tiết
Với 5 dạng bài tập Andehit, Xeton, Axit cacboxylic trong đề thi Đại học có giải chi tiết Hoá học lớp 11 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Andehit, Xeton, Axit cacboxylic từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Dạng 1: Khử anđehit, xeton ( Phản ứng cộng H2)
Phương pháp:
+ R(CHO)n + nH2 → R(CH2OH)n
Anđehit + H2 → ancol bậc 1
+ R(CO)nR’ + nH2 → R(CHOH)nR’
Xeton + H2 → ancol bậc 2
Chú ý:
+ nanđehit/xeton = nsản phẩm
+ manđehit/xeton + mH2 = msản phẩm
+ Vkhí giảm = VH2 pư
Ví dụ minh họa
Ví dụ 1 : Hiđro hóa hoàn toàn 2,9 gam một anđehit no A được 3,1 gam ancol. A có công thức phân tử là
A. CH2O. B. C2H4O. C. C3H6O. D. C2H2O2.
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng:
mH2 = mancol – manđehit = 3,1 – 2,9 = 0,2g
nH2 = 0,1 mol
R(CHO)n + nH2 → R(CH2OH)n
0,1/n ← 0,1 (mol)
Ta có: manđehit = 0,1/n . (R + 29n) = 2,9 ⇒ R = 0
⇒ Anđehit là: (CHO)2 ⇒ Đáp án D
Ví dụ 2 : Cho 14,6 gam hỗn hợp 2 anđehit đơn chức, no kế tiếp tác dụng hết với H2 tạo 15,2 gam hỗn hợp 2 ancol.
a. Tổng số mol 2 ancol là
A. 0,2 mol. B. 0,4 mol. C. 0,3 mol. D. 0,5 mol.
b. Khối lượng anđehit có KLPT lớn hơn là
A. 6 gam. B. 10,44 gam. C. 5,8 gam. D. 8,8 gam.
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng: mH2 = mancol – manđehit = 0,6g
nH2 = 0,3 mol
Gọi công thức chung của 2 anđehit no đơn chức là:
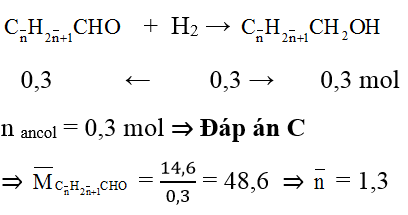
⇒ 2 anđehit là: CH3CHO (x mol) và C2H5CHO (y mol)
Dựa vào phương trình tổng số mol và tổng khối lượng ⇒ x = 0,2; y = 0,1
mC2H5CHO = 0,1.58= 5,8g ⇒ Đáp án C
Ví dụ 3 : Hiđro hoá hoàn toàn hỗn hợp M gồm hai anđehit X và Y no, đơn chức, mạch hở, kế tiếp nhau trong dãy đồng đẳng (MX < MY), thu được hỗn hợp hai ancol có khối lượng lớn hơn khối lượng M là 1 gam. Đốt cháy hoàn toàn M thu được 30,8 gam CO2. Công thức và phần trăm khối lượng của X lần lượt là:
A. HCHO và 50,56%. B. CH3CHO và 67,16%.
C. CH3CHO và 49,44%. D. HCHO và 32,44%.
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng: mancol – manđehit = mH2 = 1g
⇒ nH2 = 0,5 mol
Gọi công thức chung của 2 anđehit là:
Ta có:
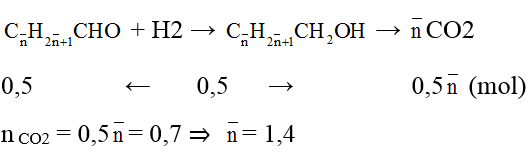
⇒ 2 anđehit là: HCHO(x mol) và CH3CHO(y mol)
Ta có: x + y = 0,5 mol;
nCO2 = x + 2y = 0,7
⇒ x = 0,3; y = 0,2
%mHCHO = 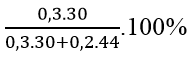
⇒ Đáp án A

Dạng 2: Phản ứng tráng bạc của anđehit
Phương pháp:
R(CHO)n → 2nAg
Chú ý: HCHO → 2Ag
+ 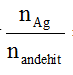
+ 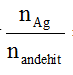
+ Nếu hỗn hợp anđehit đơn chức mà 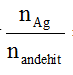
+ Dung dịch sau phản ứng tráng bạc tác dụng với HCl giải phóng khí CO2 chứng tỏ anđehit ban đầu có HCHO
Chú ý: Phản ứng tráng bạc là phản ứng thể hiện tính khử của anđehit, ngoài ra anđehit còn bị oxi hóa bởi các chất như: CuO( sản phẩm kết tủa đỏ gạch Cu2O); O2; dung dịch Br2,… để tạo ra axit.
Ví dụ minh họa
Ví dụ 1 : Cho 0,1 mol hỗn hợp X gồm hai anđehit no, đơn chức, mạch hở, kế tiếp nhau trong dãy đồng đẳng tác dụng với lượng dung dịch AgNO3 trong NH3 dư, đun nóng thu được 32,4 gam Ag. Hai anđehit trong X là
A. HCHO và C2H5CHO. B. HCHO và CH3CHO.
C. C2H3CHO và C3H5CHO. D. CH3CHO và C2H5CHO.
Hướng dẫn giải:
nAg = 0,3 mol
nAg : nX > 2; X đơn chức ⇒ X có HCHO
X gồm 2 anđehit đồng đẳng kế tiếp ⇒ X gồm: HCHO và CH3CHO
⇒ Đáp án B
Ví dụ 2 : Cho 1,72 gam hỗn hợp anđehit acrylic và anđehit axetic tham gia phản ứng cộng vừa đủ 1,12 lít H2(đktc). Cho thêm 0,696 gam anđehit B là đồng đẳng của anđehit fomic vào 1,72 gam hỗn hợp 2 anđehit trên rồi cho hỗn hợp thu được tham gia phản ứng tráng bạc hoàn toàn được 10,152 gam Ag. Công thức cấu tạo của B là:
A. CH3CH2CHO. B. C4H9CHO.
C. CH3CH(CH3)CHO. D. CH3CH2CH2CHO.
Hướng dẫn giải:
CH2=CH-CHO ( x mol); CH3-CHO (y mol)
⇒ 56x + 44y = 1,72g
nH2 = 2x + y = 0,05 mol
⇒ x = 0,015 mol; y = 0,02 mol
Ta có: nAg = 0,094 mol = 2x + 2y + 2 nB
⇒ nB = 0,012 mol; MB = 0,696/0,012= 58
⇒ B là: C2H5CHO ⇒ Đáp án B
Ví dụ 3 : Oxi hóa 1,8 gam HCHO thành axit với hiệu suất H% thu được hỗn hợp X. Cho X tham gia phản ứng tráng gương thu được 16,2 gam Ag. Giá trị của H là
A. 60. B. 75. C. 62,5. D. 25.
Hướng dẫn giải:
nHCHO = 0,06 mol; gọi nHCHO bị oxi hóa = x mol
HCHO + 1/2 O2 → HCOOH
x → x (mol)
Khi X gồm HCHO dư và HCOOH tham gia phản ứng tráng gương:
nAg = 4nHCHO + 2nHCOOH = 4.(0,06-x) + 2x = 0,15 mol
⇒ x = 0,045 mol
⇒ H% = 0,045/0,06.100% = 75% ⇒ Đáp án B
Dạng 3: Tính axit của cacboxylic
Phương pháp:
+ Phản ứng với dung dịch kiềm ( phản ứng trung hòa)
n–COOH= nOH-
+ Phản ứng với kim loại:
n–COOH = 2nH2
+ Phản ứng với muối: CO32- ; HCO3- tạo khí CO2

Ví dụ minh họa
Ví dụ 1 : A và B là 2 axit cacboxylic đơn chức. Trộn 1,2 gam A với 5,18 gam B được hỗn hợp X. Để trung hòa hết X cần 90 ml dung dịch NaOH 1M. A, B lần lượt là
A. Axit acrylic, axit axetic. B. Axit axetic, axit propionic.
C. Axit acrylic, axit propionic. D. Axit axetic, axit acrylic.
Hướng dẫn giải:
maxit = 1,2 + 5,18 = 6,38g; nNaOH = 0,09mol
Gọi công thức chung của 2 axit là RCOOH
nRCOOH = nNaOH = 0,09 mol
⇒ MRCOOH = 6,38/0,09 = 70,8 ⇒ R = 25,8
⇒ A hoặc B phải là CH3COOH
+ Nếu A là CH3COOH ⇒ nA = 1,2 : 60 = 0,02 mol
⇒ nB = 0,09 – 0,02 = 0,07 mol
MB = 5,18 : 0,07 = 74 ⇒ B là: C2H5COOH
+ Nếu B là CH3COOH ⇒ A không có giá trị
⇒ Đáp án B
Ví dụ 2 : Cho 2,46 gam hỗn hợp X gồm HCOOH, CH3COOH, C6H5OH tác dụng vừa đủ với 40 ml dung dịch NaOH 1M. Tổng khối lượng muối khan thu được sau khi phản ứng là:
A. 3,52 gam. B. 6,45 gam. C. 8,42 gam. D. 3,34 gam.
Hướng dẫn giải:
Hỗn hợp X đều tác dụng với NaOH → muối + H2O
nNaOH = nH2O
Áp dụng định luật bảo toàn khối lượng ta có:
mmuối = mX + mNaOH – mH2O
mmuối = 2,46 + 0,04.40 – 0,04.18 = 3,34g
⇒ Đáp án D
Ví dụ 3 : Cho 5,76 gam axit hữu cơ X đơn chức, mạch hở tác dụng hết với CaCO3 thu được 7,28 gam muối của axit hữu cơ. Công thức cấu tạo thu gọn của X là
A. CH2=CH - COOH. B. CH3COOH.
C. HC C - COOH. D. CH3 - CH2 - COOH.
Hướng dẫn giải:
Đặt công thức của X là: RCOOH
RCOOH → (RCOO)2Ca
R + 45 → 2R + 128 (g)
5,76 → 7,28
⇒ 5,76.(2R + 128) = 7,28.(R+45)
⇒ R = 27 ( C2H3-)⇒ X là: CH2=CH – COOH
⇒ Đáp án A
Dạng 4: Phản ứng este hóa
Phương pháp:
RCOOH + HOR’ → RCOOR’ + H2O
+ Tính hiệu suất của phản ứng theo chất thiếu hoặc sản phẩm
+ Sử dụng hằng số cân băng Kc nếu cần
Ví dụ minh họa
Ví dụ 1 : Thực hiện phản ứng este hóa m gam CH3COOH bằng một lượng vừa đủ C2H5OH ( xúc tác H2SO4 đặc, đun nóng) thu được 1,76 gam este (H=100%). Giá trị của m là:
A. 2,1 B. 1,2 C. 2,4 D. 1.4
Hướng dẫn giải:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
60g 88g
1,76.60/88 = 1,2g ← 1,76g
maxit = 1,2g ⇒ Đáp án B
Ví dụ 2 : Cho hỗn hợp X gồm ancol metylic và hai axit cacboxylic (no, đơn chức, kế tiếp nhau trong dãy đồng đẳng) tác dụng hết với Na, giải phóng ra 6,72 lít khí H2 (đktc). Nếu đun nóng hỗn hợp X (có H2SO4 đặc làm xúc tác) thì các chất trong hỗn hợp phản ứng vừa đủ với nhau tạo thành 25 gam hỗn hợp este (giả thiết phản ứng este hoá đạt hiệu suất 100%). Hai axit trong hỗn hợp X là
A. CH3COOH và C2H5COOH B. HCOOH và CH3COOH
C. C2H5COOH và C3H7COOH D. C3H7COOH và C4H9COOH
Hướng dẫn giải:
Gọi 2 axit có công thức chung là RCOOH.
Khi tham gia phản ứng với Na ⇒ nancol + naxit = 2nH2 = 0,6 mol
Vì các chất trong hỗn hợp phản ứng este hóa vừa đủ với nhau
⇒ naxit = nancol = 0,3 mol
⇒nRCOOCH3 = naxit = 0,3 mol ⇒ (R + 44 + 15). 0,3 = 25
⇒ 15 (CH3) < R = 24,333 < 29 (C2H5)
Vậy axit kế tiếp nhau là CH3COOH.

Ví dụ 3 : Khi đun nóng 25,8 gam hỗn hợp ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14,08 gam este. Nếu đốt cháy hoàn toàn lượng hỗn hợp đó thu được 23,4 ml nước. Thành phần % hỗn hợp ban đầu và hiệu suất của phản ứng este hóa lần lượt là
A. 53,5% C2H5OH; 46,5% CH3COOH và hiệu suất 80%.
B. 55,3% C2H5OH; 44,7% CH3COOH và hiệu suất 80%.
C. 60,0% C2H5OH; 40,0% CH3COOH và hiệu suất 75%.
D. 45,0% C2H5OH; 55,0% CH3COOH và hiệu suất 60%.
Hướng dẫn giải:
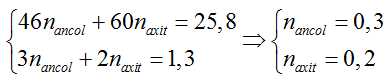
Hiệu suất tính theo axit
C2H5OH + CH3COOH → CH3COOC2H5 + H2O
0,2 ← 0,2 → 0,2 (mol)
neste = 0,16 => H% = 0,16/0,2 .100% = 80%
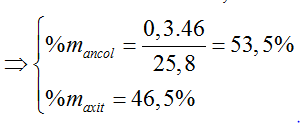
⇒ Đáp án A
Dạng 5: Đốt cháy anđehit, xeton, axit cacboxylic
Phương pháp:
+ Anđehit no đơn chức, mạch hở: CnH2nO
CnH2nO + (3n-1)/2O2 → nCO2 + nH2O
Đốt cháy anđehit no đơn chức, mạch hở: nCO2= nH2O
+Axit no đơn chức mạch hở: CnH2nO2
CnH2nO2 + (3n-2)/2O2 → nCO2 + nH2O
Đốt cháy anđehit no đơn chức, mạch hở: nCO2 = nH2O
Ví dụ minh họa
Ví dụ 1 : Đốt cháy hoàn toàn 1 andehit no, đơn chức, mạch hở X cần 17,92 lít khí oxi (đktc). Hấp thụ hết sản phẩm cháy vào dung dịch nước vôi trong dư được 60gam kết tủa. Công thức phân tử của X là
A. CH2O. B. C2H4O. C. C3H6O. D. C4H8O.
Hướng dẫn giải:
nCO2 = nCaCO3 = 0,6 mol; nO2 = 0,8 mol
Gọi anđehit no đơn chức mạch hở X là: CnH2nO
CnH2nO + (3n-1)/2O2 → nCO2 + nH2O
0,8 0,6
Ta có: 0,8.n = 0,6. (3n-1)/2 ⇒ n = 3
⇒ X là: C3H6O ⇒ Đáp án C
Ví dụ 2 : Một hỗn hợp đẳng mol gồm một axit cacboxylic no đơn chức và một ancol no đơn chức. Chia hỗn hợp làm hai phần bằng nhau. Phần 1 đem đốt cháy thu được 0,2 mol CO2 và 0,25 mol H2O. Phần 2 đem thực hiện phản ứng este hóa, phản ứng xong đem loại nước rồi đốt cháy thu được 0,2 mol CO2 và 0,22 mol H2O. Hiệu suất của phản ứng este hóa là
A. 40% B. 45% C. 50% D. 60%
Hướng dẫn giải:
Phần 1:
Đốt cháy ancol no đơn chức: nancol = nH2O – nCO2
Đốt cháy axit no đơn chức: nCO2 = nH2O
⇒ Đốt cháy phần 1: nancol = nH2O – nCO2 = 0,05 mol
Phần 2:
Ta thấy, lượng H2O loại đi chính là số mol este tạo thành
=> neste = 0,25 - 0,22 = 0,03 mol
=> H% = 0,3/0,5 . 100% = 60%
⇒ Đáp án D

Ví dụ 3 : Trung hòa 3,88 gam hỗn hợp X gồm hai axit cacboxylic no, đơn chức, mạch hở bằng dung dịch NaOH, cô cạn toàn bộ dung dịch sau phản ứng thu được 5,2 gam muối khan. Nếu đốt cháy hoàn toàn 3,88 gam X thì thể tích oxi (đktc) cần dùng là
A. 4,48 lít. B. 3,36 lít. C. 2,24 lít. D. 1,12 lít.
Hướng dẫn giải:
Đặt công thức chung của 2 axit là: CnH2nO2
RCOOH → RCOONa
Cứ 1 mol axit + NaOH → 1 mol muối tăng 22g
⇒ naxit = (5,2-3,88)/22 = 0,06 mol
Maxit = 3,88 : 0,06 = 64,6 ⇒ 14n + 32 = 64,6 ⇒ n = 7/3
CnH2nO2 + (3n-2)/2O2 → nCO2 + nH2O
0,06 0,06. (3n-2)/2 (mol)
⇒ nO2 = 0,15 mol ⇒ VO2 = 3,36 lít
⇒ Đáp án B