70 câu trắc nghiệm Cacbon, Silic có lời giải chi tiết (cơ bản) - Hoá học lớp 11
70 câu trắc nghiệm Cacbon, Silic có lời giải chi tiết (cơ bản)
Với 70 câu trắc nghiệm Cacbon, Silic có lời giải chi tiết (cơ bản) Hoá học lớp 11 tổng hợp 70 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Cacbon, Silic từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

Bài 1:Trong các phản ứng hóa học sau, phản ứng nào sai?
A. 3CO + Fe2O3
B. CO + Cl2
C. 3CO + Al2O3
D. 2CO + O2
Lời giải:
Đáp án C
CO chỉ khử được các oxit kim loại sau nhôm thành kim loại và CO2 Do đó CO không khử được Al2O3
Bài 2:Sự hình thành thạch nhũ trong các hang động đá vôi là nhờ phản ứng hóa học nào sau đây?
A. CaCO3 + CO2 + H2O → Ca(HCO3)2
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
C. CaCO3 CaO+ CO2
D. Ca(HCO3)2 CaCO3 + CO2 + H2O
Lời giải:
Đáp án D
Phản ứng Ca(HCO3)2 CaCO3 + CO2 + H2O giải thích sự tạo thành thạch nhũ trong các hang động đá vôi, cặn trong ấm đun nước,..
Phản ứng CaCO3 + CO2 + H2O → Ca(HCO3)2 giải thích sự xâm thực đá vôi của nước mưa.
Bài 3:CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, CO2 không dùng để dập tắt đám cháy nào dưới đây?
A. đám cháy do xăng dầu
B. đám cháy nhà cửa, quần áo
C. đám cháy do magie hoặc nhôm
D. đám cháy do khí gas
Lời giải:
Đáp án C
Các kim loại mạnh như Mg, Al,... có thể cháy trong khí CO2
2Mg + CO2 → 2MgO + C
Do đó không dùng CO2 để dập tắt đám cháy magie hoặc nhôm
Bài 4:Khí CO2 điều chế trong phòng thí nghiệm thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp ta dùng:
A. dung dịch NaOH đặc
B. dung dịch NaHCO3 bão hòa và dung dịch H2SO4 đặc
C. dung dịch H2SO4 đặc
D. dung dịch Na2CO3 bão hòa và dung dịch H2SO4 đặc
Lời giải:
Đáp án B
Khi cho khí CO2 có lẫn khí HCl và hơi nước qua dung dịch NaHCO3 bão hòa thì HCl sẽ tác dụng với NaHCO3 theo phương trình:
NaHCO3 + HCl → NaCl + CO2 + H2O
Sau đó hơi nước sẽ bị hấp thụ bởi H2SO4 đặc
Loại A và D vì CO2 tác dụng được với Na2CO3 bão hòa và NaOH
Loại C vì không loại bỏ được HCl
Bài 5:Dẫn luồng khí CO dư qua ống sứ nung nóng đựng hỗn hợp Al2O3, CuO, MgO và Fe2O3. Sau khi phản ứng xảy ra hoàn toàn, hỗn hợp rắn còn lại trong ống sứ gồm những chất nào?
A. Al, Cu, Mg, Fe
B. Al2O3, Cu, MgO, Fe
C. Al2O3, Cu, Mg, Fe
D. Al, Cu, MgO, Fe
Lời giải:
Đáp án B
Khí CO khử được oxit kim loại sau nhôm
CO + CuO
3CO + Fe2O3
Vậy hỗn hợp rắn còn lại trong ống sứ gồm Al2O3, Cu, Fe, MgO
Bài 6:Tính oxi hóa của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
A. C + 2H2 → CH4
B. C + 4 HNO3
C. 4C + Fe3O4
D. C + CO2
Lời giải:
Đáp án A
Ở đáp án A, số oxi hóa của C giảm từ 0 xuống -4 → C là chất oxi hóa
Ở đáp án B, số oxi hóa của C tăng từ 0 lên +4 → C là chất khử
Ở đáp án C, số oxi hóa của C tăng từ 0 lên +4 → C là chất khử
Ở đáp án D, số oxi hóa của C tăng từ 0 lên +2 → C là chất khử
Bài 7:Có 4 chất rắn: NaCl, Na2CO3, CaCO3 và BaSO4. Chỉ dùng thêm một cặp chất nào sau đây để nhận biết?
A. H2O và CO2
B. H2O và NaOH
C. H2O và AgNO3
D. H2O và BaCl2
Lời giải:
Đáp án A
Hòa tan 4 chất rắn trên vào nước.
-Chất nào tan trong nước là NaCl, Na2CO3 (nhóm I)
-Chất không tan trong nước là CaCO3, BaSO4 (nhóm II)
Sục khí CO2 vào 2 chất ở nhóm II
-Chất nào tan thu được dung dịch trong suốt thì đó là CaCO3
CaCO3 + CO2 + H2O → Ca(HCO3)2
-Chất không tan là BaSO4
Lấy dung dịch Ca(HCO3)2 thu được ở trên cho vào 2 chất ở nhóm I
-Chất nào xuất hiện làm xuất hiện kết tủa trắng thì đó là Na2CO3
Na2CO3 + Ca(HCO3)2 → CaCO3↓ + 2NaHCO3
-Chất nào không có hiện tượng gì là NaCl
Bài 8:Trong các phản ứng sau, phản ứng nào cacbon đóng vai trò vừa là chất khử vừa là chất oxi hóa?
A. C + HNO3 đặc nóng →
B. C + H2SO4 đặc nóng →
C. CaO + C 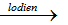
D. C + O2 → CO2
Lời giải:
Đáp án C
A. C + 4HNO3 đặc nóng → CO2 + 4NO2 + 2H2O
→ Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử
B. C +2 H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O
→ Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử
C. CaO + 3C 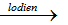
→ Số oxi hóa của C tăng từ 0 lên +2 (trong CO) và giảm từ 0 xuống -1(trong CaC2) nên C vừa là chất khử vừa là chất oxi hóa.
D. C + O2 → CO2
→ Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử
Bài 9:Cho cacbon (C) lần lượt tác dụng với Al, H2O, CuO, HNO3 đặc, KClO3, CO2, H2SO4 đặc ở điều kiện thích hợp. Số phản ứng mà trong đó C đóng vai trò là chất khử?
A. 6
B. 5
C. 7
D. 4
Lời giải:
Đáp án A
3C + 4Al
C+ H2O
C+ CuO
C + 4HNO3 đặc nóng → CO2 + 4NO2 + 2H2O (4)
3C + 2KClO3
C+ CO2
C +2 H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O (7)
Các phản ứng trong đó C là chất khử là (2), (3), (4), (5), (6), (7) tức là có 6 phản ứng
Bài 10: Cho các chất sau: CO, CO2, SO2, NO, NO2, Cl2, SiO2, H2S, NH3. Lần lượt dẫn chúng qua dung dịch Ba(OH)2 thì xảy ra bao nhiêu phản ứng và bao nhiêu phản ứng oxi hóa khử?
A. 5 phản ứng và 2 phản ứng oxi hóa khử
B. 6 phản ứng và 3 phản ứng oxi hóa khử
C. 4 phản ứng và không có phản ứng oxi hóa khử
D. 6 phản ứng và 2 phản ứng oxi hóa khử
Lời giải:
Đáp án A
Các phản ứng xảy ra là:
CO2 + Ba(OH)2 → BaCO3 + H2O (1)
SO2 + Ba(OH)2 → BaSO3 + H2O (2)
4NO2 +2 Ba(OH)2 → Ba(NO3)2 + Ba(NO2)2+ 2H2O (3)
2Cl2 +2 Ba(OH)2 → BaCl2 + Ba(ClO)2 + 2H2O (4)
H2S+ Ba(OH)2 → BaS + 2H2O (5)
Có 5 phản ứng xảy ra, trong đó phản ứng 3 và 4 là phản ứng oxi hóa khử
Chú ý SiO2 chỉ tan trong kiềm đặc nóng.
Bài 11: Cho một luồng khí CO2 đi qua 30 gam C nung nóng. Khối lượng C còn lại sau phản ứng là 6 gam. Hỗn hợp CO và CO2 thu được có thể tích bằng 112 lít (đktc). Thể tích của khí CO2 dùng ban đầu là:
A. 22,4 lít
B. 44,8 lít
C. 67,2 lít
D. 112 lít
Lời giải:
Đáp án C
Khối lượng C đã phản ứng là 30-6 =24 gam → nC= 2 mol
C+ CO2
2 2 4 mol
→ Sau phản ứng VCO2= 112- 4.22,4= 22,4 lít
→ Thể tích khí CO2 dùng ban đầu là 22,4 + 2.22,4= 67,2 lít
Bài 12: Silic đioxit không tan được trong dung dịch nào sau đây?
A. dd NaOH đặc nóng
B. dd HF
C. dd HCl
D. Na2CO3 nóng chảy
Lời giải:
Đáp án C
Silic đioxit không tan được trong dung dịch HCl
SiO2 + 2NaOH đặc nóng → Na2SiO3 + H2O
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
Bài 13:Silic phản ứng với dãy chất nào sau đây:
A. CuSO4, SiO2, H2SO4 loãng
B. F2, Mg, NaOH
C. HCl, Fe(NO3)3, CH3COOH
D. Na2SiO3, Na3PO4, NaCl
Lời giải:
Đáp án B
Si + 2F2 → SiF4
Si + 2Mg → Mg2Si
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Bài 14: Dãy chuyển hóa nào sau đây đúng với tính chất hóa học của Si và hợp chất của Si?
A. SiO2 → Na2SiO3 → H2SiO3 → SiO2 → Si
B. SiO2 → Na2SiO3 → H2SiO3 → SiO2 → NaHSiO3
C. Si → NaHSiO3 → H2SiO3 → SiO2 → Si
D. Si → SiH4 → SiO2 → NaHSiO3 → SiO2
Lời giải:
Đáp án A
Các PTHH:
SiO2 +2 NaOH nóng chảy/ → Na2SiO3 + H2O
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3
H2SiO3
SiO2 + 2Mg → 2MgO + Si
Bài 15:Cho khí CO dư đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH dư, khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm :
A. Mg, Fe, Cu
B. MgO, Fe3O4, Cu
C. MgO, Fe, Cu
D. Mg, Al, Fe, Cu
Lời giải:
Đáp án C
Cho khí CO dư đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thì CO chỉ khử các oxit kim loại sau nhôm:
4CO + Fe3O4
CO + CuO
Chất rắn Y có chứa Al2O3, MgO, Fe, Cu
Cho chất rắn Y vào dung dịch NaOH dư thì:
Al2O3 + 2NaOH → 2 NaAlO2 + H2O
Phần không tan Z là MgO, Fe và Cu.
Bài 16:Cho luồng khí CO dư đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3, nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO trong hỗn hợp đầu là :
A. 0,8 gam
B. 8,3 gam
C. 2,0 gam
D. 4,0 gam
Lời giải:
Đáp án D
Gọi số mol CuO là x, Al2O3 là y mol
Ta có
CuO + CO
x mol x mol
Al2O3 + CO
Ta có: 80x +102y= 9,1
mchất rắn sau pứ= mCu + mAl2O3= 64x+ 102 y=8,3 gam
Giải hệ trên ta có x= 0,05;y= 0,05 → mCuO= 4 gam
Bài 17:Cho V lít hỗn hợp khí (ở đktc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là :
A. 0,112
B. 0,560
C. 0,224
D. 0,448
Lời giải:
Đáp án D
Bản chất phản ứng:
CO + Ooxit → CO2
H2 + OOxit → H2O
Khối lượng chất rắn giảm chính là khối lượng oxi trong oxit kim loại bị tách ra
Ta có: moxi(oxit)= mchất rắn giảm= 0,32 gam → nO= 0,02 mol
Theo PTHH: nCO, H2= nO(oxit)= 0,02 mol → V= 0,448 lít
Bài 18:Dẫn từ từ V lít khí CO (đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là :
A. 1,12
B. 0,896
C. 0,448
D. 0,224
Lời giải:
Đáp án B
Bản chất phản ứng:
CO + Ooxit → CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Theo PTHH: nCO= nCO2= nCaCO3= 4/100 = 0,04mol → V= 0,896 lít
Bài 19:Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít khí CO (ở đktc), sau phản ứng thu được 0,84 gam Fe và 0,02 mol khí CO2. Oxit sắt X và giá trị của V lần lượt là :
A. Fe3O4và 0,224
B. Fe3O4và 0,448
C. FeO và 0,224
D. Fe2O3 và 0,448
Lời giải:
Đáp án B
Đặt công thức oxit sắt là FexOy
FexOy + yCO → xFe + yCO2
nFe= 0,84/56= 0,015 mol
Ta có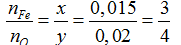
Ta có: nCO= nCO2= 0,02 mol → V= 0,02.22,4= 0,448 lít
Bài 20:Để khử hoàn toàn 45 gam hỗn hợp X gồm CuO, FeO, Fe3O4, Fe2O3 và MgO cần dùng vừa đủ 8,4 lít khí CO (đktc). Khối lượng chất rắn Y thu được sau phản ứng là:
A. 39 gam
B. 51 gam
C. 24 gam
D. 42 gam
Lời giải:
Đáp án A
Bản chất phản ứng : CO + Ooxit → CO2
Theo PTHH: nO(oxit)= nCO= 8,4/22,4= 0,375 mol
Ta có khối lượng chất rắn giảm chính là khối lượng oxi trong oxit tách ra
Khối lượng chất rắn Y thu được sau phản ứng là:
45 - 0,375.16= 39 gam
Bài 21:Cho khí CO đi qua m gam Fe2O3 nung nóng thì thu được 10,68 gam chất rắn X và khí Y. Cho toàn bộ khí Y hấp thụ vào dung dịch Ca(OH)2 dư thì thấy tạo ra 3 gam kết tủa. Giá trị của m là:
A. 11,16
B. 11,58
C. 12,0
D. 12,2
Lời giải:
Đáp án A
Bản chất phản ứng:
CO + Ooxit → CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Theo PTHH: nO (oxit)= nCO2= nCaCO3= 3/100 = 0,03 mol
→ m= mchất rắn X + mO (oxit tách)= 10,68 + 0,03.16= 11,16 gam
Bài 22:Cho khí CO đi qua ống sứ chứa 16 gam Fe2O3 đun nóng, sau phản ứng thu được hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3. Hòa tan hoàn toàn X bằng H2SO4 đặc, nóng bằng dung dịch Y. Cô cạn dung dịch Y, khối lượng muối khan thu được bằng:
A. 20 gam
B. 32 gam
C. 40 gam
D. 48 gam
Lời giải:
Đáp án C
Ta có sơ đồ phản ứng
CO + Fe2O3 → Fe, FeO, Fe3O4, Fe2O3 + H2SO4 đặc → Fe2(SO4)3
Bảo toàn nguyên tố Fe ta có: nFe2(SO4)3= nFe2O3= 16/160 = 0,1 mol
→ mFe2(SO4)3= 0,1.400= 40 gam
Bài 23:Dẫn từ từ 4,48 lít khí CO2(đktc) vào 500 ml dung dịch NaOH 1M thu được dung dịch Y. Thành phần chất tan trong dung dịch Y là:
A. NaOH, Na2CO3
B. Na2CO3
C. NaOH, NaHCO3
D. NaHCO3, Na2CO3
Lời giải:
Đáp án A
Ta có: nCO2= 4,48/22,4= 0,2 mol; nNaOH= 0,5.1= 0,5 mol
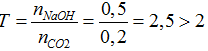
2NaOH + CO2 → Na2CO3 + H2O
Bài 24:Xác định khối lượng kết tủa thu được khi dẫn từ từ 6,72 lít khí CO2(đktc) vào 400 ml dung dịch Ca(OH)2 1M?
A. 30 gam
B. 40 gam
C. 35 gam
D. 45 gam
Lời giải:
Đáp án A
nCO2= 6,72/22,4= 0,3 mol; nCa(OH)2= 0,4.1= 0,4 mol
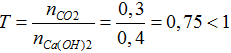
CO2 + Ca(OH)2 → CaCO3 + H2O
Ta có: 0,3 <0,4 nên CO2phản ứng hết, Ca(OH)2 còn dư
Ta có: nCaCO3= nCO2= 0,3 mol → mCaCO3= 0,3.100= 30,0 gam

Bài 25:Cho 2,8 gam CaO tác dụng với lượng nước dư thu được dung dịch A. Sục 1,68 lít khí CO2(đktc) vào dung dịch A thu được m gam kết tủa và dung dịch B. Đun nóng dung dịch B lại thu được m’ gam kết tủa nữa. Giá trị của m và m’ lần lượt là:
A. 2,5 và 2,5
B. 2,5 và 5,0
C. 5,0 và 5,0
D. 2,5 và 7,5
Lời giải:
Đáp án A
CaO+ H2O → Ca(OH)2
Ta có: nCa(OH)2= nCaO= 0,05 mol; nCO2= 1,68/22,4= 0,075 mol
Khi sục khí CO2vào dung dịch A:
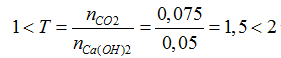
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Ca(HCO3)2
Đặt số mol CaCO3 PT 1 là x mol; số mol Ca(HCO3)2 PT 2 là y mol
Ta có: nCO2= x+2y= 0,075 mol; nCa(OH)2= x+y= 0,05 mol
→ x=y= 0,025 mol → m= mCaCO3= 0,025.100= 2,5 gam
Theo PT (2) và (3): nCaCO3= nCa(HCO3)2= 0,025 mol
→ m'= mCaCO3= 0,025.100= 2,5 gam
Bài 26:Cho 10 lít (đktc) hỗn hợp khí gồm N2 và CO2 tác dụng với 2 lít dung dịch Ca(OH)2 0,02 mol/l thu được 1 gam kết tủa. Thành phần % theo thể tích N2 trong hỗn hợp ban đầu là:
A. 2,24% hoặc 84,32%
B. 2,24% hoặc 15,68%
C. 15,68% hoặc 97,76%
D. 84,32% hoặc 97,76%
Lời giải:
Đáp án D
Ta có nCa(OH)2= 2.0,02= 0,04 mol; nCaCO3= 1/100= 0,01 mol
Ta có nCa(OH)2 > nCaCO3 nên có 2 trường hợp:
-TH1: Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3 + H2O(1)
Theo PT (1): nCaCO3= nCO2= 0,01 mol → VCO2=0,01.22,4=0,224 lít
→ %VCO2= 2,24% → %VN2= 100%- 2,24%=97,76%
-TH2: Ca(OH)2 phản ứng hết:
CO2 + Ca(OH)2 → CaCO3 + H2O(1)
0,01 0,01 ← 0,01 mol
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
2.0,03 (0,04-0,01)
Ta có: nCO2= 0,01+ 2.0,03= 0,07 mol → VCO2= 0,07.22,4=1,568 lít
→ %VCO2= 15,68% → %VN2= 100%- 15,68%=84,32%
Bài 27:Hòa tan hoàn toàn 11,2 gam CaO vào nước ta thu được dung dịch A. Nếu cho khí CO2 sục qua dung dịch A và sau khi kết thúc thí nghiệm thấy có 2,5 gam kết tủa thì có bao nhiêu lít CO2 (đktc) đã tham gia phản ứng?
A. 0,56 lit hoặc 8,4 lít
B. 0,56 lit hoặc 5,6 lít
C. 5,6 lít hoặc 2,24 lít
D. 2,24 lít hoặc 5,6 lít
Lời giải:
Đáp án A
CaO+ H2O → Ca(OH)2
Ta có: nCa(OH)2= nCaO= 11,2/56=0,2 mol; nCaCO3= 2,5/100= 0,025mol
Ta có nCa(OH)2 > nCaCO3 nên có 2 trường hợp:
-TH1: Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
Theo PT (1): nCaCO3= nCO2= 0,025 mol → VCO2=0,025.22,4=0,56 lít
-TH2: Ca(OH)2 phản ứng hết:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
0,025 0,025 ← 0,025 mol
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
0,35 (0,2-0,025)
Ta có: nCO2= 0,025+ 0,35= 0,375 mol → VCO2= 0,375.22,4=8,4 lít
Bài 28:Sục 1,792 lít khí SO2 (đktc) vào 250 ml dung dịch Ba(OH)2 nồng độ C mol/lít. Phản ứng xảy ra hoàn toàn thu được 8,68 gam kết tủa. Giá trị của C là:
A. 0,16M
B. 0,20M
C. 0,24M
D. 0,12M
Lời giải:
Đáp án C
Ta có: nSO2= 1,792/22,4= 0,08 mol; nBaSO3= 8,68/ 217= 0,04 mol
Ta có: nSO2 > nBaSO3 nên xảy ra 2 PTHH sau:
SO2 + Ba(OH)2 → BaSO3 + H2O (1)
0,04 0,04 ← 0,04 mol
2SO2 + Ba(OH)2 → Ba(HSO3)2 (2)
(0,08-0,04) → 0,02 mol
Tổng số mol Ba(OH)2 là: nBa(OH)2= 0,04 + 0,02 = 0,06 mol
→ C= CM Ba(OH)2= 0,06/ 0,25= 0,24M
Bài 29:Sục V lít khí CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1M và NaOH 1M. Sau phản ứng thu được 19,7 gam kết tủa. Giá trị lớn nhất của V là:
A. 13,44
B. 17,92
C. 20,16
D. 11,2
Lời giải:
Đáp án D
Ta có:
nBa(OH)2= 0,2.1= 0,2 mol; nNaOH= 0,2.1= 0,2 mol; nBaCO3= 19,7/197= 0,1 mol
nOH-= 0,2.2 + 0,2= 0,6 mol; nBa2+= 0,2 mol
Do đề hỏi giá trị lớn nhất của V nên số mol CO2 phải lớn nhất. Khi đó xảy ra 2 PT sau:
CO2 + 2OH- → CO32-+ H2O (1)
0,1 0,2 ← 0,1 mol
CO2 + OH- → HCO3- (2)
0,4 ← (0,6-0,2)
Ba2++ CO32- → BaCO3 (3)
0,2 0,1 ← 0,1 mol
Theo PT (1), (2) ta có: nCO2= 0,1 + 0,4= 0,5 mol → VCO2= 0,5.22,4= 11,2 lít
Bài 30:Sục 5,6 lít khí CO2 (đktc) vào 200 ml dung dịch hỗn hợp NaOH 1M, Ba(OH)2 0,5M, KOH 0,5M. Kết thúc phản ứng thu được m gam kết tủa. Trị số của m là:
A. 49,25 gam
B. 21,7 gam
C. 54,25 gam
D. 19,7 gam
Lời giải:
Đáp án D
Ta có: nCO2= 5,6/22,4=0,25 mol
nBa(OH)2= 0,2. 0,5= 0,1 mol; nNaOH= 0,2.1= 0,2 mol; nKOH= 0,2.0,5= 0,1 mol
nOH-= 0,1.2 + 0,2 + 0,1= 0,5 mol; nBa2+= 0,1 mol
Ta có: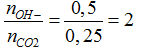
CO2 + 2OH- → CO32-+ H2O (1)
0,25 0,5 0,25 mol
Ba2++ CO32- → BaCO3 (2)
Ta có 0,1 < 0,25 nên Ba2+ phản ứng hết
→ nBaCO3= nBa2+= 0,1 mol → mBaCO3= 0,1.197= 19,7 gam
Bài 31:Một loại thủy tinh có thành phần phần trăm về khối lượng: SiO2 50,42%; CaO 23,53%; Na2O 26,05%. Trong loại thủy tinh này 1,0 mol Na2O kết hợp với:
A. 2,0 mol SiO2 và 1,0 mol CaO
B. 1,0 mol SiO2 và 2,0 mol CaO
C. 1,0 mol SiO2 và 1,0 mol CaO
D. 2,0 mol SiO2 và 2,0 mol CaO
Lời giải:
Đáp án A
Đặt công thức của thủy tinh là (Na2O)x. (CaO)y.(SiO2)z
Ta có: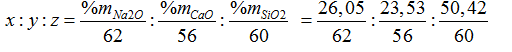
= 0,42: 0,42: 0,84= 1:1:2 → Công thức của thủy tinh là Na2O. CaO.2SiO2
→ 1 mol Na2O kết hợp với 1 mol CaO và 2 mol SiO2
Bài 32:Loại thủy tinh khó nóng chảy chứa 18,43% K2O; 10,98% CaO và 70,59% SiO2 có công thức dưới dạng các oxit là:
A. K2O. CaO.4SiO2
B. K2O. 2CaO.6SiO2
C. K2O. CaO.6SiO2
D. K2O. 3CaO.8SiO2
Lời giải:
Đáp án C
Đặt công thức của thủy tinh là (K2O)x. (CaO)y.(SiO2)z
Ta có: 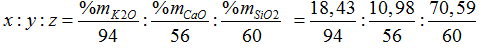
= 0,196: 0,196: 1,1765= 1:1:6 → Công thức của thủy tinh là Na2O. CaO.6SiO2
Bài 33:Thành phần chính của đất sét là cao lanh, có công thức là x Al2O3.ySiO2.zH2O, trong đó tỉ lệ về khối lượng các oxit và nước tương ứng là 0,3696;0,4348; 0,1957. Công thức hóa học nào dưới đây là của cao lanh đã cho?
A. Al2O3.2SiO2.3H2O
B. Al2O3.3SiO2.2H2O
C. 3Al2O3.SiO2.2H2O
D. 2Al2O3.SiO2.3H2O
Lời giải:
Đáp án A
Ta có:
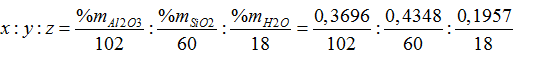
=0,00362:0,0072: 0,01087= 1:2:3
→ Công thức của cao lanh là: Al2O3.2SiO2.3H2O
Bài 34:Khi đốt cháy hỗn hợp X gồm SiH4 và CH4 thu được chất rắn nặng 6 gam và chất khí. Cho chất khí qua dung dịch NaOH dư thu được 31,8 gam muối khan. Thành phần phần trăm theo thể tích của mỗi khí trong A là:
A. 45% và 55%
B. 26% và 74%
C. 30% và 70%
D. 25% và 75%
Lời giải:
Đáp án D
Đốt cháy hỗn hợp gồm SiH4 và CH4 thu được chất rắn là SiO2 và chất khí là CO2.
Ta có: SiH4 +2 O2
CH4 +2 O2
Ta có: nSiH4= nSiO2= 6/60= 0,1 mol
Khi cho khí CO2 qua dung dịch NaOH dư thì:
CO2 + 2NaOH → Na2CO3 + H2O
Theo PTHH: nCH4= nCO2=nNa2CO3= 31,8/106= 0,3 mol
→ nX= nCH4 + nSiH4= 0,3 + 0,1= 0,4 mol
Trong cùng điều kiện, tỉ lệ về số mol chính là tỉ lệ về thể tích
→ 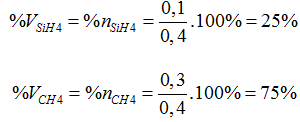
Bài 35:Cho nhận xét sau:
1)Silic vừa thể hiện tính khử vừa thể hiện tính oxi hóa
2)Trong công nghiệp, silic được điều chế bằng cách đốt cháy hỗn hợp gồm bột Mg và cát nghiền mịn
3)SiO2 là một oxit axit, tan được trong nước tạo ra axit silixic
4)Silic siêu tinh khiết là chất bán dẫn trong kĩ thuật vô tuyến và điện tử
5)Axit silixic có tính axit yếu hơn axit cacboxilic
Số nhận xét đúng là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án C
1) Đúng: Silic có các số oxi hóa là -4; 0; +2; +4. Tuy nhiên số oxi hóa +2 ít phổ biến.
2) Sai: Trong công nghiệp, silic được điều chế bằng cách dùng than cốc khử SiO2 trong lò điện ở nhiệt độ cao.
3) Sai: SiO2 là oxit axit nhưng không tan trong nước
4) Đúng
5) Đúng. Ví dụ: Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3
Bài 36:Nấu chảy 6 gam Mg với 4,5 gam silic đioxit thu được hỗn hợp Y. Tính thể tích khí ở đkc khi cho lượng dư dung dịch NaOH vào Y. Giả sử phản ứng được tiến hành với hiệu suất 100%?
A. 3,36 lít
B. 1,68 lít
C. 4,48 lít
D. 2,24 lít
Lời giải:
Đáp án A
Số mol Mg bằng 0,25 mol; số mol SiO2 bằng 0,075 mol
PTHH: 2Mg + SiO2 → 2MgO + Si
Ta có: 0,25/2 > 0,075/1 → SiO2 phản ứng hết
→ nSi= nSiO2= 0,075 mol
hỗn hợp Y chứa MgO, Si, Mg dư
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Ta có: nH2= 2.nSi= 2.0,075= 0,15 mol → VH2=3,36 lít
Bài 37:Xác định khối lượng kết tủa thu được khi dẫn từ từ 4,48 lít khí CO2 (đktc) vào 300 ml dung dịch Ca(OH)2 1M?
A. 20 gam
B. 30 gam
C. 40 gam
D. 35 gam
Lời giải:
Đáp án A
Ta có: nCO2= 0,2 mol; nCa(OH)2= 0,3 mol
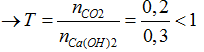
CO2 + Ca(OH)2 → CaCO3 + H2O
0,2 0,3 0,2 mol
→ mCaCO3= 0,2.100= 20 gam
Bài 38:Có một hỗn hợp gồm Si, Al và CaCO3. Cho hỗn hợp trên tác dụng với lượng dư dung dịch NaOH tạo thành 17,92 lít khí (đktc).Cũng lượng hỗn hợp trên khi tác dụng với lượng dư dung dịch HCl cũng sinh ra 17,92 lít khí (đktc) và lượng khí này tác dụng với dung dịch Ca(OH)2 tạo ra 16,2 gam Ca(HCO3)2. Khối lượng của Si trong hỗn hợp là:
A. 1,4 gam
B. 2,8 gam
C. 5,6 gam
D. 7,0 gam
Lời giải:
Đáp án B
Đặt số mol Si, Al, CaCO3 lần lượt là x, y, z mol
Si + 2NaOH + H2O → Na2SiO3 + 2H2 (1)
Al+ NaOH + H2O → NaAlO2 + 3/2 H2 (2)
Theo PT(1), (2) ta có: nH2= 2.nSi + 3/2.nAl= 2x+ 3/2y= 0,8 mol (*1)
CaCO3 + 2HCl → CaCl2 + CO2 + H2O (3)
2Al + 6HCl → 2AlCl3 + 3H2 (4)
Theo PT(3), (4) ta có: nkhí= nCaCO3 + 3/2.nAl= z+ 3/2y= 0,8 mol (*2)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (5)
Theo PT (5): nCO2= 2. nCa(HCO3)2= 2. 16,2/162= 0,2 mol
Theo PT (3): nCaCO3= nCO2= 0,2 mol= z
Từ (*1), (*2) ta có: x=0,1; y= 0,4
→ mSi= 0,1.28 = 2,8 gam
Bài 39:Nung m1 gam Mg dư với lượng SiO2 thu được hỗn hợp chất rắn Y. Cho Y tác dụng vừa đủ với 300 ml dung dịch HCl 2M (đktc) thu được 2,24 lít khí H2 (đktc). Tính lượng Si tạo thành. Biết các phản ứng xảy ra hoàn toàn.
A. 1,4 gam
B. 2,8 gam
C. 5,6 gam
D. 7,0 gam
Lời giải:
Đáp án B
PTHH: 2Mg + SiO2 → 2MgO + Si (1)
Chất rắn Y chứa MgO, Si và Mg dư
MgO + 2HCl → MgCl2 + H2O (2)
Mg + 2HCl → MgCl2 + H2 (3)
Ta có: nHCl= 0,3.2= 0,6 mol; nH2= 0,1 mol
Theo PT (3): nMg= nH2= 0,1 mol; nHCl PT 3= 2.nH2= 0,2 mol
→ nHCl PT 2= 0,6- 0,2= 0,4 mol → nMgO= 0,2 mol
Theo PT (1): nSi=0,5 nMgO= 0,1 mol → mSi= 0,1.28= 2,8 gam
Bài 40:Đốt cháy 4,48 lít hỗn hợp khí CH4 và SiH4 ở đktc thu được m gam chất rắn và sản phẩm khí và hơi. Dẫn toàn bộ sản phẩm khí vào dung dịch Ca(OH)2 dư thấy khối lượng dung dịch tăng 1,6 gam so với khối lượng dung dịch ban đầu. Thành phần phần trăm khối lượng của SiH4 trong hỗn hợp là:
A. 50%
B. 66,67%
C. 33,33%
D. 26,7%
Lời giải:
Đáp án B
CH4 + 2O2 → CO2 + 2H2O (1)
x x mol 2x mol
SiH4 + 2O2 → SiO2 + 2H2O (2)
y mol 2y mol
Sản phẩm khí thu được chứa CO2, H2O
CO2 + Ca(OH)2 → CaCO3 + H2O (3)
x x mol
Ta có: mdd tăng= mCO2 + mH2O - mCaCO3= 44x+ 18 (2x+2y)- 100x=-20x+ 36y= 1,6
mà nhỗn hợp khí= x+ y= 0,2 mol
Giải hệ trên ta có: x= 0,1; y= 0,1
Phần trăm khối lượng của SiH4 trong hỗn hợp là:
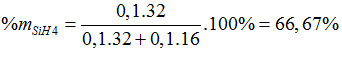
Bài 41:Từ hai muối X và Y thực hiện các phản ứng sau:
X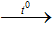
X1+ H2O → X2
X2+ Y → X+ Y1+ H2O
X2+ 2Y → X + Y2+ 2H2O
Hai muối X, Y tương ứng là:
A. BaCO3, Na2CO3
B. CaCO3, NaHSO4
C. MgCO3, NaHCO3
D. CaCO3, NaHCO3
Lời giải:
Đáp án D
Do X nhiệt phân thu được sản phẩm X1 có khả năng phản ứng với nước nên X là BaCO3 hoặc CaCO3 → X2 là kiềm
Do X2+ Y tạo ra X nên Y là muối CO32-- hoặc HCO3-
Do X2 tác dụng với Y theo 2 tỉ lệ khác nhau nên Y phải là muối HCO3-
Vậy X là CaCO3, Y là NaHCO3
PTHH:
CaCO3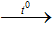
CaO+ H2O → Ca(OH)2
Ca(OH)2 + NaHCO3 → CaCO3 + NaOH+ H2O
Ca(OH)2 + 2 NaHCO3 → CaCO3 + Na2CO3 + 2H2O

Bài 42:Có 3 dung dịch hỗn hợp:
1)NaHCO3 + Na2CO3
2) NaHCO3 + Na2SO4
3)Na2CO3 + Na2SO4
Chỉ dùng thêm một cặp chất nào trong số các cặp chất cho dưới đây để có thể phân biệt được các dung dịch hỗn hợp trên?
A. dung dịch HNO3 và dung dịch KNO3
B. dung dịch HCl và dung dịch KNO3
C. dung dịch HNO3 và dung dịch Ba(NO3)2
D. Dung dịch Ba(OH)2 dư
Lời giải:
Đáp án C
Cho dung dịch Ba(NO3)2 vào các dung dịch trên:
Ở cả 3 dung dịch đều xuất hiện kết tủa trắng:
-Ống nghiệm 1:
Ba(NO3)2 + Na2CO3 → BaCO3 ↓ + 2NaNO3
- Ống nghiệm 2:
Ba(NO3)2 + Na2SO4 → BaSO4 ↓ + 2NaNO3
-Ống nghiệm 3:
Ba(NO3)2 + Na2CO3 → BaCO3 ↓ + 2NaNO3
Ba(NO3)2 + Na2SO4 → BaSO4 ↓ + 2NaNO3
Sau đó cho dung dịch HNO3 lần lượt vào các ống nghiệm trên:
-Ống nghiệm nào kết tủa tan hoàn toàn thì đó là BaCO3 → Ống nghiệm ban đầu chứa NaHCO3 + Na2CO3
2HNO3 + BaCO3 → Ba(NO3)2 + CO2 + H2O
-Ống nghiệm nào kết tủa không tan thì đó là BaSO4 → Ống nghiệm ban đầu chứa NaHCO3 + Na2SO4
-Ống nghiệm nào kết tủa tan 1 phần thì đó là BaCO3, BaSO4 → Ống nghiệm ban đầu chứa Na2CO3 + Na2SO4
2HNO3 + BaCO3 → Ba(NO3)2 + CO2 + H2O
Bài 43:Nung nóng 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khối lượng không đổi còn lại 69 gam chất rắn. % khối lượng mỗi chất trong hỗn hợp ban đầu là:
A. 63% và 37%
B. 42% và 58%
C. 16% và 84%
D. 84% và 16%
Lời giải:
Đáp án C
Đặt số mol Na2CO3, NaHCO3 lần lượt là x, y mol → 106x + 84y= 100 (gam)
2NaHCO3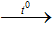
ymol y/2 mol
→ mNa2CO3= (x+y/2).106= 69 gam
Giải hệ trên ta có x= 8/53 mol; y= 1mol
→ %mNa2CO3= 16%; %mNaHCO3= 84%
Bài 44:Nung 49,2 gam hỗn hợp Ca(HCO3)2 và NaHCO3 đến khối lượng không đổi, được 5,4 gam H2O. Khối lượng chất rắn thu được là:
A. 43,8 gam
B. 30,6 gam
C. 21,8 gam
D. 17,4 gam
Lời giải:
Đáp án C
Đặt nCa(HCO3)2= x mol; nNaHCO3= y mol
→ mhỗn hợp= mCa(HCO3)2 + mNaHCO3= 162x + 84y= 49,2 gam
Ca(HCO3)2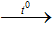
x x x mol
2NaHCO3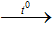
y y/2 y/2 mol
Ta có: nH2O= x + y/2= 5,4/18= 0,3 mol
Suy ra x= 0,2 mol; y= 0,2 mol
Chất rắn thu được sau phản ứng là 0,2 mol CaO và 0,1 mol Na2CO3
→ mchất rắn= mCaO + mNa2CO3= 0,2. 56 + 0,1. 106= 21,8 gam

Bài 45:Hòa tan hoàn toàn 4 gam hỗn hợp MCO3 và RCO3 bằng dung dịch HCl dư thấy thoát ra V lít khí (đktc). Dung dịch thu được đem cô cạn được 5,1 gam muối khan. Giá trị của V là:
A. 1,12 lít
B. 1,68 lít
C. 2,24 lít
D. 3,36 lít
Lời giải:
Đáp án C
MCO3 + 2HCl → MCl2 + CO2 + H2O
x 2x x x mol
RCO3 + 2HCl → RCl2 + CO2 + H2O
y 2y y y mol
Theo định luật bảo toàn khối lượng:
mmuối cacbonat + mHCl= m muối clorua + mCO2 + mH2O
→ 4 + 36,5. (2x+ 2y)= 5,1 + 44. (x+y) + 18 (x+y)
→ x+y= 0,1 mol → V= 2,24 lít
Bài 46:Cho 7,0 gam hỗn hợp hai muối cacbonat của kim loại hóa trị II tác dụng hết với dung dịch HCl thấy thoát ra V lít khí ở đktc. Cô cạn dung dịch sau phản ứng thu được 9,2 gam muối khan. Giá trị của V là:
A. 1,12 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Lời giải:
Đáp án D
Đặt công thức của hai muối là RCO3: x mol
RCO3 + 2HCl → RCl2 + CO2 + H2O
x 2x x x mol
Theo định luật bảo toàn khối lượng:
mmuối cacbonat + mHCl= m muối clorua + mCO2 + mH2O
→ 7,0 + 2x. 36,5=9,2+ 44x+18x → x= 0,2 mol → VCO2= 0,2.22,4= 4,48 lít
Bài 47:Hòa tan hoàn toàn hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị II trong dung dịch HCl dư thu được 10,08 lít khí không màu ở điều kiện tiêu chuẩn. Cô cạn dung dịch sau phản ứng thì khối lượng muối khan thu được so với trước phản ứng là:
A. tăng 4,95 gam
B. giảm 4,95 gam
C. tăng 5,85 gam
D. giảm 5,85 gam
Lời giải:
Đáp án A
Đặt công thức của hai muối là RCO3
Ta có: nCO2= 10,08/22,4= 0,45 mol
RCO3 + 2HCl → RCl2 + CO2 + H2O
Theo PT ta có: nRCO3= nRCl2= nCO2= 0,45 mol
→ mRCl2- mRCO3= 0,45. (R+71)- 0,45. (R+60)= 4,95 gam
→ Muối sau phản ứng tăng so với trước phản ứng là 4,95 gam
Bài 48:Cho 1,84 gam hỗn hợp hai muối RCO3 và R'CO3 tác dụng hết với dung dịch HCl thu được 0,672 lít khí CO2(đktc) và dung dịch X. Khối lượng muối tạo thành trong dung dịch X là bao nhiêu?
A. 2,17 gam
B. 1,51 gam
C. 2,575 gam
D. 1,105 gam
Lời giải:
Đáp án A
Ta có: nCO2= 0,672/22,4= 0,03 mol
RCO3 + 2HCl → RCl2 + CO2 + H2O
R'CO3 + 2HCl → R'Cl2 + CO2 + H2O
Ta có nHCl= 2.nCO2= 0,06 mol; nH2O= nCO2= 0,03 mol
Theo định luật bảo toàn khối lượng:
mmuối cacbonat + mHCl= mmuối clorua + mCO2 + mH2O
1,84+ 0,06.36,5= mmuối clorua + 0,03.44+ 0,03.18 → mmuối clorua= 2,17 gam
Bài 49Cho 0,53 gam muối cacbonat của kim loại hóa trị I tác dụng với dung dịch HCl dư thấy thoát ra 112 ml khí CO2(đktc). Công thức phân tử nào dưới đây là của muối cacbonat?
A. NaHCO3
B. KHCO3
C. Na2CO3
D. K2CO3
Lời giải:
Đáp án C
Ta có: nCO2= 0,112/22,4= 0,005 mol
-TH1: Muối cacbonat trung hòa:
Đặt công thức của muối là R2CO3
R2CO3 + 2HCl → 2RCl+ CO2 + H2O
Theo PTHH: nR2CO3= nCO2= 0,005 mol → MR2CO3= 0,53/ 0,005=106
→ MR= 23 → Na → Na2CO3
-TH2: Muối cacbonat axit
Đặt công thức của muối là RHCO3
RHCO3 + HCl → RCl+ CO2 + H2O
Theo PTHH: nRHCO3= nCO2= 0,005 mol → MRHCO3= 0,53/ 0,005=106
→ MR= 465 → Loại
Bài 50:Hấp thụ hoàn toàn a mol khí CO2vào dung dịch chứa b mol Ca(OH)2 thì thu được sản phẩm chỉ chứa muối axit. Quan hệ giữa a và b là:
A. a≥2b.
B. a<b.
C. b<a<2b.
D. a=b.
Lời giải:
Đáp án A
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Sau phản ứng thu được muối axit nên
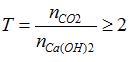
Bài 51:Cacbon chỉ thể hiện tính khử trong phản ứng hóa học nào sau đây?
A. C + O2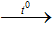
B. C + 2H2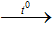
C. 3C+ 4Al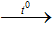
D. 3C + CaO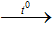
Lời giải:
Đáp án A
-Ở đáp án A: số oxi hóa của C tăng từ 0 lên +4 → C là chất khử
-Ở đáp án B: số oxi hóa của C giảm từ 0 xuống -4 → C là chất oxi hóa
-Ở đáp án C: số oxi hóa của C giảm từ 0 xuống -4 → C là chất oxi hóa
-Ở đáp án D: số oxi hóa của C tăng từ 0 lên +2 và xuống -1 nên C vừa là chất oxi hóa vừa là chất khử
Bài 52:Dẫn khí CO dư đi qua ống sứ đựng 7,2 gam bột FeO nung nóng, thu được hỗn hợp khí X. Cho toàn bộ X vào nước vôi trong dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn, giá trị của m là:
A. 5,0
B. 10,0
C. 7,2
D. 15,0
Lời giải:
Đáp án B
CO + FeO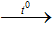
CO2 + Ca(OH)2 → CaCO3 + H2O
Theo PTHH: nCaCO3= nCO2= nFeO= 7,2/72= 0,1 mol → mCaCO3= 0,1.100= 10 gam
Bài 53:Hấp thụ hoàn toàn a mol khí CO2vào dung dịch chứa b mol Ca(OH)2 thì thu được hỗn hợp chứa 2 muối. Quan hệ giữa a và b là:
A. a>b.
B. a<b.
C. b<a<2b.
D. a=b.
Lời giải:
Đáp án C
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Sau phản ứng thu được 2 muối nên
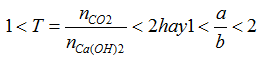
Bài 54:Cho 224,0 ml khí CO2(đktc) hấp thụ hết trong 100,0 ml dung dịch KOH 0,200M. Khối lượng của muối tạo thành là:
A.1,38 gam.
B. 2gam
C. 1gam
D. 1,67 gam
Lời giải:
Đáp án A
Ta có: nCO2= 0,224/22,4= 0,01 mol; nKOH= 0,1.0,2= 0,02 mol
→ CO2tác dụng với KOH tạo muối trung hòa theo PTHH:
CO2 + 2KOH → K2CO3 + H2O
0,01 0,02 0,01 mol
→ mK2CO3= 0,01.138= 1,38 gam
Bài 55:Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít khí CO (ở đktc), sau phản ứng thu được 1,12 gam Fe và 0,03 mol khí CO2. Công thức của X và giá trị V lần lượt là
A. Fe3O4 và 0,224.
B. Fe2O3 và 0,672.
C. Fe3O4 và 0,448.
D. FeO và 0,224.
Lời giải:
Đáp án B
Đặt công thức oxit sắt là FexOy
Ta có: nFe= 1,12/56= 0,02mol
FexOy + yCO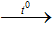
Theo PTHH:
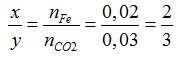
Ta có: nCO= nCO2= 0,03 mol → V= 0,03.22,4= 0,672 lít
Bài 56:V lít khí CO2(đktc) vào 1,5 lít Ba(OH)2 0,1M được 19,7 gam kết tủa. Giá trị lớn nhất của V là?
A. 1,12
B. 2,24
C. 4,48
D. 6,72
Lời giải:
Đáp án C
Ta có: nBa(OH)2= 1,5. 0,1= 0,15 mol; nBaCO3= 19,7/197= 0,1 mol
Do đề hỏi giá trị lớn nhất của V nên xảy ra các phương trình hóa học sau:
CO2 + Ba(OH)2 → BaCO3 + H2O
0,1 0,1 ← 0,1 mol
2CO2 + Ba(OH)2 → Ba(HCO3)2
0,1 ← (0,15-0,1)
Vậy nCO2= 0,1 + 0,1= 0,2 mol → VCO2= 0,2.22,4= 4,48 lít
Bài 57:Thổi V lit (đktc) CO2vào 100 ml dd Ca(OH)2 1M, thu được 6g kết tủa. Lọc bỏ kết tủa lấy dd đun nóng lại có kết tủa nữa. Giá trị V là:
A.3,136
B. 1,344
C. 1,344 hoặc 3,136
D. 3,36 hoặc 1,12
Lời giải:
Đáp án A
Ta có: nCa(OH)2= 1,0. 0,1= 0,1 mol; nBaCO3= 6/100= 0,06 mol
Do sau khi đun nóng dung dịch lại xuất hiện kết tủa nên CO2tác dụng với Ca(OH)2 theo 2 PTHH sau:
CO2 + Ca(OH)2 → CaCO3 + H2O
0,06 0,06 ← 0,06 mol
2CO2 + Ca(OH)2 → Ca(HCO3)2
0,08 ← (0,1-0,06)
Vậy nCO2= 0,06 + 0,08= 0,14 mol → VCO2= 0,14.22,4= 3,136 lít

Bài 58:Khử 4,64 gam hỗn hợp X gồm các oxit MgO, FeO, Fe3O4, và Fe2O3 bằng khí CO ỏ nhiệt độ cao, người ta thu được m gam hỗn hợp chất rắn Y và khí Z. Khí Z dẫn qua dung dịch Ba(OH)2 dư thu được 1,97 gam kết tủa. Giá trị của m là
A. 4,84
B. 4,40
C. 4,48
D. 4,68
Lời giải:
Đáp án C
Bản chất phản ứng:
CO + Ooxit → CO2
CO2 + Ba(OH)2 → BaCO3↓ + H2O
Theo PTHH: nO (oxit)= nCO2= nBaCO3= 1,97/197 = 0,01 mol
→ m= mchất rắn X - mO (oxit tách)= 4,64 -0,01.16= 4,48 gam
Bài 59:Hấp thụ toàn bộ 0,3 mol CO2vào dung dịch chứa 0,25 mol Ca(OH)2. Khối lượng dung dịch sau phản ứng tăng hay giảm bao nhiêu gam?
A. Tăng 13,2gam
B. Tăng 20gam
C. Giảm 16,8gam
D. Giảm 6,8 gam
Lời giải:
Đáp án D
Ta thấy:
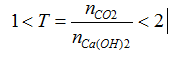
→ CO2phản ứng với Ca(OH)2 theo 2 PTHH sau:
CO2 + Ca(OH)2 → CaCO3 + H2O
x x x mol
2CO2 + Ca(OH)2 → Ca(HCO3)2
2y y y mol
Đặt nCaCO3= x mol; nCa(HCO3)2= y mol
Ta có: nCO2= x+2y= 0,3; nCa(OH)2= x+y= 0,25 mol
→ x= 0,2 và y= 0,05
→ Khối lượng dung dịch sau phản ứng giảm là:
mCaCO3- mCO2= 100.x- 0,3.44= 100. 0,2- 0,3.44= 6,8 gam
Bài 60:Trong các phản ứng hoá học sau,phản ứng nào sai?
A. SiO2 + 4HF → SiF4 + 2H2O
B. SiO2 + 4HCl → SiCl4 + 2H2O
C. SiO2 + 2C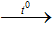
D. SiO2 + 2Mg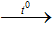
Lời giải:
Đáp án B
SiO2 không phản ứng với HCl
Bài 61:Hoà tan hoàn toàn 20 gam hỗn hợp A gồm MgCO3 và RCO3 (với tỉ lệ mol 1:1) bằng dung dịch HCl dư. Lượng CO2sinh ra cho hấp thụ hoàn toàn bởi 500 ml dung dịch Ba(OH)2 0,5 M thu được 39,4 gam kết tủa.Kim loại R là
A. Ba.
B. Ca.
C. Fe.
D. Cu.
Lời giải:
Đáp án C
Đặt nMgCO3= nRCO3= x mol → 84.x + (R+60).x= 20 gam (*)
MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
RCO3 + 2HCl → RCl2 + CO2 + H2O (2)
Theo PT (1,2): nCO2= nMgCO3 + nRCO3= x + x= 2x mol
Ta có: nBa(OH)2= 0,5.0,5= 0,25 mol; nBaCO3= 39,4/197= 0,2 mol
Do nBa(OH)2 > nBaCO3 nên có 2 trường hợp xảy ra:
-TH1: Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3 + H2O
Theo PT: nCO2= nBaCO3= 0,2 mol = 2x → x= 0,1 mol
Thay x= 0,1 vào (*) ta có: R=56 → R là Fe
-TH2: Ba(OH)2 phản ứng hết
CO2 + Ba(OH)2 → BaCO3 + H2O
0,2 0,2 ← 0,2 mol
2CO2 + Ba(OH)2 → Ba(HCO3)2
0,1 ← (0,25-0,2)
Vậy nCO2= 0,2 + 0,1= 0,3 mol = 2x → x= 0,15
Thay x= 0,15 vào (*) ta có: R= -10,67 Loại
Vậy R là Fe
Bài 62:Cho V lít khí CO2(đktc) hấp thụ hết vào 500 ml dung dịch Ca(OH)2 0,02 M thì thu được 0,5 gam kết tủa. Giá trị tối thiểu của V là
A. 0,336.
B. 0,112.
C. 0,224.
D. 0,448.
Lời giải:
Đáp án B
Ta có: nCa(OH)2= 0,5.0,02= 0,01 mol; nCaCO3= 0,5/100= 0,005 mol
Ta có: nCa(OH)2 > nCaCO3 và đề hỏi giá trị tối thiểu của V nên khi đó Ca(OH)2 dư
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Theo PT: nCO2= nCaCO3= 0,005 mol → VCO2= 0,005.22,4= 0,112 lít
Bài 63:Hấp thụ hết V lít CO2(đktc) vào 300ml dung dịch NaOH x mol/l được 10,6g Na2CO3 và 8,4g NaHCO3. Giá trị V, x lần lượt là?
A. 4,48lít và 1M
B. 4,48lít và 1,5M
C. 6,72 lít và 1M
D. 5,6 lít và 2M
Lời giải:
Đáp án A
Ta có: nNa2CO3= 0,1 mol; nNaHCO3=0,1 mol
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Theo PT (1,2): nCO2= nNaHCO3 + nNa2CO3= 0,2 mol → V= 0,2.22,4= 4,48 lít
Theo PT(1,)2: nNaOH= nNaHCO3 + 2.nNa2CO3= 0,1+0,1.2= 0,3 mol
→ CM NaOH= 0,3/ 0,3= 1,0M= x
Bài 64:Hấp thụ hết CO2vào dung dịch NaOH được dung dịch A. Chia A làm 2 phần bằng nhau. Cho dung dịch BaCl2 dư vào phần 1 được a gam kết tủa. Cho dung dịch Ba(OH)2 dư vào phần 2 được b gam kết tủa. Cho biết a<b. Dung dịch A chứa:
A. Na2CO3
B. NaHCO3
C. NaOH và NaHCO3
D. NaHCO3, Na2CO3
Lời giải:
Đáp án D
Do dung dịch A tác dụng với BaCl2 dư thu được kết tủa → A chứa muối Na2CO3
Do dung dịch A tác dụng với dung dịch Ba(OH)2 dư thu được kết tủa nhiều hơn khi tác dụng với dung dịch BaCl2 dư nên A ngoài Na2CO3 còn chứa NaHCO3
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
BaCl2 + Na2CO3 → BaCO3 + 2NaCl
Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH
Ba(OH)2 + 2NaHCO3 → BaCO3 ↓ + Na2CO3 + 2H2O
Bài 65:Dung dịch X chứa a mol NaHCO3 và b mol Na2CO3. Thực hiện các thí ngiệm sau:
TN1: cho (a+b)mol CaCl2; TN2: cho (a+b) mol Ca(OH)2 vào dung dịch X. Khối lượng kết tủa thu được trong 2 TN là
A. Bằng nhau
B. Ở TN1 < ở TN2
C. Ở TN1 > ở TN2
D. Không xác định
Lời giải:
Đáp án B
TN1: CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl (a+b) b b mol
TN2:
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
b b b mol
Ca(OH)2 + NaHCO3 → CaCO3 ↓ + NaOH + H2O
a a a mol
Vậy nCaCO3 (TN1) < nCaCO3 (TN2) → mCaCO3 (TN1) < mCaCO3 (TN2)

Bài 66:Dung dịch X có chứa: 0,1 mol Na2CO3; 0,1 mol K2CO3 và 0,3 mol NaHCO3. Thêm từ từ V ml dung dịch HCl 1M vào dung dịch X thu được dung dịch Y và 3,36 lít khí (đktc). Giá trị của V là
A. 250 ml
B. 300 ml
C. 350 ml
D. 400 ml
Lời giải:
Đáp án C
Ta có: nCO3(2-)= 0,1 + 0,1= 0,2 mol; nCO2= 0,15 mol
Cho từ từ dung dịch HCl vào dung dịch X thì xảy ra các PTHH sau:
H+ + CO32- → HCO3-
0,2 ← 0,2 → 0,2
Tổng số mol HCO3- là: 0,2 + 0,3= 0,5 mol
H+ + HCO3- → CO2 +H2O
0,15 0,15 ← 0,15
Ta có: nH+= 0,2 + 0,15= 0,35 mol= nHCl → V= 0,35/1= 0,35 lít = 350 ml
Bài 67:Cho khí CO qua ống chứa 15,2g hỗn hợp gồm CuO và FeO nung nóng. Sau một thời gian thu được hỗn hợp khí B và 13,6g chất rắn C. Cho B tác dụng với dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là
A. 15,0.
B. 10,0.
C. 20,0.
D. 25,0
Lời giải:
Đáp án B
Bản chất phản ứng:
CO + Ooxit → CO2
Khối lượng chất rắn giảm chính là khối lượng oxi trong oxit bị tách ra
→ mO (oxit tách ra)= mCuO,FeO- mhỗn hợp C= 15,2-13,6= 1,6 gam
→ nO (oxit tách ra)= 0,1 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Theo PTHH: nCaCO3= nCO2= nO(oxit)= 0,1 mol → mCaCO3= 0,1.100= 10 gam
Bài 68:Dẫn một luồng khí CO dư qua ống sứ đựng Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Tổng số gam 2 oxit ban đầu là
A. 6,24.
B. 5,32.
C. 4,56.
D. 3,12.
Lời giải:
Đáp án D
Đặt nFe3O4= x mol; nCuO= y mol
4CO + Fe3O4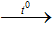
x 4x 3x mol
CO + CuO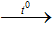
y y y mol
CO2 + Ca(OH)2 → CaCO3 + H2O
(4x+y) (4x+y)
Theo PTHH: nCO2= 4x + y= nCaCO3= 5/100= 0,05 mol
mkim loại= mFe + mCu= 3x.56+ 64y= 2,32 gam
Giải hệ trên ta có: x= 0,01; y= 0,01 mol
→ m2 oxit= mFe3O4 + mCuO= 232x + 80y= 3,12 gam
Bài 69:Cho 1,568 lít CO2(đktc) hấp thụ hết vào dung dịch chứa 3,36 gam NaOH. Muối thu được có khối lượng là?
A.7,112g
B. 6,811g
C. 6,188g
D. 8,616g
Lời giải:
Đáp án C
Ta có: nCO2= 0,07 mol; nNaOH= 0,084 mol
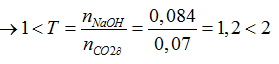
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
Đặt số mol nNa2CO3= xmol; nNaHCO3= y mol
Ta có: nCO2= x + y= 0,07 mol; nNaOH= 2x+ y=0,084 mol
→ x= 0,014; y= 0,056
→ mmuối= mNa2CO3 + mNaHCO3= 0,014.106 + 0,056.84=6,188 gam
Bài 70:Thể tích dung dịch Ca(OH)2 0,01M tối thiểu để hấp thụ hết 0,02mol khí CO2là
A. 1,0 lít.
B. 1,5 lít.
C. 2,0 lít.
D. 2,5 lít.
Lời giải:
Đáp án A
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Theo PT (1) và (2) thì nCa(OH)2 tối thiểu= 0,5. nCO2= 0,5. 0,02= 0,01 mol
→ V= n/CM= 0,01 / 0,01= 1 lít

