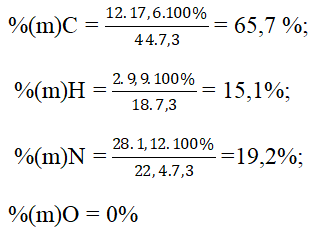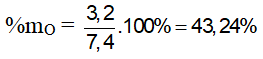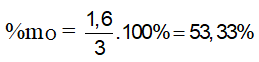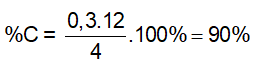Chuyên đề: Đại cương về hóa học hữu cơ - Hoá học lớp 11
Chuyên đề: Đại cương về hóa học hữu cơ
Với Chuyên đề: Đại cương về hóa học hữu cơ Hoá học lớp 11 tổng hợp các dạng bài tập, trên 100 bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Đại cương về hóa học hữu cơ từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.
Tổng hợp Lý thuyết chương Đại cương về hóa học hữu cơ
- Lý thuyết Mở đầu về hóa học hữu cơ Xem chi tiết
- Lý thuyết Công thức phân tử hợp chất hữu cơ Xem chi tiết
- Lý thuyết Cấu trúc phân tử hợp chất hữu cơ Xem chi tiết
- Lý thuyết Phản ứng hữu cơ Xem chi tiết
- Lý thuyết Tên gọi của hợp chất hữu cơ Xem chi tiết
- Lý thuyết Phân loại hợp chất hữu cơ Xem chi tiết
Phương pháp giải các dạng bài tập chương Đại cương về hóa học hữu cơ
- 2 dạng bài tập Đại cương về hóa học hữu cơ trong đề thi Đại học có giải chi tiết
- Dạng 1: Bài tập lý thuyết về hợp chất hữu cơ
- Dạng 2: Dạng bài tập gọi tên hợp chất hữu cơ
- Dạng 3: Các viết đồng phân của hợp chất hữu cơ
- Dạng 4: Xác định công thức hóa học hợp chất hữu cơ
- Dạng 5: Xác định hàm lượng nguyên tố trong hợp chất hữu cơ
Bài tập lý thuyết về hợp chất hữu cơ
Bài 1: Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là:
A. Thường xảy ra rất nhanh và cho một sản phẩm duy nhất.
B. Thường xảy ra chậm, không hoàn toàn, không theo một hướng nhất định.
C. Thường xảy ra rất nhanh, không hoàn toàn, không theo một hướng nhất định.
D. Thường xảy ra rất chậm, nhưng hoàn toàn, không theo một hướng xác định.
Lời giải:
Đáp án: B
Bài 2: Phát biểu nào sau đây không đúng?
A. Trong phân tử hợp chất hữu cơ, cacbon có hóa trị 4 hoặc 2.
B. Việc thay đổi thức tự các liên kết của nguyên tử trong phân tử hữu cơ sẽ làm thay đổi cấu tạo hóa học tạo ra chất mới.
C. Để xác định sự có mặt của nguyên tố halogen trong hợp chất hữu cơ, người ta đốt cháy hợp chất hữu cơ và cho qua dung dịch AgNO3
D. Không thể định lượng trực tiếp nguyên tố oxi trong phân tử hợp chất hữu cơ.
Lời giải:
Đáp án: A
Bài 3: Chất nào sau đây thuộc loại chất hữu cơ ?
A. Al2C4 B. CH4 C. CO D. Na2CO3.
Lời giải:
Đáp án: B
Bài 4: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. Cộng hóa trị B. Ion C. Kim loại D. Hiđro.
Lời giải:
Đáp án: A
Bài 5: Chất nào sau đây trong phân tử có liên kết đôi ?
A. C2H4 B. C2H2 C. C3H8 D. C2H5OH.
Lời giải:
Đáp án: A
Bài 6: Thành phần các nguyên tố trong hợp chất hữu cơ
A. Nhất thiết phải có cacbon, thường có H, hay gặp O, N sau đó đến halogen, S, P,...
B. Gồm có C, H và các nguyên tố khác.
C. Bao gồm tất cả các nguyên tố trong bảng tuần hoàn.
D. Thường có C, H hay gặp O, N, sau đó đến halogen, S, P,...
Lời giải:
Đáp án: A
Bài 7: Cho một số phát biểu về đặc điểm chung của các phân tử hợp chất hữu cơ
1. Thành phần nguyên tố chủ yếu là C và H.
2. Có thể chứa nguyên tố khác như Cl, N, P, O.
3. Liên kết hóa học chủ yếu là liên kết cộng hóa trị.
4. Liên kết hóa học chủ yếu là liên kết ion.
5. Dễ bay hơi, khó cháy.
6. Phản ứng hóa học xảy ra nhanh.
7. Phản ứng xảy ra theo nhiều hướng
Các câu đúng là
A. 1, 2, 5, 6. B. 1, 2, 3, 5. C. 1, 2, 3, 7. D. 1, 2, 4, 6.
Lời giải:
Đáp án: C
Bài 8: Cấu tạo hóa học là
A. Số lượng liên kết giữa các nguyên tử trong phân tử.
B. Số lượng các nguyên tử trong phân tử.
C. Thứ tự liên kết giữa các nguyên tử trong phân tử.
D. Bản chất liên kết giữa các nguyên tử trong phân tử.
Lời giải:
Đáp án: C
Bài 9: Công thức đơn giản nhất của hợp chất hữu cơ là
A. Công thức biểu thị số nguyên tử của mỗi nguyên tố trong phân tử.
B. Công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
C. Công thức biểu thị tỉ lệ về hóa trị của mỗi nguyên tố trong phân tử.
D. Công thức biểu thị tỉ lệ về khối lượng nguyên tố có trong phân tử.
Lời giải:
Đáp án: B
Bài 10: Nung một hợp chất hữu cơ X với lượng dư chất oxi hóa CuO người ta thấy thoát ra khí CO2, hơi H2O và khí N2. Chọn kết luận chính xác nhất trong các kết luận sau :
A. X chắc chắn chứa C, H, N và có thể có hoặc không có oxi.
B. X là hợp chất của 3 nguyên tố C, H, N.
C. Chất X chắc chắn có chứa C, H, có thể có N.
D. X là hợp chất của 4 nguyên tố C, H, N, O.
Lời giải:
Đáp án: A
Bài 11: Mục đích phân tích định tính chất hữu cơ là
A. Tan trong nước, không tan trong dung môi hữu cơ.
B. Nhiệt độ nóng chảy, nhiệt độ sôi cao.
C. Xác định phân tử khối của chất hữu cơ.
D. Xác định các nguyên tố trong phân tử chất hữu cơ.
Lời giải:
Đáp án: D
Bài 12: Mục đích của phân tích định lượng chất hữu cơ.
A. Xác định nhiệt độ sôi của chất hữu cơ.
B. Xác định phần trăm khối lượng các nguyên tố trong phân tử chất hữu cơ.
C. Xác định cấu tạo của chất hữu cơ.
D. Xác định các nguyên tố trong phân tử chất hữu cơ.
Lời giải:
Đáp án: B
Bài 13: Chất nào sau đây có phân tử có liên kết ba ?
A. C2H4 B. C2H2 C. CH4 D. CH3OH.
Lời giải:
Đáp án: B
Bài 14: Chất nào sau đây là hiđrocacbon ?
A. CH2O B. C2H5Br C. C6H6 D. CH3COOH.
Lời giải:
Đáp án: A
Bài 15: Chất nào sau đây là dẫn xuất của hiđrocacbon ?
A. CH4 B. C2H6 C. C6H6 D. C3H6Br.
Lời giải:
Đáp án: D
Xác định công thức hóa học hợp chất hữu cơ
A. Phương pháp giải & Ví dụ minh họa
Xét chất hữu cơ CxHyOz
a. Dựa vào % khối lượng của cac nguyên tố
Bước 1: Đặt CTTQ
Bước 2: Tính số nguyên tử của mỗi nguyên tố CxHyOzNt
- Áp dụng công thức : 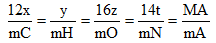
- Tính tỉ lệ số nguyên tử của các nguyên tố
- Khi đề cho % các nguyên tố áp dụng : 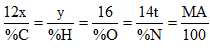
Bước 3: Tính n, suy ra CTPT
*Gợi ý: Tỷ lệ số nguyên tử các nguyên tố phải là tỷ lệ nguyên và tối giản.
- Chỉ số CTĐGN có thể tìm từ:
+ M
+ Dự kiện bài toán
+ Điều kiện hoá trị
b. Theo phương trình phản ứng cháy
Bước 1. Tính MA
Bước 2. Viết phương trình phản ứng cháy
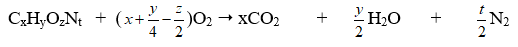
Bước 3. Lập tỷ lệ x:y:z:t
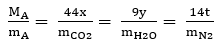
Bước 4. Sau khi biết được x, y, t và M ta suy ra z
Ví dụ minh họa
Bài 1: Phân tích nguyên tố 1 hợp chất hữu cơ A cho kết quả : 70,97 % C , 10,15 % H còn lại là O . Cho biết khối lượng mol phân tử của A là 340 g/mol. Xác định công thức phân tử của A. Hãy giải bài tập trên bằng 2 cách dưới đây
a) Qua công thức đơn giản nhất?
b) Không qua công thức đơn giản nhất ?
Hướng dẫn:
a) Qua CTĐGN:
%mO= 100 - ( 70,97 + 10,15) = 18,88 %
Đặt CTPT của hợp chất là CxHyOz
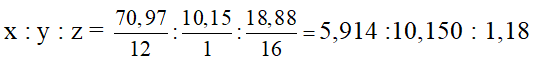
x : y : z = 5 : 9 : 1 → Vậy CTĐGN là C5H9O
ta có : ( C5H9O )n = 340
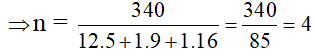
Vậy CTPT hợp chất là C20H36O4
b) Từ %C và %H %O = 18,88%
Đặt CTPT của hợp chất là CxHyOz , MA = 340
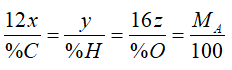
x = 20 , y = 36 , z = 4
Vậy CTPT hợp chất là C20H36O4
Bài 2: Phân tích 0,45 gam hợp chất hữu cơ X (C, H, N), thu được 0,88 gam CO2. Mặt khác , nếu phân tích 0,45 gam X để toàn bộ N trong X chuyển thành NH3 rồi dẫn NH3 vừa tạo thành vào 100ml dung dịch H2SO4 0,4M thu được dung dịch Y. Trung hòa axit dư trong Y cần 70 ml dung dịch NaOH 1M. Biết 1 lít hơi chất X (đktc) nặng 2,009 gam. Công thức phân tử của X là
Hướng dẫn:
nCO2 = 0,88/44 = 0,03 mol; nH2SO4 = 0,04 mol; nNaOH = 0,07 mol
2NH3 + H2SO4 → (NH4)2SO4
2NaOH + H2SO4 → Na2SO4 + 2H2O
2nH2SO4 = nNaOH + nNH3 ⇒ nNH3 = 0,01 mol
MX = 2,009.22,4 = 45
Đặt CTPT của X là CxHyNz
⇒ 0,01x = 0,02 x = 2; 0,01z = 0,01 z = 1
12.2 + y + 1.14 = 45 ⇒ y = 7 ⇒ CTPT là C7H7N
Bài 3: Đốt cháy hoàn toàn 3,61g chất hữu cơ X thu được hỗn hợp khí gồm CO2, H2O và HCl. Dẫn hỗn hợp này qua bình chứa dung dịch AgNO3/HNO3 ở nhiệt độ thấp thấy có 2,87g kết tủa và bình chứa tăng 2,17g. Cho biết chỉ có H2O và HCl bị hấp thụ. Dẫn khí thoát ra vào 100ml dung dịch Ba(OH)2 1M thu được 15,76g kết tủa Y, lọc bỏ Y, lấy dung dịch đem sôi lại có kết tủa nữa.
a. Tính khối lượng các nguyên tố trong hợp chất.
b. Lập công thức phân tử X, biết khối lượng phân tử của X < 200.
Hướng dẫn:
a. nCl = nHCl = nAgCl = 2,87/143,5 = 0,02 mol
Khối lượng Cl trong X: mCl = 0,02.35,5 = 0,71 gam
Khối lượng bình tăng là khối lượng của HCl và H2O: mHCl + mH2O = 2,17 ⇒ mH2O = 2,17 – 0,02.36,5 = 1,44 gam
Khối lượng H trong X là: mH = 1,44.2/18 = 0,16 gam
Dẫn khí thoát ra vào dung dịch Ba(OH)2 thu được kết tủa Y, lọc bỏ Y, lấy dung dịch đem sôi lại có kết tủa nữa ⇒ tạo 2 loại muối là BaCO3 và Ba(HCO3)2
nBaCO3 = 15,76/197 = 0,08 mol; nBa(OH)2 = 0,1 mol ⇒ nBa(HCO3)2 = 0,1 – 0,08 = 0,02 mol
Số mol CO2 là: nCO2 = 0,08 + 0,02.2 = 0,12 mol ⇒ mC = 0,12.12 = 1,44 gam
Khối lượng O trong X là: mO = 3,61 – 1,44 – 0,16 – 0,71 = 1,3 gam
b. Đặt CTPT của hợp chất là CxHyOzClt
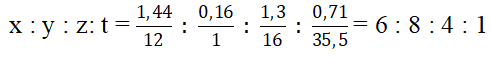
CTĐGN (C6H8O4Cl)n Vì MX < 200 ⇒ CTPT của X là: C6H8O4Cl
Bài 4: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đựng dung dịch Ca(OH)2 dư. Sau thí nghiệm, khối lượng bình (1) tăng 3,6 gam, ở bình (2) có 20 gam kết tủa. Tỉ khối của X đối với hiđro là 30. Xác định công thức của phân tử X.
Hướng dẫn:
Đặt CTPT của X là CxHyOz
MX = 30.2 = 60 ; nCO2 = nCaCO3 = 20/100 = 0,2 mol; nH2O = 3,6/18 = 0,2 mol
nX = 6/60 = 0,1 mol
Bảo toàn nguyên tố C: 0,1.x = 0,2 ⇒ x = 2
Bảo toàn nguyên tố H: 0,1y = 2.0,2 ⇒ y = 4
12.4 + 4.1 + 16z = 60 ⇒ z = 2 ⇒ CTPT: C2H4O2
B. Bài tập trắc nghiệm
Bài 1: Hợp chất X có CTĐGN là CH3O. CTPT nào sau đây ứng với X ?
A. C3H9O3. B. C2H6O2. C. C2H6O. D. CH3O.
Lời giải:
Đáp án: B
Bài 2: Hợp chất X có công thức đơn giản nhất là CH2O. tỉ khối hơi của X so với hiđro bằng 30. Công thức phân tử của X là
A. CH2O B. C2H4O2 C. C3H6O2 D. C4H8O2.
Lời giải:
Đáp án: B
CTPT của X là (CHO)n hay CnH2nOn
MX = 30.2 = 60 (12 + 2.1 + 16)n = 60 ⇒ n = 2 ⇒ CTPT là C2H4O2
Bài 3: Hợp chất X có %C = 54,54% ; %H = 9,1%, còn lại là oxi. Khối lượng phân tử của X bằng 88. CTPT của X là:
A. C4H10O. B. C5H12O. C. C4H10O2. D. C4H8O2.
Lời giải:
Đáp án: D
CTPT là CxHyOz; ta có x : y : z = 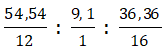
Bài 4: Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X ( C, H, O ). Thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Khi hóa hơi 1,85 gam X, thu được thể tích bằng với thể tích của 0,7 gam N2 cùng nhiệt độ,áp suất. Xác định công thức phân tử của X.
A. C5H10O B. C3H6O2 C. C2H2O3 D. C3H6O.
Lời giải:
Đáp án: B
Đặt CTPT của X là CxHyOz
nX = nN2 = 0,7/28 = 0,025 mol ⇒ MX = 1,85/0,025 = 74
nCO2 = 4,48/22,4 = 0,2 mol ⇒ nH2O = 3,6/18 = 0,2 mol; nX = 7,4/74 = 0,1 mol
Bảo toàn nguyên tố C: 0,1x = 0,3 ⇒ x = 3
Bảo toàn nguyên tố H: 0,1y = 2.0,3 ⇒ y = 6
12.3 + 6.1 + 16z = 74 z = 2 CTPT: C3H6O2
Bài 5: Đốt cháy 200 ml hơi một hợp chất hữu cơ X chứa C, H, O trong 900 ml O2, thể tích hỗn hợp khí thu được là 1,3 lít. Sau khi ngưng tụ hơi nước chỉ còn 700 ml. Tiếp theo cho qua dung dịch KOH dư chỉ còn 100 ml khí bay ra. Các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất. CTPT của Y là:
A. C3H6O B. C3H8O2. C. C3H8O. D. C3H6O2.
Lời giải:
Đáp án: A
CTPT của X có dạng CxHyOz ; VH2O = 600 ml; VCO2 = 600 ml ; VO2 dư = 100 ml ⇒ VO2 pu = 800 ml
Vo(X) = 600 + 600.2 – 800.2 = 200 ml
Ta có x : y : z = 3 : 6 : 1 ⇒ CTPT của X là C3H6O.
Bài 6: Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ X thu được 4,4 gam CO2 và 1,8 gam H2O. Biết tỉ khối của X so với He (MHe = 4) là 7,5. CTPT của X là:
A. CH2O2. B. C2H6. C. C2H4O. D. CH2O.
Lời giải:
Đáp án: D
CTPT của X có dạng CxHyOz ; mO = 3 - (0,1.12 + 0,1.2) = 1,6 gam
x : y : z = 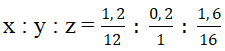
Bài 7: Hợp chất hữu cơ X ( C, H, O N) có công thức trùng với công thức đơn giản nhất, đốt cháy hoàn toàn 7,5 gam X, thu được 4,48 lít CO2; 1,12 lít N2 (các khí đều đo (đktc)) và 4,5 gam H2O. Số nguyên tử hiđro trong một phân tử X là
A. 7 B. 6 C. 5 D. 9.
Lời giải:
Đáp án: C
Đặt CTPT của X là CxHyOzNt
nCO2 = 4,48/22,4 = 0,2 mol; nH2O = 4,5/18 = 0,25 mol; nN2 = 1,12/22,4 = 0,05 mol
nC = nCO2 = 0,2 mol; nH = 2nH2O = 0,5 mol; nN = 2nN2 = 0,1 mol
12.0,2 + 1.0,5 + 14.0,1 + 16nO = 7,5 ⇒ nO = 0,2 mol
x : y : z : t = 0,2 : 0,5 : 0,2 : 0,1 = 2 : 5 : 2 : 1
⇒ Công thức đơn giản nhất là C2H5O2N ⇒ CTPT là C2H5O2N
Bài 8: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 54,54% ; %mH = 9,09% còn lại là oxi. Tỉ khối hơi của X so với CO2 bằng 2. Công thức phân tử của X là
A. C5H12O B. C2H4O C. C3H4O3 D. C4H8O2.
Lời giải:
Đáp án: D
MX = 2.44 = 88. Đặt CTPT của X là CxHyOz
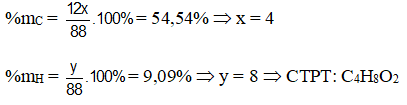
Bài 9: Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đựng dung dịch KOH dư. Sau thí nghiệm, khối lượng bình (1) tăng 1,8 gam, khối lượng bình (2) tăng 6,6 gam. Tỉ khối của X đối với hiđro là 44. Xác định công thức của phân tử X.
A. C2H4O B. C5H12O C. C4H8O2 D. C3H4O3.
Lời giải:
Đáp án: D
Đặt CTPT của X là CxHyOz
MX = 44.2 = 88 ; nCO2 = 6,6/44 = 0,15 mol; nH2O = 1,8/18 = 0,1 mol
nX = 4,4/88 = 0,05 mol
Bảo toàn nguyên tố C: 0,05.x = 0,15 ⇒ x = 3
Bảo toàn nguyên tố H: 0,05y = 2.0,1 ⇒ y = 4
12.3 + 4.1 + 16z = 88 ⇒ z = 3 ⇒ CTPT: C3H4O3
Xác định hàm lượng nguyên tố trong hợp chất hữu cơ
A. Phương pháp giải & Ví dụ minh họa
Cho hợp chất hữu cơ có công thức CxHyOzNt khối lượng a gam
- Áp dụng các công thức tính sau:
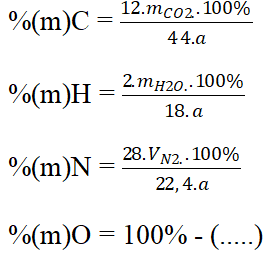
Ví dụ minh họa
Bài 1: Oxi hóa hoàn toàn 0,6 gam hợp chất hữu cơ A thu được 0,672 lit khí CO2 đktc và 0,72 gam H2O. Tính thành phần phần trăm khối lượng của các nguyên tố trong phân tử chất A?
Hướng dẫn:
Oxi hóa A thu được CO2 và H2O ⇒ hợp chất A có C, H có thể có O.
nCO2 = 0,672/22,4 = 0,03 mol; nH2O = 0,72/18 = 0,04 mol
⇒ nC = nCO2 = 0,03 mol; nH = 2nH2O = 0,08 mol;
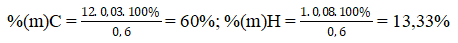
%(m)O = 100% - (60% + 13,33%) = 26,67%
Bài 2: Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm chảy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đụng dung dịch Ca(OH)2 dư, sau thí nghiệm, khối lượng bình (1) tăng 5,4 gam, ở bình (2) có 30 gam kết tủa. Thành phần phần trăm khối lượng oxi trong X là
Hướng dẫn:
nCO2 = nCaCO3 =30/100 = 0,3 mol; nH2O = 5,4/18 = 0,3 mol
mX = mC + mH + mO = 12nCO2 + 2nH2O + mO
⇒ 12.0,3 + 2.0,3 + mO = 7,4 ⇒ mO = 3,2 gam ⇒
Bài 3: Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ X ( C, H, O ). Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 dư. Sau thí nghiệm , thu được 10 gam kết tủa và khối lượng dung dịch giảm 3,8 gam so với dung dịch Ca(OH)2 ban đầu. Thành phần phần trăm khối lượng oxi trong X là
Hướng dẫn:
nCO2 = nCaCO3 = 10/100 = 0,1 mol
mgiảm = mCaCO3 - (mCO2 + mH2O) = 3,8g mCO2 + mH2O = 10-3,8 = 6,2g
mH2O = 6,2 – 0,1.44 = 1,8 (gam) ⇒ nH2O = 1,8/18 = 0,1 mol
mX = mC + mH + mO = 12nCO2 + 2nH2O + mO
12.0,1 + 2.0,1 + mO = 3 ⇒ mO = 1,6 gam ⇒
Bài 4: Đốt cháy hoàn toàn 4 gam hi đrocacbon X. Hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2. Sau thí nghiệm, thu được 25 gam kết tủa và khối lượng dung dịch giảm 8,2 gam so với dung dịch Ca(OH)2.ban đầu. Thành phần phần trăm khối lượng cacbon trong X là
Hướng dẫn:
mgiảm = mCaCO3 - (mCO2 + mH2O) = 8,2g mCO2 + mH2O = 25-8,2 = 16,8g
44nCO2 + 18nH2O = 16,8 (1)
mX = mC + mH = 12nCO2 + 2nH2O = 4 (2)
Từ (1), (2) ⇒ nCO2 = 0,3 mol; nH2O = 0,2 mol ⇒
Bài 5: Oxi hoá hoàn toàn 0,135 g HCHC A rồi cho sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH, thì thấy khối lượng bình 1 tăng lên 0,117 g, bình 2 tăng thêm 0,396 g. Ở thí nghiệm khác, khi nung 1,35 g hợp chất A với CuO thì thu được 112 ml (đktc) khí nitơ. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Hướng dẫn:
Khối lượng bình 1 tăng là khối lượng của H2O
⇒ nH = 2nH2O = 2.0,117/18 = 0,013 mol
Khối lượng bình 2 tăng là khối lượng của CO2
⇒ nC = nCO2 = 0,396/44 = 0,009 mol
Số mol N trong 0,135 gam hợp chất hữu cơ A là :
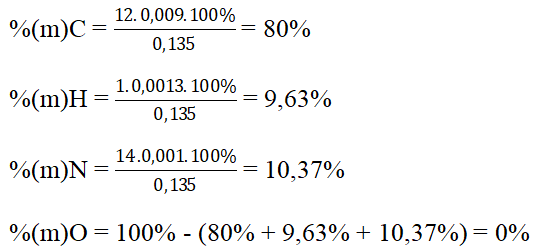
B. Bài tập trắc nghiệm
Bài 1: Nung một hợp chất hữu cơ X với lượng dư chất oxi hóa CuO, thấy thoát ra khí CO2, hơi nước và khí N2. Chọn kết luận đúng nhất.
A. X chắc chắn chứa C, H, N và có thể có oxi.
B. X là hợp chất chỉ chứa 3 nguyên tố C, H, N.
C. X luôn có chứa C, H và có thể không có N.
D. X là hợp chất chứa 4 nguyên tố C, H, N, O.
Lời giải:
Đáp án: A
Bài 2: Để đốt cháy hoàn toàn 2,50 g chất A phải dùng vừa hết 3,36 lít O2 (đktc). Sản phẩm cháy chỉ có CO2 và H2O, trong đó khối lượng CO2 hơn khối lượng H2O là 3,70 g. Phần trăm khối lượng của H trong A là :
A. 11,5%. B. 9%. C. 8% D. 7,8%
Lời giải:
Đáp án: C
mCO2 + mH2O = 2,5 + 0,15.32 = 7,3 gam ; mCO2 – mH2O = 3,7 ⇒ mCO2 = 5,5 gam và mH2O = 1,8 gam ⇒
Bài 3: Đốt cháy hoàn toàn m gam hợp chất hữu cơ X ( C, H, O ). Cần vừa đủ 7,84 lít O2 (đktc), thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Thành phần phần trăm khối lượng oxi trong X là
A. 16,62% B. 45,95% C. 28,85 % D. 43,24%.
Lời giải:
Đáp án: D
nCO2 = 6,72/22,4 = 0,3 mol; nH2O = 5,4/18 = 0,3 mol; nO2 = 7,84/22,4 = 0,35 mol
Theo bảo toàn khối lượng:
mX + mO2 = mCO2 + mH2O ⇒ mX = 0,3.44 + 5,4 – 0,35.32 = 7,4 (gam)
nO(X) + 2nO2 = 2nCO2 + nH2O ⇒ nO(X) = 2.0,3 + 0,3 - 2.0,35 = 0,2 mol
⇒ %mO = 43,24%
Bài 4: Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm chảy lần lượt qua bình (1) đựng dung dịch H2SO4 đặc, bình (2) đụng dung dịch KOH dư, sau thí nghiệm, khối lượng bình (1) tăng 7,2 gam, khối lượng bình (2) tăng 17,6 gam. Thành phần phần trăm khối lượng oxi trong X là
A. 36,36% B. 27,27% C. 40,91% D. 54,54%.
Lời giải:
Đáp án: A
Độ tăng khối lượng bình đựng H2SO4 chính là khối lượng H2O
Độ tăng khối lượng bình đựng dung dịch KOH chính là khối lượng CO2
nCO2 = 17,6/44 = 0,4 mol; nH2O = 7,2/18 = 0,4 mol
mX = mC + mH + mO = 12nCO2 + 2nH2O + mO
⇒ 12.0,4 + 2.0,4 + mO = 8,8 ⇒ mO = 3,2 gam ⇒ %mO =36,36%
Bài 5: Đốt cháy hoàn toàn 1,25g chất Y thu được 0,896 lít CO2 ở đktc và 0,54g H2O. Mặt khác đốt cháy Y cho sản phẩm tác dụng với dung dịch AgNO3 dư thu được 1,435g kết tủa trắng. Các nguyên tố có trong Y và phần trăm của C là:
A. C, H, O, Br; %(m)C = 42,6%. B. C, H, O, Cl; %(m)C = 38,4%
C. C, H, Cl; %(m)C = 38,4%. D. C, H, O, Br; %(m)C = 38,4%
Lời giải:
Đáp án: B
mO = 1,25 – (0,04.12 + 0,03.2 + 0,01.35,5) = 0,355 gam ⇒ các chất có trong Y là C, H, O, Cl; %(m)C = 0,04.12.100%/1,25 = 38,4%
Bài 6: Đốt cháy hoàn toàn m gam hợp chất hữu cơ X ( C, H, O ). Cần vừa đủ 6,72 lít O2 (đktc), thu được 4,48 lít CO2 (đktc) và 5,4 gam H2O. Thành phần phần trăm khối lượng oxi trong X là
A. 34,78% B. 69,56% C. 76,19 % D. 67,71%
Lời giải:
Đáp án: A
nCO2 = 4,48/22,4 = 0,2 mol; nH2O = 5,4/18 = 0,3 mol; nO2 = 6,72/22,4 = 0,3 mol
Theo bảo toàn khối lượng:
mX = 0,2.44 + 5,4 – 0,3.32 = 4,6 (gam)
nO(X) + 2nO2 = 2nCO2 + nH2O ⇒ nO(X) = 2.0,2 + 0,3 - 2.0,3 = 0,1 mol
⇒ %mO = 34,78%
Bài 7: Đốt cháy chất A (chỉ chứa C và H) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng nước vôi dư. Thấy khối lượng bình 1 tăng 5,4g, bình 2 có 60g kết tủa. Phần trăm khối lượng của C và H trong A lần lượt là:
A. 78%, 22%. B. 92,3%, 7,7%. C. 80%, 20%. D. 78,4%, 21,6%
Lời giải:
Đáp án: B
mA = mC + mH = 0,6.12 + 0,3.2 = 7,8 gam ⇒ %(m)C = 7,2.100%/7,8 = 92,3% ⇒%(m)O = 7,75
Bài 8: Đốt cháy 7,3g chất A dẫn toàn bộ sản phẩm qua bình đựng nước vôi dư. Thấy có 1,12 lít khí N2 thoát ra, khối lượng bình tăng 27,5g và khối lượng kết tủa trong bình là 40g. Phần trăm của C, H, O, N lần lượt là:
A.65,7%, 15,1%; 19,2%, 0%. B. 56,4%, 10,4%, 13,1%, 20,1%
C. 69,7%, 9,6%; 20,7%, 0%. D. 59%, 16,4%, 16,5%, 8,2%
Lời giải:
Đáp án: A
mCO2 = 0,4.44 = 17,6 gam ⇒ mH2O = 27,5 – 17,6 = 9,9 gam;