Phương pháp giải các dạng bài tập chương Nhóm Cacbon, Silic - Hoá học lớp 11
Phương pháp giải các dạng bài tập chương Nhóm Cacbon, Silic
Với Phương pháp giải các dạng bài tập chương Nhóm Cacbon, Silic Hoá học lớp 11 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nhóm Cacbon, Silic từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

- 5 dạng bài tập về Cacbon, Silic trong đề thi Đại học có giải chi tiết
- Dạng 1: Bài tập lý thuyết về tính chất hóa học của Cacbon, Silic
- Dạng 2: Bài tập CO2 tác dụng với dung dịch kiềm
- Dạng 3: Bài toán khử oxit kim loại bằng C và CO
- Dạng 4: Các dạng bài tập về muối Cacbonat
- Dạng 5: Các dạng bài tập về Silic và hợp chất
- Bài tập về Axit Cacbonic và Muối cacbonat cực hay, có lời giải chi tiết
- Bài tập về Cacbon monooxit (CO) cực hay, có lời giải chi tiết
- Bài tập về Cacbon (C) cực hay, có lời giải chi tiết
- Bài tập về CO2 cực hay, có lời giải chi tiết
- Bài tập về Silic (Si) và hợp chất của Silic cực hay, có lời giải chi tiết
Bài tập trắc nghiệm
- 70 câu trắc nghiệm Cacbon, Silic có lời giải chi tiết (cơ bản)
- 70 câu trắc nghiệm Cacbon, Silic có lời giải chi tiết (nâng cao)
Bài tập lý thuyết về tính chất hóa học của Cacbon, Silic
Bài 1: Chọn câu trả lời đúng: Trong phản ứng hoá học, cacbon
A. Chỉ thể hiện tính khử.
B. Vừa thể hiện tính khử vừa thể hiện tính oxi hóa.
C. Chỉ thể hiện tính oxi hoá.
D. Không thể hiện tính khử và tính oxi hoá.
Lời giải:
Đáp án: B
Bài 2: Cho các chất: O2 (1),CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 đặc (8), HNO3 (9), H2O (10), KMnO4 (11). Cacbon phản ứng trực tiếp được với bao nhiêu chất?
A. 12. B. 9. C. 11. D. 10
Lời giải:
Đáp án: B
(1) C + O2 → CO2
(2) C + CO2 → 2CO
(3) C + 2H2 −tº→ CH4
(4) Fe2O3 + 3C −tº→ 2Fe + 3CO
(5) 2C + SiO2 −tº→ Si + 2 CO
(7) CaO + 3C → CaC2 + CO (trong lò điện)
(8) C + 2H2SO4 đặc −tº→ CO2 + 2SO2 + 2H2O
(9) C + 4HNO3 đặc −tº→ CO2 + 4NO2 + 2H2O
(10) C + 2H2O → CO2 + 2H2
Bài 3: Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta dùng chất hấp thụ là
A. Đồng (II) oxit và mangan oxit.
B. Đồng (II) oxit và magie oxit.
C. Đồng (II) oxit và than hoạt tính.
D. Than hoạt tính.
Lời giải:
Đáp án: D
Bài 4: CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, CO2 không dùng để dập tắt đám cháy nào dưới đây?
A. Đám cháy do xăng, dầu.
B. Đám cháy nhà cửa, quần áo.
C. Đám cháy do magie hoặc nhôm.
D. Đám cháy do khí ga.
Lời giải:
Đáp án: C
Bài 5: “Nước đá khô” không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là
A. CO rắn. B. SO2 rắn. C. H2O rắn. D. CO2 rắn.
Lời giải:
Đáp án: D
Bài 6: Trong các phản ứng hoá học sau, phản ứng nào sai?
A. SiO2 + 4HF → SiF4 + 2H2O
B. SiO2 + 4HCl → SiCl4 + 2H2O
C. SiO2 + 2C → Si + 2CO
D. SiO2 + 2Mg → 2MgO + Si
Lời giải:
Đáp án: B
Bài 7: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 (nóng) sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al2O3, Cu, MgO, Fe
B. Al, Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe
D. MgO, Al2O3, CuO, Fe2O3
Lời giải:
Đáp án: A
Bài 8: Tính khử của cacbon thể hiện ở phản ứng nào trong số các phản ứng sau
A. 2C + Ca → CaC2 B. C + 2H2 → CH4
C. 3 C + 4 Al → Al4C3 D. C + O2 → CO2
Lời giải:
Đáp án: D
Bài 9: Than được dùng làm chất độn cao su, sản xuất mực in, xi đánh giầy là:
A. Than chì B. Than muội C. Than gỗ D. Than cốc
Lời giải:
Đáp án: B
Bài 10: Câu 10: Cacbonmonooxit có phản ứng với nhóm chất nào sau đây
A. O2, Fe2O3, CuO B. O2, Ca(OH)2, CaO
C. CuO, CuSO4, Cu(OH)2 D. O2 , Al, Al2O3
Lời giải:
Đáp án: A
Bài 11: Silic tác dụng với chất nào sau đây ở nhiệt độ thường
A. O2 B. F2 C. Cl2 D. Br2
Lời giải:
Đáp án: B
Bài 12: Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với:
A. H2SO4 B. HCl C. HNO3 D. HF
Lời giải:
Đáp án: D
Bài 13: Cặp chất nào sau đây không có phản ứng xảy ra
A. CaO và CO2 C. H2CO3 và K2SiO3
B. SiO2 và HCl D. NaOH và CO2
Lời giải:
Đáp án: B
Bài 14: Khí CO2 điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
A. Dung dịch NaOH đặc.
B. Dung dịch NaHCO3 bão hoà và dung dịch H2SO4 đặc.
C. Dung dịch H2SO4 đặc.
D. Dung dịch Na2CO3 bão hoà và dung dịch H2SO4
Lời giải:
Đáp án: B
Bài 15: Khẳng định nào sau đây sai?
A. Tất cả các muối silicat đều không tan (trừ muối của kim loại kiềm, muối amoni)
B. Silicagen là axit silixic mất nước một phần.
C. Axit silixic là axit yếu nhưng mạnh hơn axit cacbonic.
D. Tất cả muối silicat của kim loại kiềm đều bị thủy phân mạnh
Lời giải:
Đáp án: C
Bài 16: CO không khử được các oxit trong nhóm nào sau đây ?
A. Fe2O3, MgO B. MgO, Al2O3
C. Fe2O3, CuO D. ZnO, Fe2O3,
Lời giải:
Đáp án: B
Bài 17: Nhóm nào sau đây gồm các muối không bị nhiệt phân ?
A. CaCO3, Na2CO3, KHCO3
B. Na2CO3, K2CO3, Li2CO3
C. Ca(HCO3)2, Mg(HCO3)2, KHCO3
D. K2CO3, KHCO3, Li2CO3
Lời giải:
Đáp án: B
Bài 18: Phản ứng nào sau đây không đúng ?
A. SiO2 + Na2CO3 −tº→ Na2SiO3 + CO2
B. Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3
C. Si + 2NaOH + H2O → Na2SiO3 + 2H2
D. SiO2 + 2NaOH (loãng) → Na2SiO3 + H2O
Lời giải:
Đáp án: D
Bài tập CO2 tác dụng với dung dịch kiềm
A. Phương pháp giải & Ví dụ minh họa
1. Bài toán thuận:
Cho chất tham gia hỏi sản phẩm.
- Các PTHH của các phản ứng xảy ra
CO2 + OH- → HCO3-
CO2 + 2OH- → CO32- + H2O
Đặt T = nOH- / nCO2 :
+ Nếu T ≤ 1 → tạo muối duy nhất HCO3-
+ Nếu 1 < T < 2 → tạo hỗn hợp hai muối HCO3- và CO32-
+ Nếu T ≥ 2 → tạo muối duy nhất CO32-
- Xác định sản phẩm nào được tạo thành bằng các tính giá trị T.
- Nếu tạo thành hỗn hợp hai muối thường ta giải bằng cách lập hệ PT hoặc sử dụng bảo toàn nguyên tố.
Lưu ý: Có những bài toán không thể tính T. Khi đó phải dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối.
- Hấp thụ CO2 vào NaOH dư (KOH dư) chỉ tạo muối trung hòa Na2CO3 (K2CO3)
- Hấp thụ CO2 vào NaOH chỉ tạo muối Na2CO3, Sau đó thêm BaCl2 vào thấy kết tủa. Thêm tiếp Ba(OH)2 dư vào thấy xuất hiện thêm kết tủa nữa →Tạo cả 2 muối Na2CO3 và NaHCO3
- Chất hấp thụ vào bình NaOH tăng :
m bình tăng = m dd tăng = m chất hấp thụ ( CO2 + H2O có thể có )
Hoặc với TH tác dụng với Ca(OH)2 , Ba(OH)2:
- Hấp thụ CO2 vào nước vôi dư thì chỉ tạo muối CaCO3
- Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, thêm NaOH dư vào thấy có kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2
- Hấp thụ CO2 vào nước vôi trong thấy có kết tủa, lọc bỏ kết tủa rồi đun nóng nước lọc lại thấy kết tủa nữa suy ra có sự tạo cả CaCO3 và Ca(HCO3)2.
- Sự tăng giảm khối lượng dung dịch: Khi cho sản phẩm cháy vào bình Ca(OH)2 hay Ba(OH)2
m bình tăng = m hấp thụ
m dd tăng = m hấp thụ - m kết tủa
m dd giảm = m kết tủa – m hấp thụ
Bài 1: Sục 4,48l khí CO2 (đktc) vào 500ml dd NaOH 0,1M và Ba(OH)2 0,2M. Tính m kết tủa thu được?
Hướng dẫn:
nCO2 = 0,2 mol, nOH- = 0,25 mol, nBa2+ = 0,1 mol
CO2 + 2OH- → CO32- + H2O
0,125 0,25 → 0,125
CO2 + CO32- + H2O → 2HCO3-
0,075 →0,075 → 1,5
nCO32- = 0,05mol
Ba2+ + CO32- → BaCO3
0,05 0,05
⇒ m↓ = 0,05 . 197 = 9,85g
Bài 2: Cho 1,344 lít khí CO2 (đktc) hấp thụ hết vào 2 lít dung dịch X chứa NaOH 0,04M và Ca(OH)2 0,02M thu được m gam kết tủa. Xác định giá trị của m.
Hướng dẫn:
nCO2 = 1,344/22,4 = 0,06 mol;
nNaOH = 0,04.2 = 0,08 mol; nCa(OH)2 = 0,02.2 = 0,04 mol ; nOH- = 0,08 + 0,04.2 = 0,16 mol
T= nOH-/nCO2 = 0,16/0,06 = 8/3 ⇒ tạo ra muối CO2-
Phương trình phản ứng:
CO2 + OH- → CO32-
0,06 0,06 mol
CO32- + Ca2+ → CaCO3↓
0,04 0,04 0,04 mol
Khối lượng kết tủa thu được: m = 0,04.100 = 4 gam
Bài 3: Sục 3,36 lít khí CO2 (đktc) vào 300ml dd Ca(OH)2 0,2M và NaOH 0,3 M thu được m (g) kết tủa và dd Y. Cô cạn dd Y thu được m’( g) chất rắn khan. Tìm m và m’ ?
Hướng dẫn:
nCO2 = 0,15 mol, nOH- = 0,21 mol, nCa2+ = 0,06 mol
CO2 + 2OH- → CO32- + H2O
0,105 0,21 → 0,105
CO2 + CO32- + H2O → 2HCO3-
0,045 → 0,045 → 0,09
nCO32- = 0,06mol
Ca2+ + CO32- → CaCO3
0,06 0,06 0,06
⇒ m↓ = 6g
Dd ⇒ mcrắn = 0,09 . 84 = 7,56g
2. Bài toán nghịch:
VD: Cho x mol CO2 tác dụng với a mol OH- tạo thành b kết tủa ( b mol muối trung hòa). Tìm giá trị x biết a, b.
Giải: Với bài toán này thì chúng ta chú ý đến giá trị a, b.
- Nếu a = 2b thì bài toán rất đơn giản x = b
- Nếu a > 2b thì bài toán có thể có 2 đáp số vì xảy ra 2 trường hợp
+ Trường hợp 1: OH- dư, tức là chỉ xảy ra phản ứng (2) Vậy x= b
+ Trường hợp 2: Xảy ra cả 2 phản ứng (1), (2): Vậy x= a – b
Ví dụ minh họa
Bài 1: Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 1M thu được 6g kết tủa. Lọc kết tủa đun nóng dd lại thấy có kết tủa nữa. Tìm V?
Hướng dẫn:
Dd sau phản ứng ↓ ⇒ có Ca(HCO3)2 taọ thành
BTNT Ca 0,1 = 0,06 + nCa(HCO3)2 ⇒ nCa(HCO3)2 = 0,04 mol
nCO2= nCaCO3 + 2. nCa(HCO3)2 = 0,14 mol
VCO2 = 3,136 l
Bài 2: Cho V lít CO2 ( đktc) tác dụng 500ml dung dịch Ca(OH)2 0,5M tạo thành 10 gam kết tủa . Tính giá trị của V?
Hướng dẫn:
nOH- = 0,25 mol
nCaCO3 = 0,1 mol
TH1: nCO2 = n↓ = 0,1 mol
Thể tích CO2 tham gia phản ứng là: V = 0,1.22,4 = 2,24 lít
TH2: nCaCO3 < nCa(OH)2 ⇒ tạo thành 2 muối của CO32- và HCO3-
nCO2 = 0,25 – 0,1 = 0,15 ⇒ V = 3,36 lit
Vậy giá trị của V là 2,24 lít hoặc 3,36 lít
B. Bài tập trắc nghiệm
Bài 1: Sục khí CO2 vào dd nước vôi trong, hiện tượng xảy ra:
A. Có kết tủa ngay, lượng kết tủa tăng dần qua một cực đại rồi sau đó tan trở lại hết.
B. Một lúc mới có kết tủa, lượng kết tủa tăng dần qua một cực đại rồi lại giảm.
C. Có kết tủa ngay, nhưng kết tủa tan trở lại ngay sau khi xuất hiện.
D. Có kết tủa ngay, lượng kết tủa tăng dần đến một giá trị không đổi.
Lời giải:
Đáp án: A
Bài 2: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào dung dịch nước vôi trong có chứa 0,25 mol Ca(OH)2. Sản phẩm muối thu được sau phản ứng gồm?
A. Chỉ có CaCO3
B. Chỉ có Ca(HCO3)2
C. Cả CaCO3 và Ca(HCO3)2
D. Không có cả 2 chất CaCO3 và Ca(HCO3)2
Lời giải:
Đáp án: A
T = 0,5/0,1 = 5 ⇒ chỉ tạo muối của CO32-
Bài 3: Hấp thụ hoàn toàn 0,672 lít CO2 (đktc) vào 2 lít Ca(OH)2 0,01M thu được m gam kết tủa. Giá trị của m là
A. 1g. B. 1,5g C. 2g D. 2,5g
Lời giải:
Đáp án: A
T = 0,04/0,03 = 4/3 ⇒ tạo 2 muối: Ca(HCO3)2 x mol và CaCO3 y mol
Ta có: x + 2y = 0,03 mol và x + y = 0,02 mol ⇒ x= 0,01 và y = 0,01⇒ m =0,01.100 =1g
Bài 4: Sục 2,24 lít (đktc) CO2 vào 100ml hỗn hợp dung dịch gồm KOH 1M và Ba(OH)2 0,75M. Sau khi khí bị hấp thụ hoàn toàn thấy tạo m gam kết tủa. Tính m
A.19,7g B. 14,775g. C. 23,64g D. 16,745g
Lời giải:
Đáp án: B
T = 0,25/0,1 = 2,5 ⇒ tạo muối của CO32- ⇒ nCO32- = 0,1 mol; nBa2+ = 0,075 mol ⇒mBaCO3 = 0,075. 197 = 14,775 gam
Bài 5: Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 thu được 6g kết tủa. Lọc kết tủa đun nóng dd lại thấy có 4 gam kết tủa nữa. Giá trị của V là:
A. 2,24 lít B. 2,688 lít C.6,72 lít D. 10,08 lít
Lời giải:
Đáp án: B
CO2 tác dụng với Ca(OH)2 tạo 2 loại muối là CaCO3 và Ca(HCO3)2 ; nCaCO3 = 0,06 mol ; nCa(HCO3)2 = 0,04 mol ⇒ nCO2 = 0,06 + 0,04.2 = 0,12 mol ⇒ V = 2,688 lít
Bài 6: Hấp thụ hoàn toàn 27,552 lít (đktc) CO2 vào m gam dd Ba(OH)2 34,2%, phản ứng hoàn toàn thu được 175,33 gam kết tủa. Giá trị m là:
A. 1060 B. 265 C. 530 D. 2120
Lời giải:
Đáp án: C
nCO2 = 27,552/22,4 = 1,23 mol; n↓ = 175,33/197 = 0,89 mol; nOH- = nCO2 + n↓ = 1,23 + 0,89 = 2,12 mol; nBa(OH)2 = 2,12/2 = 1,06 mol ⇒ mdd = 1,06.171.100/34,2 = 530 gam.
Bài 7: A là hh khí gồm CO2 , SO2. dA/ H2 = 27. Dẫn a mol hh khí A qua bình đựng 1 lít dd NaOH 1,5aM. Sau phản ứng cô cạn cẩn thận dd thu được m (g) muối khan. Tìm m theo a?
A. 80a B. 105a C. 94a D. 103a
Lời giải:
Đáp án: B
Gọi CT chung của 2 oxit MO2 → MMO2 = 54 ⇒ M = 22
PP nối tiếp
MO2 + 2NaOH → Na2MO3 + H2O
0,75a 1,5a → 0,75a
MO2 + Na2CO3 + H2O → 2NaHCO3
0,25a → 0,25a
Sau phản ứng
⇒ m = 0,5a . (46 + 22 + 48) + 0,5a . (24+22+48) = 105a
Bài 8: Sục V lít CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1M và NaOH 1M. Sau phản ứng thu được 19,7 gam kết tủa. Giá trị của V là
A. 2,24 hoặc 4,48 B. 2,24 hoặc 11,2
C. 6,72 hoặc 4,48 D. 5,6 hoặc 11,2.
Lời giải:
Đáp án: B
Trường hợp 1: CO2 hết, Ba(OH)2 dư ⇒ V = 2,24 lít
Trường hợp 2: CO2 hết, Ba(OH)2 hết
⇒ V = 11,2 lít
Bài toán khử oxit kim loại bằng C và CO
A. Phương pháp giải & Ví dụ minh họa
M2On + nCO −tº→ 2M + nCO2↑
- Sử dụng định luật bảo toàn nguyên tố C để giải toán kết hợp với định luật bảo toàn khối lượng.
moxit KL + mCO = mKL + mCO2
→ nO(Oxit) = nCO = nCO2 và moxitKL = mKL + mO
Chú ý: Đốt cháy Cacbon bởi oxi: Có 2 trường hợp
+) Nếu thừa oxi: C + O2 → Hỗn hợp khí sau phản ứng gồm CO2 và O2 (dư).
+) Nếu thiếu oxi: C + O2 → Hỗn hợp khí sau phản ứng gồm CO2 và CO dư.
Ví dụ minh họa
Bài 1: Khử 16g hỗn hợp các oxit kim loại: FeO, Fe2O3, Fe3O4, CuO, PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 g. Tính thể tích khi CO đã tham gia phản ứng (đktc)
Hướng dẫn:
Áp dụng ĐLBT khối lượng
nCO2 = nCO = x mol
moxit + mCO = mCR + mCO2
16 + 28x = 11,2 + 44x ⇒ x=0,3
⇒ VCO = 6,72 lit
Bài 2: Dẫn một luồng khí CO dư qua ống sứ đựng Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Tính tổng khối lượng 2 oxit trong hỗn hợp đầu.
Hướng dẫn:
Phương trình phản ứng:
4CO + Fe3O4 → 4CO2↑ + 3Fe
CO + CuO → CO2↑ + Cu
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 5/100 = 0,05 mol
Áp dụng định luật bảo toàn nguên tố C ta có: nCO = nCO2 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng ta có: moxit kl + mCO = mkl + mCO2
⇒ moxit kl = 2,32 + 0,05.44 – 0,05,28 = 3,12 gam
Bài 3: Khử hoàn toàn 32,20 gam hỗn hợp gồm CuO, Fe2O3 và ZnO bằng CO ở nhiệt độ cao thu được 25,00 gam hỗn hợp X gồm 3 kim loại. Cho X tác dụng vừa đủ với dung dịch HNO3 thì thu được V lít khí NO duy nhất (đktc) và dung dịch chứa m gam muối (không chứa NH4NO3). Tính thể tích khí NO thoát ra và m gam muối thu được
Hướng dẫn:
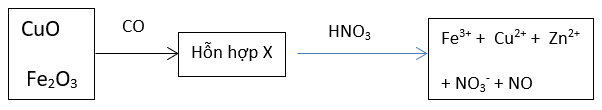
Ta có: nCO = nCO2 = x mol
Áp dụng định luật bảo toàn khối lượng : moxit kl + mCO = mkl + mCO2
⇔ 32,2 + 28x = 25 + 44x ⇒ x = 0,45 mol
Trong quá trình phản ứng chỉ có sự thay đỏi số oxi hóa của C và N.
Phương trình cho nhận e: C+2 - 2e → C+4 ; N+5 + 3e → N+2
Áp dụng bảo toàn e cho toàn quá trình ta có: 0,45.2 = 3.nNO ⇒ nNO = 0,3 mol
Vậy thể tích khí NO thu được là V = 0,3.22,4 = 6,72 lít
nNO3- tạo muối = 3nNO = 0,3.3 = 0,9 mol
Khối lượng muối thu được là m = mkl + mNO3- = 25 + 0,9.62 = 80,8 gam.
B. Bài tập trắc nghiệm
- CO khử được các oxit kim loại đứng sau Zn trong dãy hoạt động hóa học.
Bài 1: Trong các phản ứng hoá học sau, phản ứng nào sai?
A. 3CO + Fe2O3 −tº→ 3CO2↑ + 2Fe
B. CO + Cl2 → COCl2
C. 3CO + Al2O3 −tº→ 2Al + 3CO2↑
D. 2CO + O2 −tº→ 2CO2↑
Lời giải:
Đáp án: C
Bài 2: Nhóm gồm các khí đều cháy được (pứ với oxi) là:
A. CO, CO2. B. CO, H2. C. O2, CO2. D. Cl2, CO.
Lời giải:
Đáp án: B
Bài 3: Khí B có tính chất: rất độc, không màu, ít tan trong nước, cháy trong không khí sinh ra chất khí làm đục nước vôi trong. Khí B là:
A. H2. B. CO. C. Cl2. D. CO2.
Lời giải:
Đáp án: B
Bài 4: Dẫn luồng khí CO qua hổn hợp Al2O3, MgO, Fe2O3, CuO (nóng) sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al2O3, MgO, Fe, Cu
B. Al,Fe,Cu,Mg
C. Al2O3, Mg, Fe, Cu
D. Al2O3, MgO, Fe3O4, Cu
Lời giải:
Đáp án: A
Bài 5: Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm
A. MgO, Fe, Cu. B. Mg, Fe, Cu.
C. MgO, Fe3O4, Cu. D. Mg, Al, Fe, Cu.
Lời giải:
Đáp án: A
Bài 6: Cho V lít hỗn hợp khí (ở đktc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng.. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,48 gam. Giá trị của V là
A. 0,448. B. 0,672 C. 0,224. D. 0,560.
Lời giải:
Đáp án: B
nCO + nH2 = nO = mcr giảm/16 = 0,03 mol ⇒ V = 0,03.22,4 = 0,672 lít
Bài 7: Cho luồng khí CO (dư) đi qua 56 gam hỗn hợp X gồm CuO và MgO nung nóng đến khi phản ứng hoàn toàn, thu được 49,6 gam chất rắn. Khối lượng CuO có trong hỗn hợp X là
A. 48 gam. B. 40 gam. C. 16 gam D. 32 gam.
Lời giải:
Đáp án: C
nCuO = nO = ncr giảm = (56-49,6)/16 = 0,4 mol ⇒ mCuO = 0,4.64 = 16 gam
Bài 8: Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít khí CO (ở đktc), sau phản ứng thu được 33,6 gam Fe và 17,92 lít khí CO2 (đktc). Công thức của X và giá trị V lần lượt là
A. Fe3O4 và 17,92. B. Fe3O4 và 8,96
C. FeO và 8,96 D. Fe2O3 và 17,92.
Lời giải:
Đáp án: A
nCO = nCO2 = 0,8 mol ⇒ V = 17,92 lít; Gọi CT của X là: Fe2On; nFe2On = nFe/2 = 33,6/2.56 = 0,3 mol; mFe2On = 33,6 + 44.0,8 – 28.0,8 = 46,4; MFe2On = 46,4/0,3 = 464/3 ⇒ 56.2 + 16n = 464/3 ⇒ n = 8/3. X là Fe3O4
Bài 9: Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 19 gam kết tủa. Giá trị của V là:
A.12,768 B. 2,128 C. 4,256 D. 8,512
Lời giải:
Đáp án: C
nCO = nCO2 = nCaCO3 = 19/100 = 0,19 mol ⇒ V = 0,19.22,4 = 4,256 lít
Bài 10: Khử hoàn toàn m gam Fe2O3 bằng V lít khí CO (vừa đủ) thu được chất rắn C. Hòa tan hoàn toàn chất rắn C thu được bằng dung dịch axit HNO3 thu được 6,72 lít NO (đktc) là sản phẩm khử duy nhất. Giá trị của V là:
A. 6,72 lít B. 8,96 lít C. 10,08 lít D. 11,2 lít
Lời giải:
Đáp án: C
Bảo toàn e cho C, N ta có 2nCO = 3nNO ⇒ nCO = 0,3.3/2 = 0,45 ⇒ V = 10,08 lít

