Tổng hợp Lý thuyết chương Hidrocacbon không no - Hoá học lớp 11
Tổng hợp Lý thuyết chương Hidrocacbon không no
Tài liệu Tổng hợp Lý thuyết chương Hidrocacbon không no Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về chương Hidrocacbon không no từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

- Lý thuyết Tính chất của Anken Xem chi tiết
- Lý thuyết Tính chất của Ankadien Xem chi tiết
- Lý thuyết Tính chất của Ankin Xem chi tiết
- Tóm tắt Lý thuyết về hiđrocacbon không no Xem chi tiết
- Lý thuyết Khái niệm về tecpen Xem chi tiết
Lý thuyết Tính chất của Anken
I. Đồng đẳng, cấu tạo
- Công thức chung: CnH2n (n ≥ 2).
- Tên gọi chung là anken hay olefin.
- Công thức đơn giản nhất là etilen (CH2=CH2).
- Mạch cacbon hở, có thể phân nhánh hoặc không phân nhánh.
- Trong phân tử có 1 liên kết đôi: gồm 1 liên kết σ và 1 liên kết π. Nguyên tử cacbon ở liên kết đôi tham gia 3 liên kết σ nhờ obitan lai hóa sp2, còn liên kết π nhờ obitan p không lai hóa.
- Đặc biệt phân tử CH2=CH2 có cấu trúc phẳng.
- Do có liên kết pi nên khoảng cách giữa hai nguyên tử C=C ngắn lại và nguyên tử cacbon này không thể quay quanh liên kết đôi vì khi quay như vậy liên kết π bị phá vỡ.
II. Đồng phân, danh pháp
1. Danh pháp
* Tên thông thường: Tên ankan – an + ilen
Ví dụ: CH2=CH2: etilen; CH2=CH–CH3: Propilen
* Tên thay thế: gọi tên theo cách sau:
- Chọn mạch chính là mạch C dài nhất có chứa liên kết đôi.
- Đánh số C mạch chính từ phía gần liên kết đôi hơn.
Gọi tên: vị trí nhánh – tên nhánh – tên C mạch chính – vị trí liên kết đôi – en.
CH2=CH-CH2-CH3: But–1–en.
CH3-CH=CH-CH3: But–2–en.
2. Đồng phân
a. Đồng phân cấu tạo
- Đồng phân vị trí liên kết đôi:
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
- Đồng phân mạch cacbon:
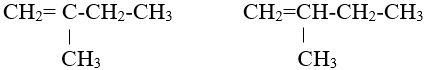
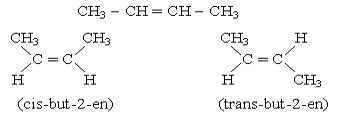
b. Đồng phân hình học
Ví dụ: But-2-en
III. Tính chất vật lý
1. Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng
- Nhiệt độ nóng chảy nhiệt độ sôi tăng dần khi tăng số nguyên tử cacbon trong phân tử: 4 chất đầu là chất khí, các chất có n từ 5 → 18 là chất lỏng, khi n≥19 là chất rắn.
- Các anken đều nhẹ hơn nước.
- Khối lượng riêng của anken không khác nhiều so với ankan và xicloankan có cùng số nguyên tử C.
2. Tính tan và màu sắc
- Đều ít tan trong nước, tan được trong một số dung môi nhưng dễ tan trong các dung môi hữu cơ (rượu, ete, …).
- Các anken không màu.
IV. Tính chất hóa học
1. Phản ứng cộng hiđro (Phản ứng hiđro hoá)
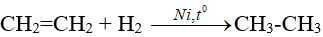
2. Phản ứng cộng halogen (Phản ứng halogen hoá)
CH2=CH2 + Br2 → Br–CH2–CH2–Br
- Anken làm mất màu của dung dịch brom → Phản ứng này dùng để nhận biết anken.
3. Phản ứng cộng nước và axit
- Cộng axit HX.
CH2=CH2 + HCl → CH3CH2Cl
- Đối với các anken khác, nguyên tử halogen (trong HX) mang điện âm, ưu tiên đính vào nguyên tử C bậc cao (theo quy tắc Maccopnhicop).
* Quy tắc Maccopnhicop: Trong phản ứng cộng HX (axit hoặc nước) vào liên kết C=C của anken, H (phần mang điện tích dương) cộng vào C mang nhiều H hơn, X- (hay phần mang điện tích âm) cộng vào C mang ít H hơn.
- Cộng nước:
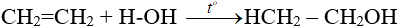
4. Phản ứng trùng hợp

- Phản ứng trùng hợp là quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polime.
- Số lượng mắt xích trong một phân tử polime gọi là hệ số trùng hợp, kí hiệu n.
5. Phản ứng oxi hoá
- Oxi hoá hoàn toàn:
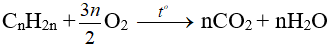
Nhận xét: Đốt anken thu nCO2 = nH2O
- Oxi hoá không hoàn toàn:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
Anken làm mất màu dd KMnO4 → Dùng để nhận biết anken.
V. Điều chế và ứng dụng
1. Điều chế
Trong phòng thí nghiệm:
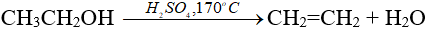
Trong công nghiệp:
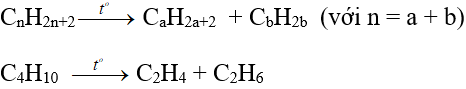
2. Ứng dụng
a. Tổng hợp polime
- Trùng hợp etilen, propilen, butilen người ta thu được các polime để chế tạo màng mỏng, bình chứa, ống dẫn nước, ... dùng cho nhiều mục đích khác nhau.
- Chuyển hoá etilen thành các monome khác để tổng hợp ra hàng loạt polime đáp ứng nhu cầu phong phú của đời sống và kĩ thuật.
Ví dụ:
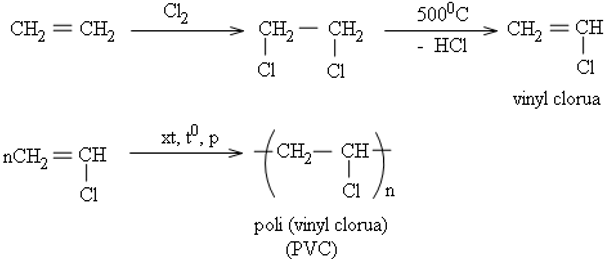
b. Tổng hợp các hoá chất khác
Từ etilen tổng hợp ra những hoá chất hữu cơ thiết yếu như etanol, etilen oxit, etylen glicol, anđehit axetic, ...
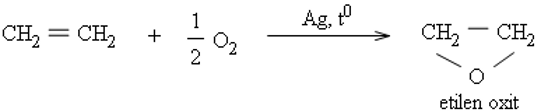
Lý thuyết Tính chất của Ankadien
I. Phân loại
- Hiđrocacbon mà trong phân tử có 2 liên kết đôi C=C gọi là đien, có 3 liên kết đôi C=C gọi là trien, ... Chúng được gọi chung là polien.
- Phân loại:
+ Hai liên kết đôi cạnh nhau: -C=C=C-
+ Ankađien liên hợp: -C=C-C=C-
+ Có hai liên kết đôi cách nhau từ hai liên kết đơn trở lên: -C=C-C-C=C-
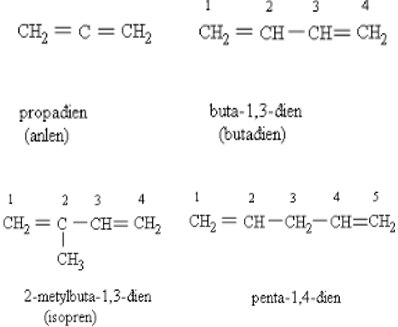
- Đien mạch hở, công thức chung CnH2n-2 (n ≥ 3), được gọi là ankađien.
Quan trọng nhất là các ankadien thuộc hệ liên hợp. Ta xét 2 chất tiêu biểu:
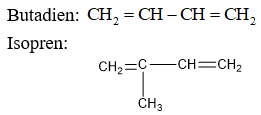
II. Phản ứng của butadien và isopren
1. Phản ứng cộng
- Với hiđrô:
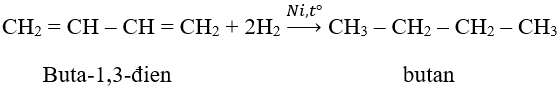
Lưu ý: khả năng cộng 1,2 ở nhiệt độ -80oC và cộng 1,4 ở 40oC.
- Với Brôm:
+ Cộng 1,2:
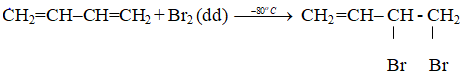
+ Cộng 1,4:
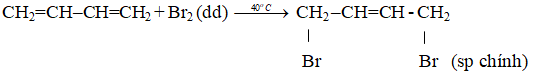
+ Cộng đồng thời vào 2 nối đôi:
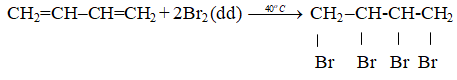
- Với hiđrô halogenua:
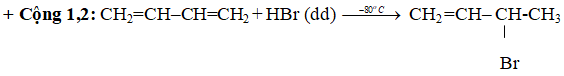
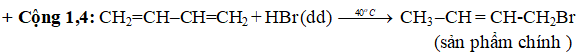
2. Phản ứng trùng hợp
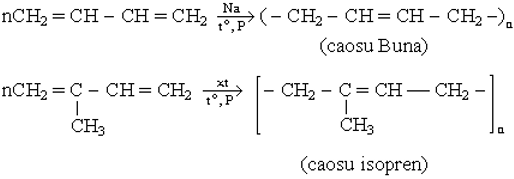
3. Phản ứng oxi hoá
a. Oxi hoá hoàn toàn:
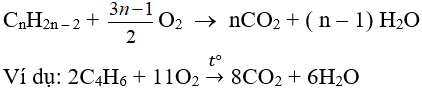
b. Oxi hoá không hoàn toàn:
buta-1,3-dien và isopren cũng làm mất màu dung dịch KMnO4.
III. Điều chế
1. Điều chế butađien: từ butan hoặc butilen.
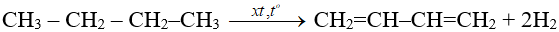
2. Điều chế isopren: