Tổng hợp Lý thuyết chương Đại cương về hóa học hữu cơ - Hoá học lớp 11
Tổng hợp Lý thuyết chương Đại cương về hóa học hữu cơ
Tài liệu Tổng hợp Lý thuyết chương Đại cương về hóa học hữu cơ Hoá học lớp 11 sẽ tóm tắt kiến thức trọng tâm về chương Đại cương về hóa học hữu cơ từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 11.

- Lý thuyết Mở đầu về hóa học hữu cơ Xem chi tiết
- Lý thuyết Công thức phân tử hợp chất hữu cơ Xem chi tiết
- Lý thuyết Cấu trúc phân tử hợp chất hữu cơ Xem chi tiết
- Lý thuyết Phản ứng hữu cơ Xem chi tiết
- Lý thuyết Tên gọi của hợp chất hữu cơ Xem chi tiết
- Lý thuyết Phân loại hợp chất hữu cơ Xem chi tiết
Lý thuyết Mở đầu về hóa học hữu cơ
I. Hợp chất hữu cơ và hóa học hữu cơ
1. Khái niệm
- Hợp chất hữu cơ là các hợp chất của C trừ oxit của C, muối cacbua, muối cacbonat, muối xianua.
- Hoá học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ.
2. Phân loại hợp chất hữu cơ.
Hợp chất hữu cơ được chia thành hidrcacbon và dẫn xuất hidrcacbon.
a/ Hidrcacbon là loại hợp chất hữu cơ đơn giản nhất, trong thành phần phân tử chỉ chứa hai nguyên tố là cacbon và hidro.
- Hidrocacbon mạch hở:
+ Hidrocacbon no: Ankan CH4
+ Hidrocacbon không no có một nối đôi: Anken C2H4
+ Hidrcacbon không no có hai nối đôi: Ankadien
- Hidrocacbon mạch vòng:
+ Hidrocacbon no: xicloankan
+ Hidrocacbon mạch vòng: Aren
b/ Dẫn xuất của hidrocacbon là những hợp chất mà trong phân tử ngoài C, H ra còn có một số hay nhiều nguyên tố khác như O, N, S, halogen...
- Dẫn xuất halogen: R – X ( R là gốc hidrocacbon)
- Hợp chất chứa nhóm chức:
- OH - : ancol; - O - : ete; - COOH: axit......
3/ Đặc điểm chung
- Hợp chất hữu cơ nhất thiết phải chứa C, hay có H thường gặp O ngoài ra còn có halogen, N, P...
- Liên kết chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
- Các hợp chất hữu cơ thường dễ bay hơi, dễ cháy, kém bền nhiệt.
- Các phản ứng trong hoá học hữu cơ thường chậm, không hoàn toàn, xảy ra theo nhiều hướng thường phải đun nóng và có xúc tác.
4/ Các phương pháp tinh chế hợp chất hữu cơ
- Chưng cất: để tách các chất lỏng có nhiệt độ sôi khác nhau nhiều.
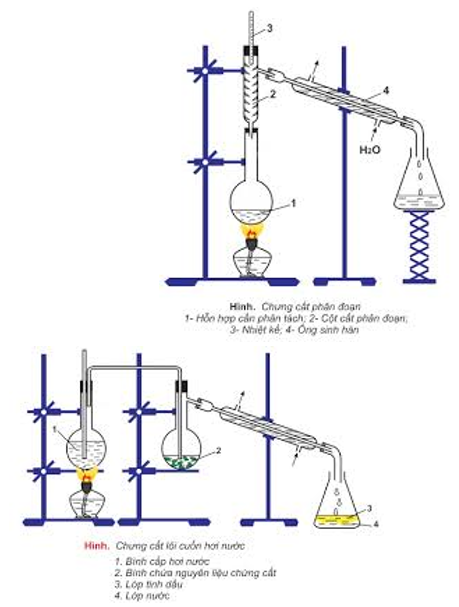
- Chiết: để tách hai chất lỏng không trộn lẫn vào nhau.
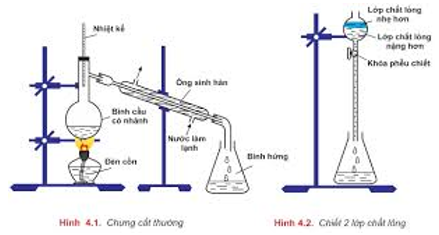
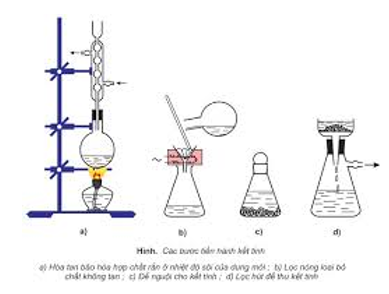
- Kết tinh lại: để tách các chất rắn có độ tan khác nhau theo nhiệt độ.
II. Phân tích nguyên tố
Để xác định công thức phân tử hợp chất hữu cơ người ta phải xác định :
- Thành phần định tính nguyên tố.
- Thành phần định lượng nguyên tố.
- Xác định khối lượng phân tử.
1. Phân tích định tính nguyên tố.
- Phân tích định tính nguyên tố để xác định thành phần các nguyên tố hóa học chứa trong một chất.
- Muốn xác định thành phần các nguyên tố , người ta chuyển các nguyên tồ trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản rồi nhận ra các sản phẩm đó.
a. Xác định cacbon và hidro.
- Nhận Cacbon: Đốt cháy hợp chất hữu cơ:
C −+O2→ CO2 −+Ca(OH)2→ CaCO3
- Nhận Hidro: Đốt cháy hợp chất hữu cơ:
2H −+O2→ H2O −+CuSO4 khan→ CuSO4.5H2O ( màu xanh lam)
- Hoặc có thể dùng chất hút nước mạnh như : H2SO4 đđ, CaCl2 khan, P2O5.
b. Xác định nitơ và oxi.
- Nhận N: Đốt cháy hợp chất hữu cơ, nếu có mùi khét thì hợp chất đó có nitơ.
Hoặc đun hợp chất hữu cơ với H2SO4 đặc ( NaOH đặc) có mùi khai NH3 thì hợp chất đó có chứa nitơ.
CxHyOzNt −+ H2SO4đ, tº→ (NH4)2SO4+......
(NH4)2SO4 + 2NaOH −tº→ Na2SO4 + H2O + NH3↑
- Nhận O : Khó phân tích định tính trực tiếp, thường xác định nhờ định lượng:
mO = mhợp chất – tổng khối lượng các nguyên tố
c. Xác định halogen.
Khi đốt cháy hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng HCl, ta dùng dung dịch AgNO3
HCl + AgNO3 → AgCl↓ + HNO3
2. Phân tích định lượng các nguyên tố:
- Phân tích định lượng các nguyên tố xác định khối lượng của mỗi nguyên tố hóa học chứa trong hợp chất hữu cơ.
- Muốn định lượng nguyên tố, người ta chuyển các nguyên tố trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản, định lượng chúng, từ đó suy ra khối lượng từng nguyên tố có trong một chất.
a. Định lượng cacbon và hidro.
VD: Đốt cháy chất hữu cơ A thu được CO2 và H2O và N2
mC (A) = mC(CO2) = nCO2.12
mH(A) = mH(H2O) = nH2O.2
b. Định lượng nitơ
mN(A) = nN2.28
c. Định lượng oxi
mO = m(A) – ( mC + mH + mN ).
* Chú ý :
- Dùng H2SO4 đặc, P2O5, CaCl2 khan hấp thụ H2O.
- Dùng NaOH, KOH, Ca(OH)2 hấp thụ CO2, độ tăng khối lượng của bình hay khối lượng kết tủa CaCO3 giúp ta tính được CO2
- Chỉ dùng CaO, Ca(OH)2, NaOH hấp thụ sản phẩm gồm CO2 và H2O thì khối lượng bình tăng chính là tổng khối lượng CO2 và H2O.
3. Thành phần nguyên tố:
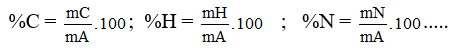
Lý thuyết Công thức phân tử hợp chất hữu cơ
I. Công thức đơn giản nhất
1. Công thức đơn giản nhất (CTĐGN)
- Cho biết số nguyên tử của các nguyên tố trong phân tử.
Cho biết tỉ lệ đơn giản nhất giữa số nguyên tử của các nguyên tố trong phân tử.
Ví dụ: CTĐGN của etilen (CH2)n, của glucozo (CH2O)n (với n là số nguyên dương, chưa xác định).
2. Cách thiết lập CTĐGN
Hợp chất chứa C, H, O có dạng CxHyOz.
* Để lập CTĐGN ta lập:
x : y : z = nC : nH : nO
= mC/12 : mH/1 : mO/16
= %(m)C/12 : %(m)H/1 : %(m)O/16
Sau đó biến đổi thành tỷ lệ tối giản.
II. Thiết lập công thức phân tử
1. Xác định khối lượng mol phân tử
- Đối với chất khí và chất lỏng dễ hóa hơi, người ta xác định khối lượng mol phân tử dựa vào tỉ khối của chúng (ở thể khí) so với chất khí đã biết theo công thức:
MA = MB.dA/B; MA = 29.DA/kk
- Đối với chất rắn và chất lỏng khó hóa hơi, người ta đo độ tăng nhiệt độ sôi của dung dịch so với dung môi và tính được khối lượng mol phân tử của chất tan không bay hơi, không chất điện li.
2. Thiết lập công thức phân tử (CTPT)
Cho biết số nguyên tử của mỗi nguyên tố trong một phần tử hợp chất.
Ví dụ: CTPT của etilen C2H4, glucozo C6H12O6, benzen C6H6. Liên hệ với CTĐGN ở trên, hệ số n đối với etilen: n = 2, với glucozo n = 6.
* Quan hệ giữa CTPT và CTĐGN:
- Số nguyên tử của các nguyên tố trong CTPT là số nguyên lần trong CTĐGN.
- Trong nhiều trường hợp, CTĐGN chính là CTPT.
- Một số chất có CTPT khác nhau, nhưng có cùng CTĐGN.
* Cách lập CTPT hợp chất hữu cơ:
a. Dựa vào thành phần phần trăm khối lượng các nguyên tố
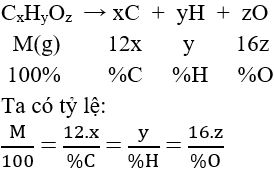
b. Thông qua CTĐGN
Từ CTĐGN ta có CTPT là (CTĐGN)n.
Để xác định giá trị n ta dựa vào khối lượng mol phân tử M.
c. Tính trực tiếp theo khối lượng sản phẩm cháy

Lý thuyết Cấu trúc phân tử hợp chất hữu cơ
I. Thuyết cấu tạo hóa học
1. Nội dung thuyết cấu tạo hóa học
- Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hóa trị và theo một thứ tự nhất định. Thứ tự liên kết đó gọi là cấu tạo hóa học. Sự thay đổi thứ tự liên kết đó, tức là thay đổi cấu tạo hóa học, sẽ tạo ra hợp chất khác.
Ví dụ: Công thức phân tử C2H6O có hai công thức cấu tạo (thứ tự liên kết khác nhau) ứng với 2 hợp chất sau:
H3C−O−CH3: đimetyl ete, chất khí, không tác dụng với Na.
H3C−CH2−O−H: ancol etylic, chất lỏng, tác dụng với Na giải phóng hiđro.
- Trong phân tử hợp chất hữu cơ, cacbon có hóa trị 4. Nguyên tử cacbon không những có thể liên kết với nguyên tử các nguyên tố khác mà còn liên kết với nhau thành mạch cacbon.
Ví dụ:
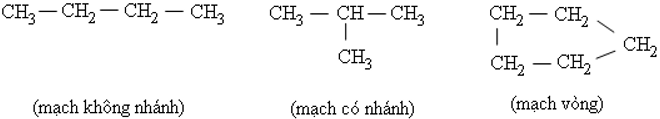
- Tính chất của các chất phụ thuộc vào thành phần phân tử (bản chất, số lượng các nguyên tử) và cấu tạo hóa học (thứ tự liên kết các nguyên tử).
Ví dụ:
- Phụ thuộc thành phần phân tử: CH4 là chất khí dễ cháy, CCl4 là chất lỏng không cháy; CH3Cl là chất khí không có tác dụng gây mê, còn CHCl3 là chất lỏng có tác dụng gây mê.
- Phụ thuộc cấu tạo hóa học: CH3CH2OH và CH3OCH3 khác nhau cả về tính chất hóa học.
2. Đồng đẳng đồng phân
a. Đồng đẳng
- Đồng đẳng là hiện tượng các chất hữu cơ có cấu tạo và tính chất hóa học tương tự nhau nhưng thành phần phân tử khác nhau một hay nhiều nhóm CH2.
- Các chất thuộc cùng dãy đồng đẳng hợp thành một dãy đồng đẳng có công thức chung.
b. Đồng phân
- Đồng phân là các chất hữu cơ có cùng công thức phân tử nhưng cấu tạo khác nhau nên tính chất hóa học khác nhau.
- Cần chú ý phân biệt đồng phân cấu tạo và đồng phân lập thể (đồng phân cis – trans).
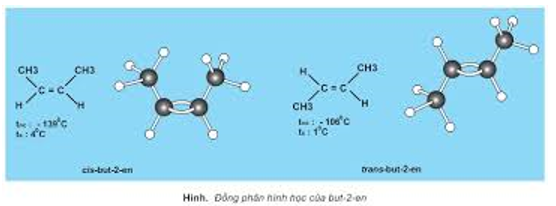
II. Liên kết trong phân tử hợp chất hữu cơ
1. Các loại liên kết trong phân tử hợp chất hữu cơ
- Liên kết thường gặp trong hợp chất hữu cơ là liên kết CHT, gồm liên kết σ và liên kết π.
- Sự tổ hợp của liên kết σ và π tạo thành liên kết đôi hoặc ba (liên kết bội).
a. Liên kết đơn (σ)
- Do 1 cặp electron tạo thành, được biểu diễn bằng 1 gạch nối giữa 2 nguyên tử.
- Liên kết σ bền.
b. Liên kết đôi (1 σ và 1 π)
- Do 2 cặp electron tạo thành, được biểu diễn bằng 2 gạch nối giữa 2 nguyên tử.
- Gồm 1σ bền và 1 π kém bền.
c. Liên kết ba (1 σ và 2 π)
- Do 3 cặp electron tạo thành, được biểu diễn bằng 3 gạch nối giữa 2 nguyên tử.
- Gồm 1σ bền và 2 π kém bền.
* Các liên kết đôi và ba gọi là liên kết bội.
- Khi nguyên tử cacbon tham gia liên kết đơn, các obitan nguyên tử hóa trị lai hóa kiểu sp3 (lai hóa tứ diện đều). Góc lai 109’28”.
- Khi nguyên tử cacbon tham gia liên kết đôi, các obitan nguyên tử hóa trị lai hóa kiểu sp2 (lai hóa đều). Góc lai hóa 120º. Ví dụ: Phân tử C2H4.
- Khi nguyên tử cacbon tham gia liên kết 3, các obitan nguyên tử hóa trị lai hóa kiểu sp (lai hóa đường thẳng). Góc lai hóa 180º. Ví dụ: Phân tử C2H2.
2. Các loại công thức cấu tạo
Cho biết trật tự liên kết của các nguyên tử trong phân tử. Khi viết CTCT phải nhất thiết đảm bảo đúng hóa trị của các nguyên tố. Có thể viết CTCT dưới dạng đầy đủ và rút gọn.
- Công thức khai triển: Biểu diễn trên mặt phẳng giấy tất cả các liên kết giữa các nguyên tử.
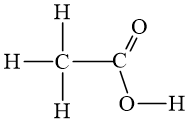
- Công thức CT thu gọn:
* Các nguyên tử hoặc nhóm nguyên tử cùng liên kết với một nguyên tử C được viết thành 1 nhóm.
* Hoặc chỉ biểu diễn liên kết giữa các nguyên tử C và với nhóm chức (mỗi đầu đoạn thẳng hoặc điểm gấp khúc là 1 cacbon, không biếu thị số nguyên tử H liên kết với cacbon).
Ví dụ: Viết công thức cấu tạo của axit axetic.
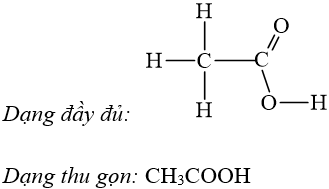
III. Đồng phân cấu tạo
1. Khái niệm đồng phân cấu tạo
Butan−1−ol và đietylete có cùng công thức phân tử C4H10O nhưng do khác nhau về cấu tạo hóa học nên khác nhau về tính chất vật lí và tính chất hóa học.
Vậy những hợp chất có cùng công thức phân tử nhưng có cấu tạo hóa học khác nhau gọi là những đồng phân cấu tạo.
2. Phân loại đồng phân cấu tạo
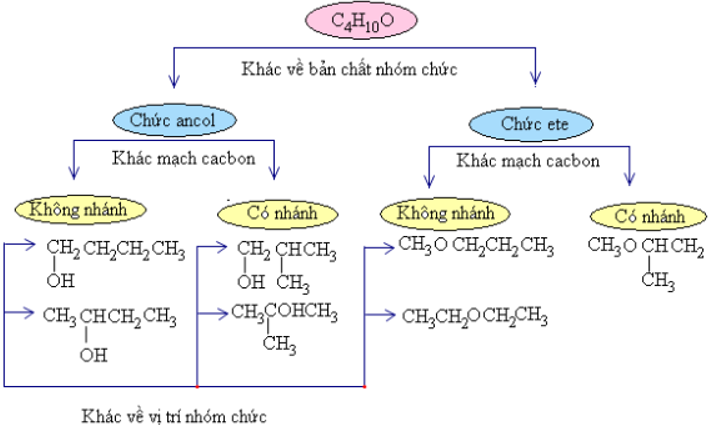
Những đồng phân khác nhau về bản chất nhóm chức gọi là đồng phân nhóm chức. Những đồng phân khác nhau về sự phân nhánh mạch cacbon gọi là đồng phân mạch cacbon. Những đồng phân khác nhau về vị trí nhóm chức gọi là đồng phân vị trí nhóm chức.
IV. Cách biểu diễn cấu trúc không gian phân tử hữu cơ
1. Công thức phối cảnh
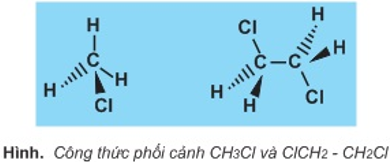
Công thức phối cảnh là một loại công thức lập thể.
Đường nét liền biểu diễn liên kết nằm trên mặt trang giấy.
Đường nét đậm biểu diễn liên kết hướng về mắt ta (ra phía trước trang giấy).
Đường nét đứt biểu diễn liên kết hướng ra xa mắt ta (ra phía sau trang giấy).
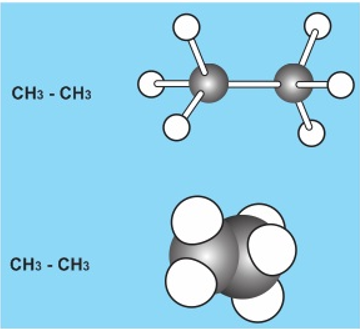
2. Mô hình phân tử
a. Mô hình rỗng
Các quả cầu tượng trưng cho các nguyên tử, các thanh nối tượng trưng cho các liên kết giữa chúng. Góc giữa hai các thanh nối bằng góc lai hóa.
b. Mô hình đặc
Các quả cầu cắt vát tượng trưng cho các nguyên tử được ghép với nhau theo đúng vị trí không gian của chúng.
V. Đồng phân lập thể
1. Khái niệm về đồng phân lập thể
- Ứng với công thức cấu tạo CHCl=CHCl có hai cách sắp xếp không gian khác nhau dẫn tới hai chất đồng phân:
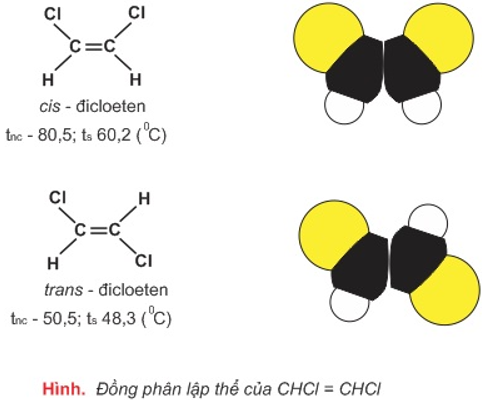
- Kết luận:
- Đồng phân lập thể là những đồng phân có cấu tạo hóa học như sau (cùng công thức cấu tạo) nhưng khác nhau về sự phân bố không gian của các nguyên tử trong phân tử (tức khác nhau về cấu trúc không gian của phân tử).
2. Quan hệ giữa đồng phân cấu tạo và đồng phân lập thể
3. Cấu tạo hóa học và cấu trúc hóa học
- Cấu tạo hóa học cho ta biết các nguyên tử liên kết với nhau theo thứ tự nào, bằng liên kết đơn hay liên kết bội, nhưng không cho biết sự phân bố trong không gian của chúng. Cấu tạo hóa học được biểu diễn bởi công thức cấu tạo.
- Cấu tạo hóa học và cấu trúc không gian của phân tử hợp thành cấu trúc hóa học.
- Cấu trúc hóa học vừa cho biết cấu tạo hóa học vừa cho biết sự phân bố trong không gian của các nguyên tử trong phân tử. Cấu trúc hóa học thường được biểu diễn bởi công thức lập thể.

