Phương pháp giải các dạng bài tập chương Nhóm Nitơ, Photpho - Hoá học lớp 11 - Hoá học lớp 11
Phương pháp giải các dạng bài tập chương Nhóm Nitơ, Photpho - Hoá học lớp 11
Với Phương pháp giải các dạng bài tập chương Nhóm Nitơ, Photpho - Hoá học lớp 11 Hoá học lớp 11 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nhóm Nitơ, Photpho từ đó đạt điểm cao trong bài thi môn Hoá học lớp 11.

- 8 dạng bài tập về Nito, Photpho trong đề thi Đại học có giải chi tiết
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrat
- Dạng 2: Phương pháp nhận biết các chất trong Nhóm Nitơ
- Dạng 3: Viết và cân bằng phương trình hóa học Nhóm Nitơ
- Dạng 4: Các dạng bài tập về Amoni
- Dạng 5: Các dạng bài tập về axit nitric
- Dạng 6: Nhiệt phân muối nitrat
- Dạng 7: Bài tập về axit phophoric
- Dạng 8: Bài tập về phân bón
- Bài tập về Muối Amoniac và Muối Amoni cực hay, có lời giải chi tiết
- Bài tập về Axit Photphoric và Muối Photphat cực hay, có lời giải chi tiết
- Bài tập về Axit Nitric (HNO3) và muối Nitrat cực hay, có lời giải chi tiết
- Bài tập về Nitơ (N2) cực hay, có lời giải chi tiết
- Bài tập về Phân bón hóa học cực hay, có lời giải chi tiết
- Bài tập về Photpho (P) cực hay, có lời giải chi tiết
Bài tập trắc nghiệm
- 100 câu trắc nghiệm Nitơ, Photpho có lời giải chi tiết (cơ bản)
- 150 câu trắc nghiệm Nitơ, Photpho có lời giải chi tiết (nâng cao)
Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrat
Bài 1: Có thể thu được nitơ từ phản ứng nào sau đây ?
A. Đun nóng dung dịch bão hòa natri nitrit với amoni Clorua.
B. Nhiệt phân muối bạc nitrat.
C. Cho bột Cu vào dung dịch HNO3 đặc nóng.
D. Cho muối amoni nitrat vào dung dịch kiềm.
Lời giải:
Đáp án: A
Bài 2: Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do
A. trong phân tử N2 có liên kết ba rất bền.
B. trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết.
C. nguyên tử nitơ có độ âm điện kém hơn oxi.
D. nguyên tử nitơ có bán kính nhỏ.
Lời giải:
Đáp án: A
Bài 3: Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là chất oxi hóa ?
A. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. 4NH3 + 5O2 → 4NO + 6H2O
D. 2NH3 + 2 Na → 2NaNH2 + H2
Lời giải:
Đáp án: D
Bài 4: Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là :
A. HCl, O2, Cl2, FeCl5.
B. H2SO4, Ba(OH)2, FeO, NaOH
C. HCl, HNO3, AlCl3, CaO
D. KOH, HNO3, CuO, CuCl2
Lời giải:
Đáp án: A
Bài 5: Trong phòng thí nghiệm người ta điều chế HNO3 từ
A. NH3 và O2
B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc.
D. NaNO2 và HCl đặc.
Lời giải:
Đáp án: C
Bài 6: Cho các phản ứng sau :
Ca3(PO4)2 + 3H2SO4 đặc → 3CaSO4 + 2H3PO4 (1)
Ca3(PO4)2 + 2H2SO4 đặc → 2CaSO4 + Ca(H2PO4)2 (2)
Ca3(PO4)2 + 4H2SO4 đặc → 3 Ca(H2PO4)2 (3)
Ca3(OH)2 + 2H2SO4 đặc → Ca(H2PO4)2 + 2H2O (4)
Những phản ứng xảy ra trong quá trình điều chế supephotphat kép từ Ca(H2PO4)2 là:
A. (2), (3).
B. (1), (3).
C. (2), (4).
D. (1), (4).
Lời giải:
Đáp án: B
Bài 7: Phát biểu nào sau đây không đúng ?
A. Supephotphat kép cố độ dinh dưỡng thấp hơn supephotphat đơn.
B. Nitơ và photpho là hai nguyên tố không thể thiếu cho sự sống.
C. Tất cả các muối nitrat đều bị nhiệt phân hủy.
D. Tất cả các muối đihiđrophotphat đều dễ tan trong nước.
Lời giải:
Đáp án: A
Bài 8: Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa ?
A. ZnS + HNO3(đặc nóng)
B. Fe2O3 + HNO3(đặc nóng)
C. FeSO4 + HNO3(loãng)
D. Cu + HNO3(đặc nóng)
Lời giải:
Đáp án: B
Bài 9: Khi nhiệt phân, nhóm các muối nitrat cho sản phẩm kim loại, khí NO2, O2 là
A. Cu(NO3)2 , Pb(NO3)2.
B. Ca(NO3)2 , Hg(NO3)2, AgNO3.
Lời giải:
Đáp án: D
Bài 10: Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm
A. FeO, NO2, O2.
B. Fe2O3, NO2.
C. Fe, NO2, O2.
D. Fe2O3, NO2 , O2.
Lời giải:
Đáp án: D
Bài 11: Nhận định nào sau đây là sai ?
A. HNO3 phản ứng với tất cả bazơ.
B. HNO3 (loãng, đặc, nóng) phản ứng với hầu hết kim loại trừ Au, Pt.
C. Tất cả các muối amoni khi nhiệt phân đều tạo khí amoniac.
D. Hỗn hợp muối nitrat và hợp chất hữu cơ nóng chảy có thể bốc cháy.
Lời giải:
Đáp án: C
Bài 12: Thành phần chính của quặng apatit là
A. CaP2O7
B. Ca(PO3)2
C. 3Ca(PO4)2.CaF2
D. Ca3(PO4)2
Lời giải:
Đáp án: C
Bài 13: Phát biểu nào sau đây là sai ?
A. Cấu hình electron nguyên tử của photpho là 1s22s22p63s23p6.
B. Photpho chỉ tồn tại ở 2 dạng thù hình photpho đỏ và photpho trắng.
C. Photpho trắng hoạt động mạnh hơn photpho đỏ
D. Ở nhiệt độ thường photpho hoạt động mạnh hơn nitơ.
Lời giải:
Đáp án: B
Bài 14: Phản ứng nào sau đây được sử dụng để điều chế H3PO4 trong phòng thí nghiệm ?
A. P + HNO3 đặc, nóng
B. Ca3(PO4)2 + H2SO4 đặc
C. P2O5 + H2O
D. HPO3 + H2O
Lời giải:
Đáp án: A
Bài 15: Trong công nghiệp, photpho được điều chế từ phản ứng nung hỗn hợp các chất nào sau đây ?
A. Quặng photphorit, đá xà vân và than cốc
B. Quặng photphorit, cát và than cốc
C. Diêm tiêu, than gỗ và lưu huỳnh
D. Cát trắng, đá vôi và sođa
Lời giải:
Đáp án: B
Phương pháp nhận biết các chất trong Nhóm Nitơ
A. Phương pháp giải & Ví dụ minh họa
Lựa chọn những phản ứng có dấu hiệu đặc trưng (sự biến đổi màu, mùi, kết tủa, sủi bọt khí…) để nhận biết.
| STT | Chất cần nhận biết | Thuốc thử | Hiện tượng xảy ra và phản ứng |
| 1 | NH3 (khí) | Quỳ tím ẩm | Quỳ tím ẩm hoá xanh |
| 2. | NH4+ | Dung dịch kiềm (có hơ nhẹ) |
Giải phóng khí có mùi khai: NH4+ + OH- → NH3↑ + H2O |
| 3. | HNO3 | Cu |
Dung dịch hoá xanh, giải phóng khí không màu và hoá nâu trong không khí: 3Cu + 8HNO3 → Cu(NO3)2 + 2NO + 4H2O 2NO + O2 → 2NO2 |
| 4. | NO3- | H2SO4, Cu |
Dung dịch hoá xanh, giải phóng khí không màu và hoá nâu trong không khí: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑+ 4H2O 2NO + O2 → 2NO2↑ |
| 5. | PO43- | Dung dịch AgNO3 |
Tạo kết tủa màu vàng 3Ag+ + PO43- → Ag3PO4↓ |
Ví dụ minh họa
Bài 1: Chỉ dùng một chất khác để nhận biết từng dung dịch sau: NH4NO3, NaHCO3, (NH4)2SO4, FeCl2 và AlCl3. Viết phương trình các phản ứng xảy ra.
Hướng dẫn:
Dùng Ba(OH)2 để nhận biết.
| NH4NO3 | NaHCO3 | (NH4)2SO4 | FeCl2 | AlCl3 | |
| Ba(OH)2 | NH3↑ mùi khai | ↓trắng BaCO3 | NH3↑ mùi khai, ↓trắng BaSO4 | ↓trắng xanh Fe(OH)2 | ↓trắng, kết tủa tan dần Ba(AlO2)2 |
Phương trình phản ứng:
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O
2NaHCO3 + Ba(OH)2 → BaCO3↓ + Na2CO3 + 2H2O
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2↓
2AlCl3 + 3Ba(OH)2 → 3BaCl2 + 2Al(OH)3↓
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O
Bài 2: Mỗi cốc chứa một trong các dung dịch sau: Pb(NO3)2, NH4Cl, (NH4)2CO3, ZnSO4, Na3PO4 và MgSO4. Nhận biết các dung dịch trên và viết phương trình hóa học.
Hướng dẫn:
| Pb(NO3)2 | ZnSO4 | MgSO4 | NH4Cl | (NH4)2CO3 | Na3PO4 | |
| NaOH | ↓ trắng Pb(OH)2, kết tủa tan dần Na2PbO2 | ↓ trắng Zn(OH)2, kết tủa tan dần Na2ZnO2 | ↓trắng Mg(OH)2 | ↑ mùi khai NH3 | ↑ mùi khai NH3 | - |
| HCl | ↓ trắng PbCl2 | - | - | ↑ không màu CO2 |
Phương trình phản ứng:
ZnSO4 + 2NaOH → Zn(OH)2↑ + Na2SO4
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4
Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO3
Pb(OH)2 + 2NaOH → Na2PbO2 + 2H2O
NH4Cl + NaOH → NH3↑+ H2O + NaCl
(NH4)2CO3 + NaOH → 2NH3↑ + 2H2O + Na2CO3
(NH4)2CO3 + HCl → NH4Cl + H2O + CO2↑
Bài 3: Chỉ dùng 1 thuốc thử hãy nhận biết các dd:
a) Na2CO3; (NH4)3PO4; NH4Cl; NaNO3.
b) NH4Cl; (NH4)2SO4; BaCl2; KNO3.
Hướng dẫn:
Lấy mẫu thử đánh số
a/ Cho Ba(OH)2 vào từng mẫu thử
- Na2CO3 có kết tủa trắng BaCO3
- (NH4)3PO4 có khí mùi khai thoát ra và có kết tủa trắng BaSO4
- NH4Cl có khí mùi khai thoát ra NH3
- NaNO3 không có hiện tượng.
b/ Cho Ba(OH)2 vào từng mẫu thử.
- NH4Cl có khí mùi khai thoát ra NH3
- (NH4)2SO4 có khí mùi khai thoát ra và có kết tủa trắng BaSO4
- 2 chất còn lại ko có hiện tượng.
+ Lấy (NH4)2SO4 cho vào 2 chất đó
* Cái nào có kết tủa trắng đó là BaCl2 còn lại là KNO3 không hiện tượng
Bài 4: Chỉ được dùng một kim loại, làm thế nào phân biệt những dung dịch sau đây: NaOH, NaNO3, HgCl2, HNO3, HCl.
Hướng dẫn:
Dùng kim loại Al, cho Al tác dụng lần lượt với các mẫu thử
Nếu có khí màu nâu bay ra là HNO3:
Al + 4HNO3 → Al(NO3)3 + NO↑ + 2H2O
2NO + O2 → 2NO2 (màu nâu)
Nếu có kim loại trắng sinh ra là HgCl2
2Al + 3HgCl2 → 3Hg + 2AlCl3
Có bọt khí bay ra, có kết tủa và tủa tan ra là:
NaOH + 2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Có bọt khí bay ra là HCl
2Al + 6HCl → 2AlCl3 + 3H2↑
Còn lại là NaNO3
B. Bài tập trắc nghiệm
Bài 1: Thuốc thử dùng để nhận biết ion PO43- trong dung dịch muối photphat :
A. Quỳ tím B. Dung dịch NaOH
C. Dung dịch AgNO3 D. Dung dịch NaCl
Lời giải:
Đáp án: C
AgNO3 + PO43- → Ag3PO4↓ + NO3- tạo kết tủa vàng
Bài 2: Hoá chất để phân biệt ba dd riêng biệt: HCl, HNO3, H2SO4:
A. Dùng giấy quỳ tím, dd bazơ
B. Dùng muối tan Ba2+, Cu kim loại
C. Dùng dd muối tan của Ag+
D. Dùng dd phenolphtalein, giấy quỳ tím.
Lời giải:
Đáp án: B
Dùng muối tan Ba2+ tạo tủa trắng là H2SO4: Ba2+ + H2SO4 → BaSO4↓ + 2H+
Dùng Cu kim loại để nhận biết 2 dd còn lại ⇒ thấy khí không màu bị hóa nâu trong không khí là HNO3
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
2NO + O2 → 2NO2 (màu nâu)
Bài 3: Có 4 bình đựng 4 khí NH3, HCl, N2, Cl2 bị mất nhãn. Hóa chất cần dùng để phân biệt 4 bình khí trên là:
A. Quỳ ẩm B. dd Ba(OH)2. C. dd AgCl D. dd NaOH
Lời giải:
Đáp án: A
NH3: quỳ tím hóa xanh; HCl: quỳ tím hóa đỏ; Cl2: quỳ tím hóa đỏ sau mất màu; N2 quỳ tím không đổi màu.
Bài 4: Có thể phân biệt muối amoni với muối khác bằng cách cho nó tác dụng với kiềm mạnh vì khi đó:
A. Muối amoni chuyển thành màu đỏ
B. Thoát ra một chất khí không màu, mùi khai và sốc
C. Thoát ra một chất khí màu nâu đỏ
D. Thoát ra chất khí không màu, không mùi.
Lời giải:
Đáp án: B
Bài 5: Có 4 dd NH4Cl, NH4HCO3, NaNO3, MgCl2. Hóa chất có thể dùng phân biệt 4 dd trên với 1 lượt thử duy nhất là:
A. dd Ca(OH)2 B. dd KOH C. dd Na2SO4 D. dd HCl
Lời giải:
Đáp án: A
Bài 6: Để tách riêng NH3 ra khỏi hỗn hợp gồm N2 , H2, NH3 trong công nghiệp người ta đã:
A. Cho hỗn hợp qua nước vôi trong dư.
B. Cho hỗn hợp qua bột CuO nung nóng.
C. Nén và làm lạnh hỗn hợp để hòa lỏng NH3.
D. Cho hỗn hợp qua dung dịch H2SO4 đặc.
Lời giải:
Đáp án: C
Bài 7: Để phân biệt các dung dịch axit HCl, HNO3, H2SO4 và H3PO4, người ta dùng thêm kim loại nào sau đây ?
A. Cu. B. Na. C. Ba. D. Fe.
Lời giải:
Đáp án: C
Bài 8: Để phân biệt các mẫu phân bón sau : (NH4)2SO4, NH4Cl và Ca(H2PO4)2 cần dùng thuốc thử là
A. dung dịch BaCl2. B. dung dịch Ba(OH)2.
C. dung dịch HCl. D. dung dịch NaOH.
Lời giải:
Đáp án: B
Viết và cân bằng phương trình hóa học Nhóm Nitơ
A. Phương pháp giải & Ví dụ minh họa
- Cân bằng phản ứng oxi hoá - khử theo phương pháp thăng bằng ion – electron cũng phải đảm bảo nguyên tắc: tổng electron mà chất khử cho bằng tổng electron mà chất oxi hoá nhận (như ở phương pháp thăng bằng electron).Chỉ khác là chất oxi hoá, chất khử viết dưới dạng ion.
Cần nhớ: Chất kết tủa (không tan), chất khí (chất dễ bay hơi), chất ít điện li (H2O) phải để dạng phân tử.
- Tuỳ theo môi trường phản ứng là axit, bazơ hoặc trung tính mà sau khi xác định nhường, nhận electron ta phải cân bằng thêm điện tích hai vế.
- Nếu phản ứng xảy ra trong môi trường axit, ta thêm H+ vào vế nào dư oxi, vế còn lại thêm H2O.
- Nếu phản ứng xảy ra trong môi trường bazơ, ta thêm OH- vào vế nào thiếu oxi, vế còn lại thêm H2O.
- Nếu phản ứng xảy ra trong môi trường nước thì nếu tạo axit ta cân bằng như môi trường axit, nếu tạo bazơ ta cân bằng như môi trường bazơ.
- Nhân hệ số cho hai quá trình nhường và nhận electron sao cho: số electron nhường ra của chất khử bằng số electron nhận vào của chất oxi hoá.
- Kiểm tra số nguyên tố ở hai vế.
Ví dụ minh họa
Bài 1: Cân bằng PTHH sau:
Cu + NaNO3 + H2SO4 → Cu(NO3)2 + NO + Na2SO4 + H2O
Hướng dẫn:
| Quá trình oxi hóa: | 3x | Cu → Cu2+ + 2e |
| Quá trình khử: | 2x | NO3- + 3e + 4H+ → NO + 2H2O |
Phương trình dạng ion rút gọn:
3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
Phương trình dạng phân tử:
3Cu + 8NaNO3 + 4H2SO4 → 3Cu(NO3)2 + 2NO + 4Na2SO4 + 4H2O
Bài 2: Hoàn thành các phương trình hóa học giữa các chất sau.cho biết phản ứng nào thể hiện tính oxi hóa mạnh?phản ứng thể hiện tính axit.
a) HNO3 + NaOH
b) HNO3(l) + CuO
c) HNO3(l) + FeCO3
d) HNO3(đặc,nóng) + S
e) HNO3(đặc nóng) + Fe(OH)2
Hướng dẫn:
a) HNO3 + NaOH → NaNO3 + H2O
b) 2HNO3 + CuO → Cu(NO3)2 + H2O
c) 10HNO3 loãng + 3FeCO3 → 3Fe(NO3)3 + 3CO2 + NO + 5H2O
d) 6HNO3 đặc + S −tº→ H2SO4 + 6NO2 + 2H2O
e) 4HNO3 đặc + Fe(OH)2 −tº→ Fe(NO3)3 + NO2 + 3H2O
- PƯ thể hiện tính acid của HNO3: a, b.
- PƯ thể hiện tính OXH của HNO3: c, d, e.
B. Bài tập trắc nghiệm
Bài 1: Cho các phản ứng sau :
(1) Cu(NO3)2 −tº→ (2) NH4NO2 −tº→
(3) NH3 + O2 −tº→ (4) NH3 + Cl2 −tº→
(5) NH4Cl −tº→ (6) NH3 + CuO −tº→
Trong các phản ứng trên, những phản ứng tạo ra khí N2 là
A. (2),(4),(6). B. (3),(5),(6).
C. (1),(3),(4). D. (1),(2),(5).
Lời giải:
Đáp án: A
(2) NH4NO2 −tº→ N2 + 2H2O
(4) 2NH3 + 3Cl2 → N2 + 6HCl
(6) NH3 + CuO −tº→ Cu + N2 + H2O7
Bài 2: Cho các phản ứng sau :
(1) NH4Cl −tº→ (2) NH4NO3 −tº→
(3) NH4NO2 + NaOH −tº→ (4) Cu + HCl + NaNO3 −tº→
(5) (NH4)2CO3 −tº→
Trong các phản ứng trên, số phản ứng tạo thành khí NH3 là
A. 2. B. 3. C. 4. D. 5.
Lời giải:
Đáp án: B
(1) NH4Cl −tº→ NH3 + HCl
(3) NH4NO2 + NaOH −tº→ NaNO2 + NH3 + H2O
(5) (NH4)2CO3 −tº→ 2 NH3 +CO2 + H2O
Bài 3: Cho 2 muối X, Y thỏa mãn điều kiện sau:
X + Y → không xảy ra phản ứng.
X + Cu → không xảy ra phản ứng.
Y + Cu → không xảy ra phản ứng.
X +Y + Cu → xảy ra phản ứng.
X và Y là:
A. Mg(NO3)2 và KNO3 B. Fe(NO3)3 và NaHSO4.
C. NaNO3 và NaHCO3 D. NaNO3 và NaHSO4.
Lời giải:
Đáp án: D
Bài 4: Cho sơ đồ chuyển hóa : P2O5 −+KOH→ X −+H2PO4→ Y −+KOH→ Z.
Các chất X, Y, Z lần lượt là:
A. KH2PO4, K2HPO4, K3PO4 B. KH2PO4, K3PO4, K2HPO4
C. K3PO4, KH2PO4, K2HPO4 D. K3PO4, K2HPO4, KH2PO4
Lời giải:
Đáp án: C
Bài 5: Trong các phản ứng sau, phản ứng nào NH3 đóng vai trồ là chất oxi hóa ?
A. 2NH3 + H2O2 +MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. 4NH3 + 5O2 → 4NO + 6H2O
D. 2NH3 + 2 Na → 2NaNH2 + H2
Lời giải:
Đáp án: D
Bài 6: Tính tổng hệ số cân bằng của phản ứng sau:
Al + NaNO3 + NaOH + H2O → NaAlO2 + NH3
A. 29 B. 25 C. 21 D. 18
Lời giải:
Đáp án: A
8Al + 3NaNO3 + 5NaOH + 2 H2O → 8NaAlO2 + 3NH3
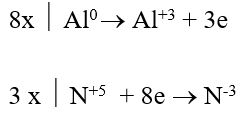
Bài 7: Cho Mg tác dụng với dd HNO3 loãng tạo khí N2O (là sản phẩm khử duy nhất). Tổng các hệ số trong phương trình hoá học là:
A. 18 B. 13 C. 24 D. 10
Lời giải:
Đáp án: C
4Mg + HNO3 → 5H2O + 4Mg(NO3)2 + N2O

